胸腔鏡切除術(shù)后組織EGFR和IGF-1R蛋白表達與胸腺瘤患者化療預(yù)后的關(guān)系分析
朱 銘 黃玉婷 鄒文蕙 趙吉星 李勇生
1.廣東省惠州市中心人民醫(yī)院胸心外科,廣東惠州 516000;2.廣東省惠州市中心人民醫(yī)院腫瘤放療科,廣東惠州 516000
胸腺瘤是前上縱隔原發(fā)性腫瘤之一,并非我國高發(fā)性腫瘤。WHO組織學(xué)類型A型AB型及B1型,通常被認(rèn)為是良性腫瘤或是低度惡性潛能性腫瘤,病程進展緩慢[1]。即便如此,也不能忽略其具有進展為惡心腫瘤的潛能。放射治療是一種通過損傷腫瘤細胞DNA,進而使細胞周期停止、細胞老化凋亡的治療方式,同時胸腺瘤治療的重要方法之一,尤其是對于具備高危風(fēng)險因素者[2-4]。臨床發(fā)現(xiàn),腫瘤細胞較普通細胞有更強的耐受性,并且受損的腫瘤細胞DNA通常得到修復(fù)[5]。隨著分子生物學(xué)技術(shù)的廣泛應(yīng)用,腫瘤細胞具有更強耐受性的分子生物學(xué)機制被揭示,目前EGFR和IGF-1R所主導(dǎo)的抵抗性機制,以成為臨床研究腫瘤研究的重點與熱點[6-7]。為此,我院開展胸腔鏡切除術(shù)后組織EGFR和IGF-1R蛋白表達與胸腺瘤患者化療預(yù)后的關(guān)系分析研究,旨在探討胸腺瘤組織中EGFR和IGF-1R蛋白表達對患者化療預(yù)后的影響。現(xiàn)報道如下。
1 資料與方法
1.1 一般資料
選取2014年7月~2017年7月我院收治50例胸腺瘤患者作為研究對象。所有病例均經(jīng)術(shù)后病理證實為胸腺瘤。男20例,女30例;年齡32~65歲,平均(56.31±6.15)歲;腫瘤直徑2.60~6.20cm,平均(4.61±1.56)cm;臨床病理分期[8]:MasaokaⅠ期14例,Ⅱ期16例,Ⅲ期12例,Ⅳ期8例。WHO組織學(xué)類型:A型3例,AB型4例,B1型14例,B2型21例,B3型8例。合并單純紅細胞再生障礙性貧血11例、重癥肌無力8例、多發(fā)性肌炎4例、再生障礙性貧血3例。
1.2 納入標(biāo)準(zhǔn)與排除標(biāo)準(zhǔn)
1.2.1 納入標(biāo)準(zhǔn) (1)術(shù)后病理證實為胸腺瘤。(2)具有完整的臨床病理資料和隨訪資料。(3)初治患者。(4)知情且簽署知情同意書。
1.2.2 排除標(biāo)準(zhǔn) (1)異位胸腺瘤。(2)其他惡性腫瘤病史。(3)妊娠期、哺乳期婦女。
1.3 方法
所有病例均先行胸腺瘤完整或部分切除術(shù),單純胸腺瘤病例行標(biāo)準(zhǔn)的胸腺切除術(shù),合并重癥肌無力病例行胸腺擴大切除術(shù),周圍組織粘連或腫瘤巨大病例行腫瘤完整切除。胸腔鏡切除術(shù)術(shù)畢,行組織取材,組織經(jīng)10%福爾馬林液固定,石蠟包埋,4μm厚切片,應(yīng)用免疫組化EnVision兩步法檢測50例胸腺瘤組織中EGFR和IGF-1R的表達。EGFR標(biāo)記采用鼠抗人單克隆抗體EGFR(北京中杉金橋生物公司,工作液);IGF1R標(biāo)記兔抗人多克隆抗體IGF1R(北京中杉金橋生物公司,濃縮液)。用磷酸鹽緩沖液代替一抗作為陰性對照,用已知陽性切片作陽性對照。再行三維適形放射治療,直線加速器(西門子(中國)有限公司,PRIMUS H),照射野大小依術(shù)前CT或術(shù)中所描述的腫瘤范圍而定,照射方式以前后對穿照射及兩前斜野照射為主,6MV-X射線照射,常規(guī)放療劑量為40~60Gy,常規(guī)分割1.80~2.00Gy/次,5次/周。隨訪:患者出院后每6個月復(fù)診復(fù)查胸部CT,通過電話或門診隨訪等途徑收集患者生存及復(fù)發(fā)狀況。
1.4 結(jié)果判斷[9]
由兩位經(jīng)驗豐富的病理科醫(yī)師采用雙盲法進行結(jié)果判斷。EGFR蛋白定位于腫瘤性上皮細胞的細胞膜,陽性細胞呈黃色或棕褐色;IGF-1R蛋白定位于腫瘤性上皮細胞的細胞膜或細胞質(zhì),陽性細胞呈黃色或棕褐色。光學(xué)顯微鏡隨機觀察10個400倍視野,每個視野計數(shù)100個細胞,觀察染色強度和陽性細胞數(shù)。染色強度積分:基本無著色為0分,淡黃色為1分,棕黃色為2分,棕褐色為3分;陽性細胞所占百分?jǐn)?shù)積分:陽性細胞≤5%為0分,6%~25%為1分,26%~50%為2分,>50%為3分。染色強度積分×陽性細胞所占百分?jǐn)?shù)積分>2分判定為陽性,≤2判定為陰性。
1.5 統(tǒng)計學(xué)處理
所有數(shù)據(jù)均經(jīng)SPSS20.0統(tǒng)計學(xué)軟件進行統(tǒng)計學(xué)分析。采用Kaplan-Meier繪制生存曲線,并采用log-rank檢驗分析IGF-1R和EGFR是否陽性對患者3年總生存率、3年無復(fù)發(fā)生存率的影響,P<0.05為差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 胸腺瘤組織中EGFR和IGF-1R表達的檢測結(jié)果
EGFR的陽性表達率為52.00%(26/50),IGF-1R的陽性表達率為56.00%(28/50)。見表1。
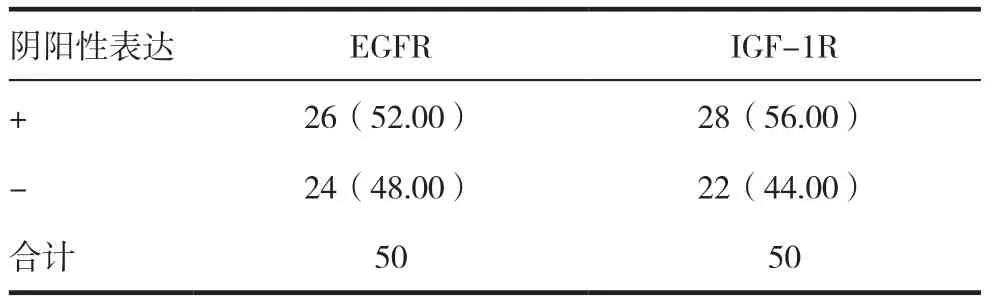
表1 EGFR和IGF-1R表達的檢測結(jié)果[n(%)]
2.2 IGF-1R和EGFR是否陽性表達對患者3年總生存率的影響
EGFR陽性表達病例的3年總生存率為69.23%(18/26),EGFR陰性表達病例的3年總生存率為95.83%(23/24),兩者比較差異有統(tǒng)計學(xué)意義(χ2=21.342,P< 0.05);IGF-1R 陽性表達病例的3年總生存率為67.85%(19/28),IGF-1R陰性表達病例的3年總生存率為100.00%(22/22),兩者相比差異有統(tǒng)計學(xué)意義(χ2=24.411,P<0.05)。見圖1。
2.3 IGF-1R和EGFR是否陽性表達對患者3年無復(fù)發(fā)生存率的影響
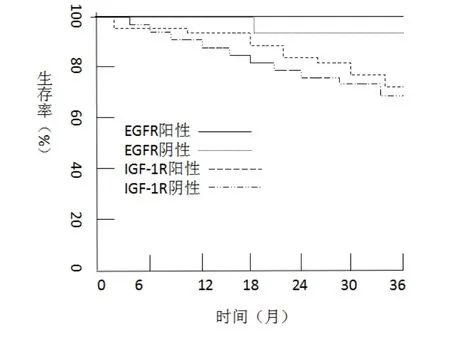
圖1
EGFR陽性表達病例的3年無復(fù)發(fā)生存率為53.84%(14/26),EGFR陰性表達病例的3年無復(fù)發(fā)生存率為91.66%(22/24),兩者相比差異有統(tǒng)計學(xué)意義(χ2=28.593,P<0.05);IGF-1R陽性表達病例的3年總生存率為53.57%(15/28),IGF-1R陰性表達病例的3年無復(fù)發(fā)生存率為95.45%(21/22),兩者比較差異有統(tǒng)計學(xué)意義(χ2=47.218,P<0.05)。見圖2。
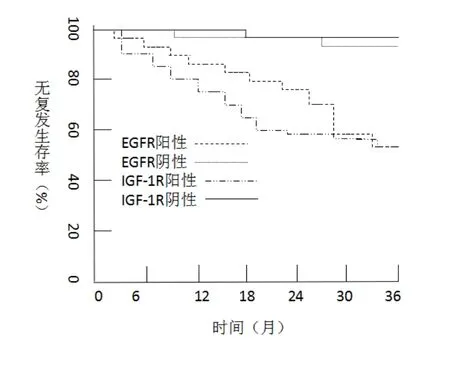
圖2
3 討論
EGFR是I型酪氨酸蛋白激酶,具有配體誘導(dǎo)的活性,是ErbB受體家族的成員之一,基因定位于人染色體7p13-p12之上。IGF-1R是胰島素樣生長因子家族的成員之一,一種糖蛋白跨膜受體。文獻報道胸腺瘤中EGFR和IGF-1R的陽性表達率分別為50.80%、55.60%。本研究胸腺瘤組織中EGFR和IGF-1R的陽性表達率分別為52.00%、56.00%,與文獻報道相仿[10]。
既往研究發(fā)現(xiàn),EGFR和(或)IGF-1R過度表達均可干擾細胞核正常轉(zhuǎn)錄,引起一系列的生物學(xué)行為,進而促進腫瘤的浸潤和轉(zhuǎn)移[11-13]。新近一項研究發(fā)現(xiàn),EGFR陽性表達率隨著腫瘤Masaoka分期進展而增高,說明EGFR蛋白表達與腫瘤Masaoka分期不完全吻合,MasaokaⅠ期病例可能是EGFR陽性表達,MasaokaⅣ期也可能是EGFR陰性表達;在同一項研究中發(fā)現(xiàn),IGF-1R陽性表達率與腫瘤Masaoka分期也有類似的線性關(guān)系[10]。眾多研究指出胸腔鏡切除術(shù)后輔以放射治療并不能改善胸腺瘤患者的生存情況,但可其復(fù)發(fā)情況,研究者將胸腺瘤放射治療預(yù)后不良的原因歸結(jié)于臨床病理特征[14]。綜上,本研究有不同的歸因,認(rèn)為EGFR和IGF-1R所主導(dǎo)的抵抗性機制,在其中發(fā)揮了重要的作用。
本研究結(jié)果提示,EGFR陽性表達病例的3年總生存率顯著低于EGFR陰性表達病例(P<0.05);IGF-1R陽性表達病例的3年總生存率顯著低于EGFR陰性表達病例(P<0.05);EGFR陽性表達病例的3年無復(fù)發(fā)生存率顯著低于EGFR陰性表達病例(P<0.05);IGF-1R陽性表達病例的3年無復(fù)發(fā)生存率顯著低于EGFR陰性表達病例(P<0.05)。說明,EGFR和IGF-1R陽性表達對胸腺瘤患者化療預(yù)后產(chǎn)生不利影響,存在EGFR和IGF-1R陽性表達的胸腺瘤患者往往預(yù)后不佳。我們認(rèn)為這種結(jié)局的形成是因為EGFR和IGF-1R均可激活PI3K/AKT通路修復(fù)放射治療等造成的DNA損傷,故對放射治療產(chǎn)生抵抗性。同時,EGFR和IGF-1R并不止存在單一的線性關(guān)系,兩者信號通路之間一并存在cross-talk現(xiàn)象或是協(xié)同作用。Liang等[15]研究者有過類似報道,其在研究中指出腫瘤細胞中的EGFR蛋白表達水平與放射治療的預(yù)后密切相關(guān),EGFR蛋白表達水平與腫瘤細胞對放射的敏感性呈負相關(guān),EGFR蛋白表達水平與腫瘤細胞對放射的抵抗性呈正相關(guān)關(guān)系。
綜上所述,胸腺瘤組織中存在EGFR和IGF-1R陽性表達的患者往往預(yù)后不佳。抑制腫瘤細胞DNA的修復(fù),或可增加放射治療的療效,新一階段可考慮深化研究EGFR和IGF-1R抑制劑對胸腺瘤EGFR和IGF-1R陽性表達病例化療預(yù)后的影響。
[1] 朱惠民,張旭,陳根強,等.胸腺瘤WHO組織學(xué)分型與胸腺瘤診治的關(guān)系[J].中華全科醫(yī)學(xué),2009,7(12):1304-1306.
[2] 賈佳,李月敏.術(shù)后放療在胸腺瘤中的作用及研究進展[J].實用醫(yī)學(xué)雜志,2016,32(15):2573-2575.
[3] 賈佳,朱慧軍,王冰,等. 侵襲性胸腺瘤術(shù)后三維適形放療預(yù)后分析[J].中華腫瘤防治雜志,2016,23(13):888-892.
[4] 劉宇,田野,張幸平,等.B3型胸腺瘤術(shù)后放射治療的臨床價值探討 [J].中國腫瘤臨床,2016,43(6):240-244.
[5] 王芹,劉曉秋,劉強,等.DNA雙鏈斷裂修復(fù)途徑中重要的修復(fù)蛋白[J].國際放射醫(yī)學(xué)核醫(yī)學(xué)雜志,2013,37(1):34-37.
[6] Vazquezmartin A,Cufí S,Oliverasferraros C,et al.IGF-1R/epithelial-to-mesenchymal transition (EMT) crosstalk suppresses the erlotinib-sensitizing effect of EGFR exon 19 deletion mutations[J].Scientific Reports,2013,3(9):2560.
[7] 邵明海,陳仕林,盧洪勝,等.胸腺瘤WHO組織學(xué)分型、Masaoka臨床分期和預(yù)后的關(guān)系[J].實用腫瘤學(xué)雜志,2007,21(2):128-130.
[8] Schanzer JM,Wartha K,Croasdale R,et al.A novel glycoengineered bispecific antibody format for targeted inhibition of epidermal growth factor receptor (EGFR)and insulin-like growth factor receptor type I (IGF-1R)demonstrating unique molecular properties.[J].Journal of Biological Chemistry,2014,289(27):18693.
[9] 李文姍, 余琦, 李寧 . 胸腺瘤中 EGFR 和 IGF-1R 的表達及其意義[J]. 臨床與實驗病理學(xué)雜志, 2016, 32(3):297-300.
[10] 夏秋媛,印洪林.胸腺上皮性腫瘤的分子病理研究進展 [J].醫(yī)學(xué)研究生學(xué)報,2013,26(3):314-318.
[11] 王進,曾祥,胡偉民,等 .IGF-1R、EGFR、VEGF、HER2在胃癌組織中的表達及與其預(yù)后的關(guān)系[J].實用癌癥雜志,2012,27(5):468-471.
[12] 李文姍,梁玉梅,余琦,等.C-KIT、EGFR及IGF-1R在胸腺瘤及其他腫瘤中的研究進展[J].現(xiàn)代腫瘤醫(yī)學(xué),2016, 24(7):1154-1157.
[13] 馬瑩,宋印利,包穎 .EGFR、HER-2、VEGF 及 IGF-1R在胃癌組織中的表達及其與臨床病理參數(shù)相關(guān)性分析 [J].哈爾濱醫(yī)科大學(xué)學(xué)報,2014,48(3):191-194.
[14] 吳開良,蔣國梁,茅靜芳,等.259例胸腺瘤術(shù)后放療長期生存結(jié)果及預(yù)后因素分析[J].中華放射腫瘤學(xué)雜志, 2005,14(6):467-470.
[15] Liang K,Ang KK,Milas L,et al.The epidermal growth factor receptor mediates radioresistance.[J].International Journal of Radiation Oncology Biology Physics,2003,57(1):246-254.

