一株產蛋白酶不動桿菌的分離與酶學性質
李 偉, 龔勁松, 李 恒, 張旦旦, 陸震鳴, 許正宏, 史勁松
一株產蛋白酶不動桿菌的分離與酶學性質
李 偉, 龔勁松, 李 恒, 張旦旦, 陸震鳴, 許正宏, 史勁松*
(江南大學 藥學院,江蘇 無錫 214122)
以脫脂奶粉或羊毛粉為唯一碳氮源,從環境樣品中篩選蛋白酶產生菌,首次獲得一株高產蛋白酶的醋酸鈣不動桿菌(Acinetobacter calcoaceticus)E9,初步發酵優化顯示,該菌株的最適發酵產酶溫度35℃,培養基初始pH 6.0,接種量為質量分數4%,培養時間30 h;發酵培養基:蔗糖10 g/L,牛肉膏15 g/L,K2HPO4·3H2O 7 g/L,KH2PO43 g/L,MgCl2·6H2O 1 g/L。酶學性質初步研究表明,不動桿菌E9所產的蛋白酶屬于中性蛋白酶,最適作用溫度50℃,最適pH 8.0,在pH 5.0~8.0及40℃以下時具有良好的穩定性,酶反應動力學參數Km為7.067 mg/mL,Vmax為966.7 μg/(mL·min)。
蛋白酶;篩選;鑒定;醋酸鈣不動桿菌;酶學性質
蛋白酶廣泛分布于動物、植物和微生物中,是生命活動中一類極為重要的水解酶。1945年Jaag等人在地衣芽孢桿菌Bacillus licheniformis中發現了堿性蛋白酶[1-2],從此微生物源蛋白酶逐步成為蛋白酶研究的熱點。微生物繁殖速度快,種類繁多,培養方法簡單,易于大批量生產和提取。因此,微生物蛋白酶的篩選和應用研究一直是生物催化與轉化領域的一個十分重要的工作。然而,近30年來,并沒有很多新的蛋白酶品種投入到工業應用中,目前應用的主要品種仍然芽孢桿菌蛋白酶,如地衣芽孢桿菌2709[3]和C1213[4]、短小芽孢桿菌289和209[5],上述蛋白酶大都為中溫、堿性品種,普遍存在中性催化活力低、溫度穩定性不好、粗品氣味較大等缺點。隨著眾多工業領域對新型酶制劑的需求,未來蛋白酶的研究發展將主要集中于:(1)繼續篩選新來源的蛋白酶菌種和基因資源,為蛋白酶在制革、紡織等領域的應用提供新的素材;(2)利用分子改造技術對微生物蛋白酶進行性能優化,通過高效表達為工業領域提供性能優良的酶品種[6-8],而微生物資源和基因資源將是這項工作的基礎。
作者從自然環境中采集土樣,篩選蛋白酶產生菌株,經過多級篩選共獲得各類產酶菌株數十株,其中首次發現了一株產蛋白酶的不動桿菌E9。不動桿菌一般主要來源于土壤和水中,以鮑氏不動桿菌為主,而醋酸鈣不動桿菌報道很少[9]。已有研究主要涉及脂肪酶的表達合成[10]及環境污染物的生物降解[11-12],而關于不動桿菌屬菌株產蛋白酶的研究尚未見文獻報道。作者通過生理生化和分子生物學鑒定確立該菌株E9為一株產中性蛋白酶的醋酸鈣不動桿菌Acinetobacter calcoaceticus,并發現該菌株所產中性蛋白酶具有較高的催化潛力和良好的穩定性。E9蛋白酶的發現,對研究微生物蛋白酶的來源與進化關系也具有一定意義,而且,不同微生物來源的酶類在結構、序列和催化機制方面往往存在較大的差異,其深入研究將加深對酶的構效關系理解,并推動酶的分子改造工作。
1 材料與方法
1.1 材料與儀器
1.1.1 樣品來源 土樣,采集自羊圈、畜牧場土壤、皮革廠等富含蛋白的環境,置于低溫保存。
1.1.2 培養基 初篩培養基(g/L):脫脂奶粉(或羊毛粉)10,NaCl 0.5,瓊脂粉18;pH自然;復篩和發酵基礎培養基(g/L):葡萄糖5,蛋白胨10,酵母粉5,K2HPO4·3H2O 7,KH2PO43;pH 7.0;種子培養基(g/ L):胰蛋白胨10,酵母粉5,NaCl 10,pH自然。
1.1.3 主要試劑及儀器 細菌基因組DNA提取試劑盒、小量質粒提取試劑盒及瓊脂糖凝膠回收試劑盒:購自上海捷瑞生物工程有限公司;擴增及克隆所用試劑:購自寶生物工程 (大連)有限公司(Takara);胰蛋白胨、酵母粉:Oxoid公司產品。
小型高速離心機:Eppendorf公司產品;PCR擴增儀,Bio-Rad公司產品;核酸電泳系統,COSMO Bio公司產品;生化培養箱:博訊公司產品。
1.2 實驗方法
1.2.1 產蛋白酶菌株的初篩 稱取1 g土樣,加到9 mL無菌水中,充分振蕩后,吸取上層濁液稀釋至10-6、10-7、10-8和10-9級數,各吸取50 μL涂布在初篩培養基上,置于37℃生化培養箱中培養48~96 h,觀察是否有透明圈的菌落。挑取透明圈較大的單菌落,劃線分離,并通過鏡檢確定為純化菌落。
1.2.2 產蛋白酶菌株的復篩 將初篩菌株接種至種子培養基中,30℃,220 r/min放置于回旋式搖床中培養12 h,再轉接至復篩培養基中,培養48 h后,取1 mL菌液進行高速離心,12 000 r/min離心10 min。取上清進行蛋白酶酶活檢測。選取酶活最高的菌株進行后續實驗研究。
1.2.3 蛋白酶酶活測定 采用福林法(GB/T23527-2009)進行酶活檢測。
酶活定義:1 mL液體酶在40℃和pH 8.0條件下,1 min水解酪蛋白產生1 μg酪氨酸為一個酶活力單位。
酶活計算公式:酶活力(U/mL)=A×K×4/10×n
A:樣品平行試驗的平均A值;K:吸光常數;4:反應試劑的總體積;10:酶解反應時間;n:酶液稀釋總倍數。
1.2.4 產蛋白酶菌株的形態及生理生化鑒定 將篩選并純化好的菌株劃線在LB培養基平板上,37℃培養,觀察菌落形態。革蘭氏染色后鏡檢。
生理生化鑒定參照伯杰細菌手冊第九版進行相關實驗。
1.2.5 16S rDNA分子鑒定 參照文獻[13],采用細菌基因組提取試劑盒提取基因組,用細菌16S rDNA通用引物 (正向引物P0:5’-GAGAGTTTGATCCT GGCTCAG-3’,反向引物P6:5’-CTACGGCTACC TTGT TACGA-3’)進行16S rDNA的擴增。擴增產物經 0.8 g/dL瓊脂糖凝膠電泳,割膠回收后連接pMD-19T載體,轉化至宿主E.coli JM109中,采用小量質粒提取試劑盒提取質粒,送至上海生工測序。測序結果在NCBI的GenBank中進行BLAST序列比對,確定種屬。采用MEGA 5.0軟件進行同源比對分析,構建系統發育樹。
1.2.6 菌體生長及產酶曲線 將目的菌株接種至發酵基礎培養基中,37℃、220 r/min培養。每隔2 h取樣檢測OD600值與蛋白酶酶活,繪制菌株生長及酶活曲線。
1.2.7 發酵條件 采用搖瓶方式研究發酵條件,回旋式搖床轉速220 r/min,培養溫度37℃,接種量為體積分數1%,培養時間30 h。依次改變接種量、培養溫度、初始pH,考察不同培養條件下菌株產蛋白酶情況。在單因素優化培養條件下,開展發酵培養基的碳源、氮源和金屬離子的優化。
1.2.8 粗蛋白酶的性質 發酵液12 000 r/min,4℃離心10 min,取上清為粗酶液。研究溫度、pH、金屬離子、蛋白酶抑制劑和表面活性劑等對粗酶的影響,并進行反應動力學參數測定。
1)溫度對蛋白酶酶活的影響 酶液經過適當稀釋,分別于10、20、30、40、50、60、70、80℃條件下測定蛋白酶活力,研究酶的最適作用溫度和溫度穩定性。
2)pH對蛋白酶酶活的影響 配制濃度為0.04 mol/L H3BO3、H3PO4、CH3COOH的不同 pH的 B-R緩沖液,分別測定pH 3.0~11.0范圍的酶活,確定該酶的最適作用pH值。取適量酶液分別用不同pH的緩沖液稀釋至適當濃度,于40℃靜置1 h,按照酶活測定方法測定殘余酶活力。
3)金屬離子、蛋白酶抑制劑和表面活性劑等化學試劑對酶活的影響 在酶液中分別添加不同金屬離子(5 mmol/L和 10 mmol/L)、表面活性劑(1 g/dL)、蛋白酶抑制劑(5 mmol/L)等化學試劑,分別測定酶活力。以未添加的反應管為對照。
4)酶反應動力學參數 用pH 8.0的緩沖液分別配制不同質量分數的酪蛋白溶液:0.1%、0.2%、0.4%、0.6%、0.8%、1.0%、1.2%,分別測定上述底物濃度下的蛋白酶酶活,利用數據分析軟件GraphPad Prism 5.0計算該酶以酪蛋白為底物時的Km值和Vmax值,并以1/V對1/[S]進行雙倒數作圖。
1.2.9 統計學分析 在研究的每項實驗中,均設3個平行。采用統計分析軟件GraphPad Prism 5對實驗數據進行平均值和標準差分析。
2 結果與討論
2.1 環境微生物群落中蛋白酶產生菌的篩選
環境微生物群落中包含豐富的微生物資源,通常采用富集培養的方法,可篩選出在特定條件下生長的微生物。作者以牛奶、羊毛粉為唯一碳氮源,從羊圈、畜牧場土壤、皮革廠等環境中采集土樣,篩選各類蛋白酶產生菌株,經過平板初篩和測酶活復篩的兩級篩選共獲得各類蛋白酶產生菌30余株,其中包括兩株高產角蛋白酶的短小芽孢桿菌Bacillus pumilus[14]和鏈霉菌Streptomyces aureofaciens[15],短小芽孢桿菌角蛋白酶能有效水解角蛋白底物而對膠原蛋白的酶活較低,可用于制革領域的脫毛工藝,另外,酶還對SDS、吐溫、曲拉通等表面活性劑具有較強的耐受能力,因而該蛋白酶在洗滌劑工業中也具有一定的應用潛力;鏈霉菌角蛋白酶則表現出對強堿性條件及多種表面活性劑存在下的突出穩定性,同樣表明了該蛋白酶的潛在應用價值。
本次篩選中,首次發現了一株產蛋白酶的不動桿菌E9。通過生理生化和分子生物學鑒定確立該菌株為一株產蛋白酶的醋酸鈣不動桿菌(Acinetobacter calcoaceticus),并發現其具有較高的產酶潛力。為了進一步挖掘該酶的產酶能力及考察該酶的應用性能,作者對醋酸鈣不動桿菌產蛋白酶進行了深入研究,考察了不同發酵條件對于產酶的影響,并分析了優化后的蛋白酶的酶學特征。
2.2 菌株E9的形態學特征及系統分析
2.2.1 生理生化及形態學特征 菌株E9在LB平板上培養24 h后菌落呈圓形、中間隆起、邊緣整齊、濕潤有光澤,顏色為米白色。鏡檢(革蘭氏染色)形態為球桿狀,革蘭氏陰性。菌株E9的生理生化特征見表1,參考伯杰細菌手冊第九版,發現該菌株屬于不動桿菌屬(Acinetobacter)菌株特征相似。
2.2.2 16S rDNA測序及系統進化分析 提取菌株E9的基因組DNA,經PCR擴增的16S rDNA片段送至上海生工公司測序,測序結果在NCBI中采用BLAST軟件(http://blast.ncbi.nlm.nih.gov/Blast.cgi)進行比對。比對結果表明,該菌與醋酸鈣不動桿菌Acinetobacter calcoaceticus(KJ149815.1)具有最高相似度,為99%;采用N-J法構建菌株E9的系統發育樹 (圖1),結果顯示菌株 E9與 A.calcoaceticus(KJ149815.1)在同一分支上。綜上所述,將該菌株確認為醋酸鈣不動桿菌(A.calcoaceticus)。不動桿菌在外界環境中廣泛存在,主要來源于土壤和水,在人體的各處也有分布。在不動桿菌屬中,醋酸鈣不動桿菌報道較少。在已有文獻資料中,醋酸鈣不動桿菌僅被報道用于產生脂肪酶[10]及用于降解柴油
[16]、表面活性劑[17]和農藥[11-12]等,而關于該菌株產蛋白酶的研究尚未見文獻報道。
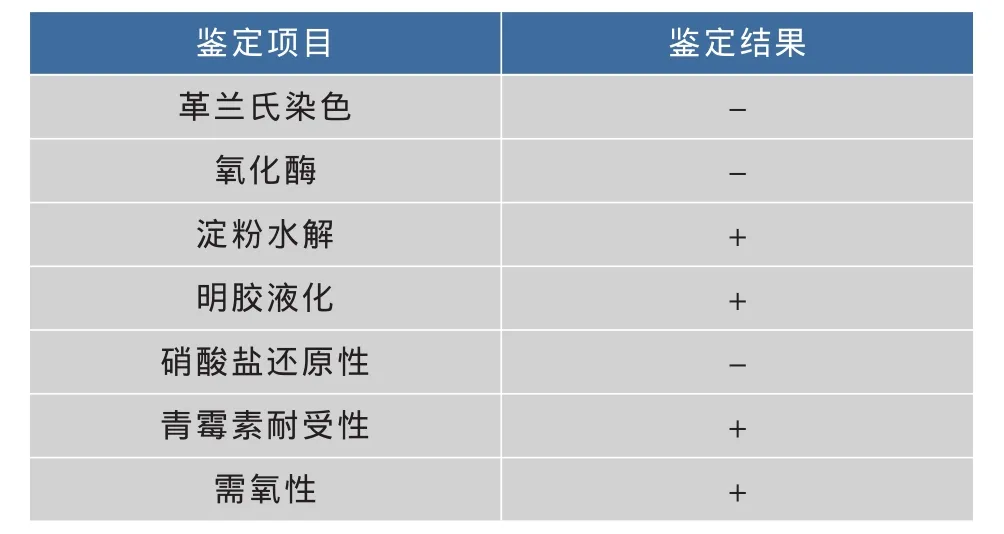
表1 菌株E9的生理生化特征Table 1 Physiological and biochemical properties of strain E9
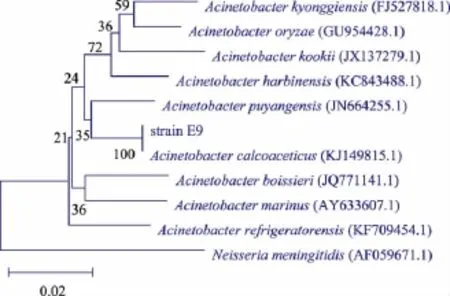
圖1 菌株E9的系統進化樹Fig.1 Phylogenetic tree of strain E9
2.3 發酵條件研究
2.3.1 生長曲線和產酶曲線 由圖2得知,菌株E9在0~8 h處于延滯期,從第8 h開始進入對數生長期,第30 h菌濃達到最高值,在第35 h左右時菌體開始進入衰亡期。菌株產蛋白酶的趨勢與菌體生長情況具有密切聯系,第30 h產酶水平達到最高,最高酶活為418 U/mL。
2.3.2 培養條件對產蛋白酶的影響 考察了培養溫度、pH以及接種量對于發酵產酶的影響。由圖3(a)可以看出,在一定溫度下,菌體濃度和產酶水平隨著溫度升高而增加,在35℃時達到最高值,之后隨溫度升高菌體和產酶均呈下降趨勢。pH對產酶影響的結果表明,初始pH為6.0時,生物量和蛋白酶酶活均達到最高(圖3(b)),在pH 6.0~7.0范圍內均表現較高酶活,其他pH條件下生物量和酶活顯著下降,說明初始pH在中性左右適合菌體生長及發酵產酶。另外,接種量的大小對產酶影響差異不大(結果未顯示),在體積分數0.5%~6%的接種量范圍內微生物均能獲得較高的生物量和產酶水平,最終選取產生較高酶活的體積分數4%作為后續實驗的接種量。

圖2 菌株E9發酵生長與產酶曲線Fig.2 Curves of cell growth and enzyme activity of strain E9
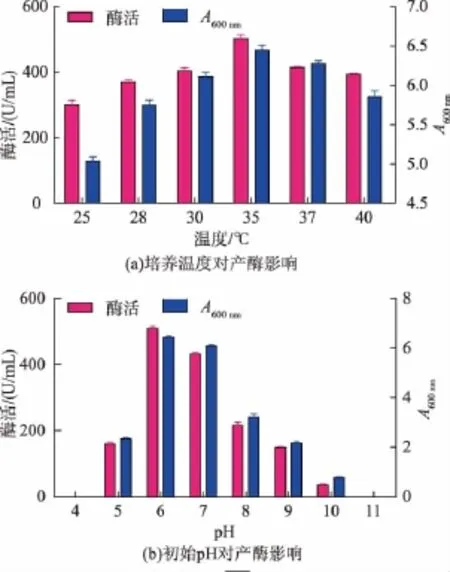
圖3 培養溫度和初始pH對產酶影響Fig.3 Effects of cultivation temperature and initial pH on the production of protease
2.3.3 碳源對產蛋白酶的影響 將蔗糖、麥芽糖、玉米粉、可溶性淀粉、甘油、檸檬酸以及不添加碳源(對照2)替代初始培養基(葡萄糖,對照1)的碳源,研究不同碳源對菌株的產酶影響。在產酶發酵過程中碳源為糖的情況下,有蛋白酶的產生,且蔗糖作為碳源能有效促進菌株發酵產生蛋白酶(結果見圖4),可溶性淀粉也有較好的促進作用。將蔗糖質量濃度進行進一步的優化,最終結果表明質量濃度為10 g/L時酶活最高。不動桿菌屬為非發酵糖革蘭氏陰性桿菌,生長過程對營養要求不高,在無糖的條件下,菌體也能生長良好,但無蛋白酶產生,研究發現有糖存在時能促進產酶。在不動桿菌產膽固醇氧化酶的發酵中也發現了類似現象。
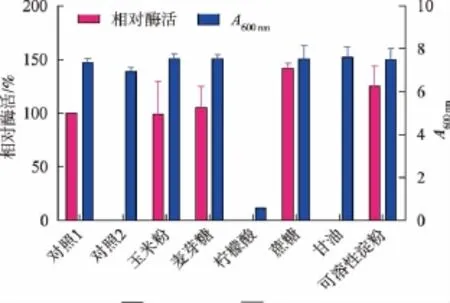
圖4 不同碳源對產酶影響Fig.4 Effects of carbon resources on the production of protease
2.3.4 氮源產蛋白酶的影響 將玉米漿、豆餅粉、蛋白胨、牛肉膏和胰蛋白胨替代初始培養基的氮源,研究不同氮源對菌株的產酶影響。圖5顯示,牛肉膏對酶活促進作用最顯著,其次為豆餅粉、蛋白胨和大豆蛋白胨,這些氮源中蛋白含量高,對蛋白酶的生產有一定的誘導作用。選擇牛肉膏為發酵最適氮源,并進行濃度優化,在牛肉膏質量濃度為10~ 15 g/L時相對酶活較高,而在15 g/L時獲得最高生物量,因此選擇15 g/L為其最適濃度。
2.3.5 金屬離子產蛋白酶的影響 在培養基中分別添加5 mmol/L的金屬離子,以考察不同金屬離子對于產酶的影響,結果表明金屬離子對產酶的影響并不顯著(圖6)。Na+對產酶具有微弱的抑制作用,K+和Mn2+則提高約5%的酶活,僅有Mg2+對產酶具有明顯的促進作用,經進一步的濃度優化最終選擇5 mmol/L為其最適濃度。
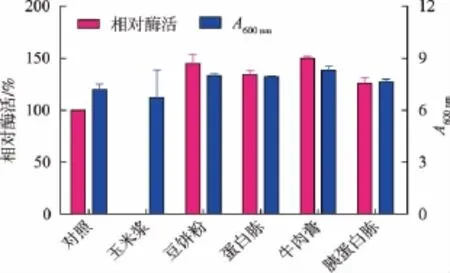
圖5 不同氮源對產酶影響Fig.5 Effects of nitrogen resources on the production of protease
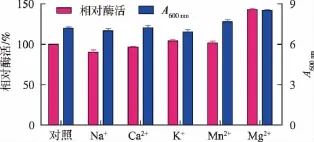
圖6 不同金屬離子對產酶影響Fig.6 Effects of metal ions on the production of protease
2.3.6 優化條件下發酵酶活檢測 將菌株按體積分數4%接種量接種至單因素發酵條件優化后的培養基(蔗糖10 g/L,牛肉膏 15 g/L,K2HPO4·3H2O 7 g/L,KH2PO43 g/L,MgCl2·6H2O 1 g/L,初始 pH 6.0)進行發酵,置于回旋搖床220 r/min,35℃下培養30 h。發酵后進行蛋白酶酶活檢測,酶活為570 U/mL,比優化前提高40%。
2.4 酶學特征研究
2.4.1 溫度對蛋白酶酶活的影響 溫度對蛋白酶活性的影響如圖7(a)所示,一定溫度范圍內,酶活隨著溫度增加而提高,溫度為50℃時酶活最高,這歸因于溫度升高使酶分子與底物分子的碰撞頻率提高,從而獲得了較高酶活性。然而,超過60℃時酶活隨溫度升高而顯著下降,這表明高溫使酶蛋白變性失活。該酶在40~60℃之間酶活較高,屬于中溫蛋白酶。熱穩定性研究結果顯示,該酶在40℃以下具有較好的穩定性,當溫度超過50℃,則穩定性減弱。
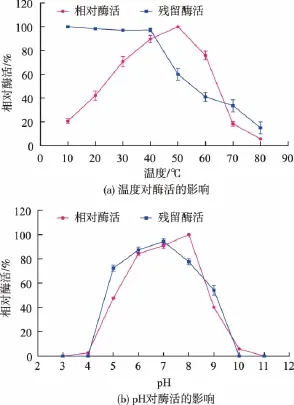
圖7 最適反應溫度、pH及其穩定性Fig.7 Effects of temperature and pH on protease activity and stability
2.4.2 pH對蛋白酶酶活的影響 pH對蛋白酶活性的影響結果見圖7(b),pH在6.0~8.0時表現出較高酶活,在其他酸堿性條件下酶活均顯著降低,pH 8.0時酶活最高,因此選取8.0為酶反應的最適pH值。該蛋白酶為中性偏堿蛋白酶,在不同pH下靜置1 h后,在pH 7.0時酶穩定性最好,最適pH 8.0下,1 h殘留酶活有80%左右,pH在5.0~8.0時酶活較為穩定,反映了該酶為中性蛋白酶的特點。
2.4.3 金屬離子、蛋白酶抑制劑和表面活性劑等化學試劑對酶活的影響 金屬離子濃度對酶活影響的研究結果表明,在5 mmol/L下,Ca2+對酶活有較高的促進作用(表2),這可能歸因于Ca2+對酶的結構具有潛在影響,其他金屬離子均無明顯影響甚至存在抑制作用;在濃度為10 mmol/L時,所有測試的金屬離子均對酶有不同程度的抑制作用。
表面活性劑則對酶活的影響較小(表3),吐溫80的存在對酶活還具有微弱的促進作用,而1%的SDS則對該蛋白酶無顯著抑制效果;蛋白酶抑制劑PMSF和EDTA對酶有明顯的抑制作用,而DTT對其抑制作用較弱,推測該蛋白酶屬于金屬絲氨酸蛋白酶類。
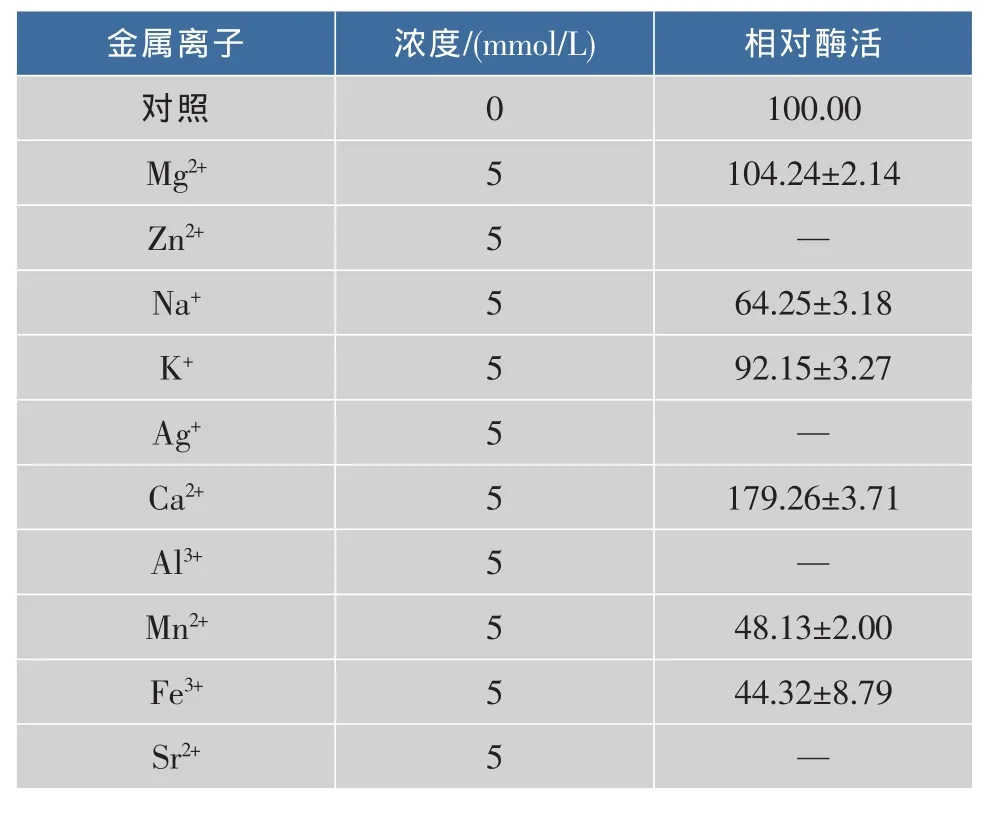
表2 金屬離子對蛋白酶酶活的影響Table 2 Effects of metal ions on the activity of protease

表3 表面活性劑和蛋白抑制劑對蛋白酶酶活的影響Table 3 Effects of surfactants and inhibitors on the activity of protease
2.4.4 酶反應動力學參數 以不同濃度的酪蛋白溶液為底物分別測定A.calcoaceticus蛋白酶酶活。通過數據分析軟件GraphPad Prism 5.0分析并計算,最終結果顯示該蛋白酶的動力學參數Km和Vmax分 別 為 7.067 mg/mL和 966.7 μg/(mL·min),Lineweaver-Burk雙倒數圖見圖 8。這與米曲霉Aspergillus oryzae蛋白酶的數值類似,其Km為8.36 mg/mL,Vmax為12.95 μg/(mL·min)。
3 結語
作者從土樣中篩選出數十株產蛋白酶的菌株,結果首次發現一株高產蛋白酶的不動桿菌E9,經過形態學和分子生物學鑒定將菌株鑒定為醋酸鈣不動桿菌(A.calcoaceticus)。鑒于目前尚未見有關該菌來源的蛋白酶報道,研究醋酸鈣不動桿菌發酵產蛋白酶及其酶學特性具有重要的理論意義和實踐價值。

圖8 A.calcoaceticus蛋白酶酶促反應動力學雙倒數圖Fig.8 Lineweaver-Burke plot of A.calcoaceticus protease
通過對該菌株產蛋白酶的發酵條件和培養基成分分別進行優化,酶活力提高40%,最高酶活達到570 U/mL。對蛋白酶的粗酶性質進行了初步研究,發現該蛋白酶屬于中溫中性蛋白酶,在低溫和中性條件下穩定性較好,低濃度Ca2+對酶活具有促進作用。蛋白酶抑制劑PMSF和EDTA對該酶表現出較強的抑制作用,而DTT對其作用微弱,推測該蛋白酶屬于金屬絲氨酸蛋白酶類。
[1]RAO M B,TANKSALE A M,Ghatge M S,et al.Molecular and biotechnological aspects of microbial proteases[J].Microbiology and Molecular Biology Reviews,1998,62(3):597-635.
[2]DENG Juyun.Research progress in microbial alkaline protease[J].Modern Food Science and Technology,2008,24(3):293-296.(in Chinese)
[3]ZHAO Liangqi,QI Jing,GAO Jinyang,A kinetic study on the production of alkaline proteinase by Bacillus licheniformis 2709[J]. Chinese Journal of Biotechnology,1998,14(4):395-400.(in Chinese)
[4]ZHENG Tiezeng,TU Tikun,HUANG Dengyu,et al.Study on raising activity of alkaline protease produced by strain C1213[J]. Food and Fermentation Industries,1993(1):25-31.(in Chinese)
[5]QIU Xiubao,CHENG Xiulan,YUAN Ying.The study of alkaline proteinase in Bacillus basophilus-Ⅰ.The study of screening,isolation and fermentation[J].Microbiology China,1988,15(3):101-104.(in Chinese)
[6]LI D,HUANG F,XIA M,et al.Molecular cloning and expression of a novel mesophilic alkaline protease from Bacillus sp.L010 in Escherichia coli[J].ACTA Microbiologica Sinica,2013,53(11):1240-1250.
[7]郭繼平.米曲霉堿性蛋白酶的異源表達和定向進化以及遺傳改造[D].哈爾濱:哈爾濱工業大學,2008.
[8]PAN Yanyun,ZHOU Yanfen,ZHANG Heying,et al.The construction and genetics identification of engineering strain producing alkaline protease[J].Natural Sciences Journal of Harbin Normal University,2004,19(4):97-100.(in Chinese)
[9]LI Feng,CHAI Jiake,CHANG Dong.Acinetobacter baumannii infection in burn wards:23 case analysis[J].Chinese Journal of Nosocomiology,2005,15(6):711-712.(in Chinese)
[10]SHI Qiaoqin,CHEN Ruoying,XU Yiqing,et al.Studies on thermostable alkaline lipasein Acinetobacter calcoaceticus[J].ACTA Microbiologica Sinica,1992,32(6):425-1431.(in Chinese)
[11]LIU Tingting,DONG Kunming,MIU Li,et al.Isolation,identification and biodegradation characteristics of a bacterial strain able to degrade bifenthrin[J].Journal of Agro-Environment Science,2012,31(6):1147-1152.(in Chinese)
[12]TANG Jie,ZHANG Qing,ZENG Chaoyi,et al.Isolation and characterization of deltamethrin degrading strain and its degradation characteristic[J].Journal of Xihua University·Natural Science,2014,33(3):108-112.(in Chinese)
[13]CHEN Y S,YANAGIDA F,SHINOHARA T.Isolation and identification of lactic acid bacteria from soil using an enrichment procedure[J].Letters in Applied Microbiology,2005,40(3):195-200.
[14]GONG J S,WANG Y,ZHANG D D,et al.A surfactant-stable Bacillus pumilus K9 α-keratinase and its potential application in detergent industry[J].Chemical Research in Chinese Universities,2015,31(1):91-97.
[15]GONG J S,WANG Y,ZHANG D D,et al.Biochemical characterization of an extreme alkaline and surfactant-stable keratinase derived from a newly isolated actinomycete Streptomyces aureofaciens K13[J].RSC Advances,2015,5(31):24691-24699.
[16]LIU Shasha,CHEN Zhiliang,DONG Jiahua,et al.Isolation,identification and degradation characteristics of a diesel oil-degrading bacterium[J].Chinese Journal of Soil Science,2013,44(6):1440-1444.(in Chinese)
[17]GUAN Xiangjie,HE Qiangli,HUANG Shuie,et al.Isolation,identification of a octylphenol polyethoxylate degradaing strains and its degradation study[J].China Environmental Science,2014(6):1556-1563.(in Chinese)
Screening of a Protease-Producing Strain Acinetobacter calcoaceticus and Characterization of the Enzyme
LI Wei, GONG Jinsong, LI Heng, ZHANG Dandan, LU Zhenming, XU Zhenghong, SHI Jinsong*
(School of Pharmaceutical Science,Jiangnan University,Wuxi 214122,China)
A strain E9 to produce protease efficiently was screened from environmental samples with skimmed milk as carbon and nitrogen sources and was identified to be a strain of Acinetobacter calcoaceticus based on biochemical and physiological properties as well as the 16S rDNA gene sequencing.Its optimal fermentation conditions were found to be temperature 35℃,initial pH 6.0,inoculation 4%and culture time of 30 h,and the optimal fermentation medium contained 10 g/L of sucrose,15 g/L of beef extract,7 g/L of K2HPO4·3H2O,3 g/L of KH2PO4and 1 g/L of MgCl2·6H2O. The resulting protease showed high activity and superior stability with moderate temperature and neutral pH values,and its kinetic parameters Kmand Vmaxwere determined to be 7.067 mg/mL and 966.7 μg/(mL·min),respectively.
protease,screening,identification,Acinetobacter calcoaceticus,enzymatic properties
Q 939
A
1673—1689(2017)01—0008—07
2015-04-08
國家863計劃項目(2012AA022204C)。
*通信作者:史勁松(1971—),男,江蘇宿遷人,工學博士,教授,主要從事酶工程及天然活性物質開發研究。Email:shijs@163.com
李偉,龔勁松,李恒,等.一株產蛋白酶不動桿菌的分離與酶學性質[J].食品與生物技術學報,2017,36(01):8-14.

