中學催化劑的種類及應用研究
華煜青(杭州第十四中學康橋校區,浙江 杭州 310015)
中學催化劑的種類及應用研究
華煜青(杭州第十四中學康橋校區,浙江 杭州 310015)
催化劑是化學中最常見的物質之一,它能改變化學反應速率,縮短或延長反應完成時間。幾乎所有的化學反應都可以在催化劑的作用下提高生產效率,因此找到合適的催化劑至關重要。介紹催化劑的性質及其對化學反應的作用機理,舉例說明中學用到催化劑的化學反應,并對其催化機理作簡要分析,最后總結催化劑的發展趨勢。
催化劑;種類;機理
催化劑又稱之為觸媒,是指改變化學反應速率,但其自身的化學性質和質量都不變的元素或化合物。催化劑用量小,作用大,分別應用于加氫、脫氫、聚合、酯化等催化反應。
中學課本里,對催化劑的催化解釋是不參與化學反應,但在一些文獻及試題中都有關于催化劑參與反應的問題。因此,本文對中學涉及到的催化劑進行探討,介紹催化劑的性質,從催化機理上解釋催化劑發揮作用的方式。通過舉若干例子,對化學反應中的催化機理進行逐一分析,得出催化劑是否參與反應的結論。
1 催化劑與化學反應
1.1 催化劑的性質
催化劑是指改變反應物化學反應速率而不改變化學平衡,且本身的質量和化學性質在化學反應前后都沒有發生改變的物質。
催化劑對化學反應的影響有正催化作用也有逆催化作用,正催化作用即加快化學反應速率,逆催化作用即減慢化學反應速率,根據化學反應的要求不同,利用催化劑對化學反應完成時間進行控制。在整個化學反應中,催化劑只是影響反應速率,因此它的質量化學性質不發生任何變化,但是其物理性質可能會變成變化。一般情況下,催化劑僅僅對改變某一化學反應有幫助,而對于其他的化學反應影響微乎其微,因此,催化劑具有選擇性。此外,催化劑在參與化學反應時,可能需要一定的溫度、壓力,讓催化劑達到最大的使用活性,即催化劑具有一定活性。
1.2 催化劑的作用機理
催化劑的作用機理有兩種解釋,即催化劑不參與化學反應和催化劑參與化學反應兩種。
1.2.1 催化劑不參與化學反應
在中學課本上,催化劑在反應前后,本身的質量和化學性質都不發生變化,但是其物理性質可能發生變化,視具體的化學反應而呈現不同的變化形態。
1.2.2 催化劑參與化學反應
這種理論解釋是基于活化能原理,所謂活化能是指分子從常態轉化為容易發生化學反應的活躍狀態所需的最小能量,這是由瑞典化學家阿倫尼烏斯提出的。催化劑在化學反應中參與反應,與反應物生成一種中間產物,該過程所需的活化能要比原反應物所需的活化能要小很多。反應過程可以表述如下

式中A,B是反應物,C是催化劑。
2 催化劑的種類及應用
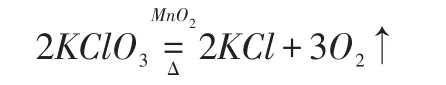
若按照催化劑參與化學反應的解釋,催化劑首先與KClO3反應,生成高錳酸鉀、氯氣和氧氣,如式(2)所示,而后高錳酸鉀在加熱的環境下分解成錳酸鉀、二氧化錳和氧氣,如式所示(3),最后,錳酸鉀和氯氣反應,生成氯化鉀、二氧化錳和氧氣,如式(4)。綜上,要判斷MnO2是否參與反應,只需測定生成的氧氣中的純度,是否混有氯氣。目前,對于MnO2催化作用還沒有完全弄清楚,主要是因為反應制得的氧氣中含有氯氣的氣味。

二氧化錳的催化作用還被應用在過氧化氫H2O2分解實驗中,這也是實驗室制取氧氣的一種方法。在常溫下,過氧化氫就可以自分解成氧氣和水,但是反應很慢,當在試管中加入少量的二氧化錳時,有大量的氣泡冒出,由帶火星的木條測試知是氧氣,其化學反應方程式如式(5)所示,在這個反應中二氧化錳作為催化劑,通過降低反應的活化能,單位體積內的活化分子百分數增加,使得過氧化氫的分解速率加快。

2.1 金屬催化劑
2.1.1 二氧化錳
二氧化錳是中學化學力最常見到的催化劑,如在氯酸鉀(KClO3)分解制取氧氣的實驗中,讓氯酸鉀與二氧化錳(MnO2)進行混合加熱到200℃,可以釋放出氧氣與氯化鉀。這種方法是一種常見的實驗室制氧法。通常會在反應堆里加入二氧化錳,能夠很明顯的觀察到試管一端氣體冒出。若催化劑不參與化學反應,則化學反應式可以表述為式(1);
2.2.2 鐵觸媒
鐵觸媒主要成分是指+2價鐵和+3價鐵組成的氧化物,工業制取氨氣通常采用鐵觸媒作為催化劑,在高溫500℃、高壓20MPa~50MPa的反應爐里,氮氣N2和氫氣H2發生化學反應生成氨氣.
3 催化劑的發展展望
3.1 催化劑的微觀解釋
幾乎所有的金屬催化劑都是過渡金屬或者貴金屬,它主要催化的化學反應是加氫、脫氧反應。對于過渡金屬元素,其最外層有1~2個電子,次外層有1~10個電子,因此(n-1)dns有未成對的電子。即使d電子完全充滿,根據能量躍遷原則,也有可能躍遷到s層軌道上,因此d軌道上有未成對的電子,從而產生化學吸附。所謂化學吸附是指吸附質和吸附劑的表面產生化學鍵,即原子間發生了電子交換、移動。因此,催化劑與反應物的化學吸附分析結果決定了催化劑是否能發揮作用。液體催化劑的催化是由于在液體中,反應物、催化劑以離子形式存在,增大了反應物與催化劑的接觸機會,使得反應向右進行。對于酶,其分子結構是剛性的,但是其表面具有特定的形狀,與反應物結構一一對應,而對于其他反應物的結構不起作用,這種目前對酶催化的一種微觀解釋。
3.2 催化劑的發展趨勢
3.2.1 高效節能
催化劑的作用是改變化學反應的速率,就目前中學接觸到的,都是正催化劑,即加快反應的進行。在實際的化學反應中也有負催化劑,如減緩某些氣體產出的速率,防止壓力驟增,發生爆炸。對于任何一款催化劑,選擇標準是希望催化速率快、轉化效率高,能夠在較短的時間內發生作用,減小反應控制的難度,即在常溫常壓下即可發生作用。
3.2.2 綠色催化
隨著資源數量的日益減少,環境質量的不斷惡化,霧霾、沙塵,水土流失等現象越來越嚴重,工業發展與環境的和諧發展很早就被提出來了,雖然有一定的改善和進步,但還遠遠不斷夠。催化劑作為現代化工必不可少的一環,它的使用和處理也成為綠色化工中很重要的問題。雖然催化劑在化學反應前后化學性質不變,質量不變,但是在使用過程中受種種因素干擾,如某些外來反應物、反應溫度過高、壓力過大等,會使得催化劑緩慢甚至快速失活,而且這種失活是不可逆的。一旦催化劑失活,則在該化學反應中即是廢料,如何對廢料處理,變廢為寶是綠色化工中一直考慮的問題。因此,催化劑的選用、以及催化劑的處理是未來催化劑的一個重要研究方向,選擇合適的催化劑,既能保證化學反應的正常進行,也能減少或者消除產生對人類健康和環境有害的產物。
4 結語
催化劑的研制及其技術的發展,是化學工業中優先發展的重點,找到一款合適的催化劑,化學反應就成功了一大半。現在中學課本接觸到的催化劑大都是簡單的實驗室方法和部分工業方法,對于工業上使用催化劑要復雜的多。催化劑的理論研究仍在繼續,活化能理論在一定程度解釋了發生催化反應的實質,在微觀層面上,如原子、電子等,一些新的催化理論正在進行當中。
[1]王祖浩.化學[M].江蘇教育出版社,1999.
[2]陳文召.催化劑在化學中的角色及其應用[J].吉林教育, 2008(25):75-76.
華煜青(1999-),女。

