重疊綜合征患者血漿血小板微顆粒及內皮細胞微顆粒水平變化及意義
黃潔,李承紅,陳實,劉敏,石奕
(江漢大學附屬醫院,武漢430025)
重疊綜合征患者血漿血小板微顆粒及內皮細胞微顆粒水平變化及意義
黃潔,李承紅,陳實,劉敏,石奕
(江漢大學附屬醫院,武漢430025)
目的 探討重疊綜合征患者血漿血小板微顆粒(PMP)、內皮細胞微顆粒(EMP)水平變化及其臨床意義。方法 選取重疊綜合征患者58例(重疊綜合征組)、單純慢性阻塞性肺疾病患者72例(慢阻肺組)、單純阻塞性睡眠呼吸暫停綜合征患者60例(呼吸暫停綜合征組)。采用流式細胞術檢測各組血漿PMP、EMP,分析重疊綜合征組血漿PMP、EMP與氧合指數(PO2/FiO2)、乳酸、FEV1、FEV1/FVC的關系。結果 重疊綜合征組入院時血漿PMP、EMP水平均高于呼吸暫停綜合征組和慢阻肺組,呼吸暫停綜合征組血漿EMP水平高于慢阻肺組,組間比較P均<0.05。重疊綜合征組睡眠呼吸暫停低通氣指數(AHI)>30次/h者入院時血漿EMP、PMP水平均高于AHI >5~≤15次/h者和>15~≤30次/h者(P均<0.05),AHI>15~≤30次/h者血漿EMP、PMP水平均高于AHI>5~≤15次/h者(P均<0.05)。重疊綜合征組治療后血漿EMP、PMP水平均明顯低于治療前(P均<0.01)。Pearson相關分析顯示,重疊綜合征組血漿EMP、PMP水平與PO2/FiO2、FEV1、FEV1/FVC均呈負相關(P均<0.01),與乳酸水平均呈正相關(P均<0.01)。結論 血漿EMP、PMP水平升高可促進重疊綜合征的發生、發展,二者聯合檢測可判斷重疊綜合征患者病情和治療效果。
重疊綜合征;血小板微顆粒;內皮細胞微顆粒
慢性阻塞性肺疾病(以下稱慢阻肺)和阻塞性睡眠呼吸暫停綜合征(以下稱呼吸暫停綜合征)同時存在稱為重疊綜合征。重疊綜合征的主要癥狀為嚴重低氧血癥,易引發肺動脈高壓、心血管疾病、動脈粥樣硬化、糖尿病等。研究表明,微顆粒具有促凝、促炎、收縮血管、調節免疫等生物學功能,與血管性疾病、癌癥、糖尿病等疾病的發生、發展相關[1]。本研究探討了重疊綜合征患者血漿血小板微顆粒(PMP)和內皮細胞微顆粒(EMP)水平變化及其臨床意義。
1 資料與方法
1.1 臨床資料 選擇2014年1月~2016年1月江漢大學附屬醫院收治的重疊綜合征患者58例(重疊綜合征組),男45例、女13例,年齡46~63(54.25±7.12)歲,睡眠呼吸暫停低通氣指數(AHI)>5~≤15次/h 28例、>15~≤30次/h 20例、>30次/h 10例,氧合指數(PO2/FiO2)為(253.2±47.8)mmHg,乳酸為(1.51±1.05)mmol/L,肺功能:FEV1為(61.83±7.28)%、FEV1/FVC為(60.31±9.85)%。入院后常規給予低流量吸氧、補液、抗感染、平喘、祛痰及BiPAP呼吸機治療3個月。同期選取我院收治的單純慢阻肺患者72例(慢阻肺組),男53例、女19例,年齡47~62(54.90±7.18)歲。單純呼吸暫停綜合征患者60例(呼吸暫停綜合征組),男44例、女16例,年齡46~64(55.64±8.06)歲。三組性別、年齡具有可比性。納入標準:①慢阻肺診斷符合2013年中華醫學會制定的《慢性阻塞性肺疾病診治指南》中的診斷標準[2];②呼吸暫停綜合征診斷符合2011年中華醫學會制定的《阻塞性睡眠呼吸暫停低通氣綜合征診治指南》中的診斷標準[3],其中AHI>5~≤15次/h為輕度、>15~≤30次/h為中度、>30次/h為重度;③重疊綜合征同時符合慢阻肺和呼吸暫停綜合征的診斷標準;④能配合完成肺功能檢查。排除標準:①近3個月內使用激素治療;②合并其他肺部疾病,如支氣管哮喘、支氣管擴張癥、肺纖維化、肺結核和胸腔積液等;③合并心肌病、心力衰竭、急慢性腎病、高血壓、肝臟疾病和代謝性疾病。本研究經醫院倫理委員會審查批準,患者均知情同意。
1.2 血漿PMP、EMP檢測 慢阻肺組、呼吸暫停綜合征組于入院時,重疊綜合征組于入院時及治療3個月結束時分別抽取清晨空腹肘靜脈血6 mL,EDTA抗凝后,分別加入前列腺素E1(PGE1)11 μL和三磷酸腺苷雙磷酸酶(Apyrase,Sigma公司)5 μL,400 g離心15 min收集富血小板血漿,以1 800 g離心15 min獲得無血小板血漿(PPP),吸取上層血漿置于-80 ℃冰箱凍存。凍存后的PPP在0 ℃解凍,每管加入PPP 40 μL,分別與10 μL PE標記的抗CD31抗體和抗CD41a抗體充分混合,避光孵育20 min,分別加入420 μL結合緩沖液及5 μL Annexin V抗體,充分混勻。流式細胞術測定血漿PMP、EMP。對照管選用5 μL鼠抗人IgG-PE,加入462 μL結合緩沖液、5 μL Annexin V抗體、1.5 μL 0.3 μm及1.5 μL 0.8 μm的標準微球,再加入5 μL絕對計數微球,混合后流式細胞術檢測。PMP、EMP的界定直徑為0.3~0.8 μm,表面標記CD41a、Annexin V雙陽性或CD31、Annexin V雙陽性。讀取10 000個微粒數,根據標準熒光微球計數PMP、EMP水平,單位為個/μL。

2 結果
2.1 各組血漿PMP、EMP水平比較 重疊綜合征組入院時血漿PMP、EMP水平均高于呼吸暫停綜合征組和慢阻肺組(P均<0.05),呼吸暫停綜合征組血漿EMP水平高于慢阻肺組(P<0.05)。見表1。重疊綜合征組AHI>30次/h者入院時血漿EMP、PMP水平均高于AHI>5~≤15次/h和AHI>15~≤30次/h者(P均<0.05),AHI>15~≤30次/h者血漿EMP、PMP水平均高于AHI>5~≤15次/h者(P均<0.05)。見表2。重疊綜合征組治療后血漿EMP、PMP水平均低于治療前(P均<0.01)。見表3。
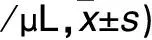
表1 三組入院時血漿PMP、EMP水平比較(個
注:與呼吸暫停綜合征組比較,△P<0.05;與慢阻肺組比較,*P<0.05。
2.2 重疊綜合征組血漿PMP、EMP水平與PO2/FiO2、乳酸、FEV1、FEV1/FVC的關系 Pearson相關分析顯示,重疊綜合征組血漿EMP、PMP水平與PO2/FiO2均呈負相關(r分別為-0.734、-0.699,P均<0.01),與乳酸水平均呈正相關(r分別為0.789、0.707,P均<0.01);血漿EMP水平與FEV1、FEV1/FVC均呈負相關(r分別為-0.812、-0.766,P均<0.01);血漿PMP水平與FEV1、FEV1/FVC均呈負相關(r分別為-0.749、-0.692,P均<0.01)。
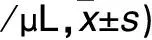
表2 重疊綜合征組不同AHI者入院時血漿PMP、EMP水平比較(個
注:與AHI>5~≤15次/h者比較,*P<0.05;與AHI>15~≤30次/h者比較,△P<0.05。
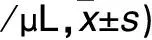
表3 重疊綜合征組治療前后血漿PMP、EMP水平比較(個
注:與治療前比較,*P<0.01。
3 討論
循環微顆粒是細胞受到刺激后從胞質膜表面脫落的顆粒,其含有的親本細胞抗原可反映親本細胞的狀態和特性;還可通過調節NO和產生前列環素對血管內皮功能和炎癥反應起重要作用,并通過刺激細胞因子的釋放及誘導細胞因子在內皮細胞中的基因表達,來調節單核細胞趨化性與內皮細胞黏附[4]。目前認為,循環微顆粒的生物學活性(如細胞間生物信號傳導、免疫調節、血管生成和組織修復等)與疾病的發生、發展密切相關[5]。EMP主要通過內皮細胞的活化或凋亡產生,其表面表達的相關分子受體使其具有不同的生物學活性,在血栓形成、血管生成、炎性反應、細胞凋亡和調節血管張力等方面具有重要作用[6]。有研究表明,注射EMP可引起大鼠急性肺損傷,其作用機制可能為促進炎癥因子、過氧化物酶釋放,上調IL-1β、TNF-α等表達,使中性粒細胞聚集和激活,加重炎癥反應[7]。此外,在惡性腫瘤、膿毒癥、動脈粥樣硬化和糖尿病等患者體內均發現PMP水平顯著升高[8]。研究發現,不管是血漿分離還是血小板刺激產生的PMP,均可作用于不同的細胞,促使其產生黏附分子、釋放細胞因子、調節血管反應性、誘導血管生成、促進腫瘤生長,亦可促使內皮細胞及單核細胞黏附,增加環氧合酶2表達,從而加重炎癥反應[9]。
研究發現,重疊綜合征患者病情進展較單純慢阻肺或呼吸暫停綜合征患者更快[10]。重疊綜合征與慢阻肺、呼吸暫停綜合征有共同的發病誘因,如吸煙。吸煙不僅是慢阻肺發病的高危因素,亦與呼吸暫停綜合征的病情嚴重程度有關[11]。低氧血癥是慢阻肺和呼吸暫停綜合征共同的病變基礎,重疊綜合征患者肺動脈高壓、心血管疾病、動脈粥樣硬化、糖尿病等并發癥的發生風險較單純慢阻肺或呼吸暫停綜合征者顯著增加,其主要死因為心血管疾病[12]。Li等[13]研究發現,香煙提取物不僅可誘導微粒釋放,還能促使具有促微粒蛋白水解活性的MMP14從巨噬細胞釋放。Gordon等[14]研究發現,煙草可增加循環微顆粒水平,吸煙的健康者循環系統EMP輕度增加,早期肺氣腫可能與血漿EMP水平升高密切相關。EMP水平與肺組織破壞程度及氣流受限明顯相關。內皮損傷是慢阻肺重要的病理生理過程,微顆粒特別是EMP可作為慢阻肺內皮損傷的生物學標記物[15]。有研究發現,EMP與肺動脈內膜中層厚度呈正相關,二者均可作為肺動脈高壓患者隨訪評估的非入侵性檢查[16]。Maruyama等[17]報道,重度呼吸暫停綜合征患者血漿PMP水平較健康者及輕中度呼吸暫停綜合征者明顯升高,且可能與重度呼吸暫停綜合征者心血管疾病發生風險更高相關,在應用持續氣道正壓通氣治療后,血漿PMP水平會隨之下降。本研究重疊綜合征組血漿EMP、PMP水平均明顯高于呼吸暫停綜合征組和慢阻肺組,且呼吸暫停綜合征組血漿EMP水平明顯高于慢阻肺組;重疊綜合征組AHI>30次/h者血漿EMP、PMP水平均高于AHI>5~≤15次/h和AHI>15~≤30次/h者;提示血漿EMP、PMP水平升高可促進重疊綜合征的發生、發展。本研究重疊綜合征患者治療后血漿EMP、PMP水平明顯低于治療前,提示隨著機體缺氧狀態的改善,血漿EMP、PMP水平即隨之下降,二者水平變化可反映機體缺氧情況。重疊綜合征患者往往存在低灌注狀態,嚴重供氧不足導致組織細胞缺氧,代謝產物乳酸濃度升高。乳酸是反映組織灌注和氧供不足的早期敏感生化指標,而PO2/FiO2可反映肺換氣功能[18]。本研究重疊綜合征組血漿EMP、PMP水平與乳酸水平呈正相關,與肺功能FEV1、FEV1/FVC及PO2/FiO2呈負相關,提示機體缺氧越嚴重,血漿EMP、PMP水平越高,即EMP、PMP水平與氣流受限明顯相關。
綜上所述,血漿EMP、PMP水平升高可促進重疊綜合征的發生、發展,二者聯合檢測可判斷重疊綜合征患者病情和治療效果。
[1] Rautou PE, Vion AC, Amabile N, et al. Microparticles, vascular function, and atherothrombosis[J]. Circ Res, 2011,109(5):593-606.
[2] 中華醫學會呼吸病學分會慢性阻塞性肺疾病學組.慢性阻塞性肺疾病診治指南(2013年修訂版) [J].中華結核和呼吸雜志,2013,36(4):255-264.
[3] 中華醫學會呼吸病分會睡眠呼吸學組.阻塞性睡眠呼吸暫停低通氣綜合征診治指南 (2011年修訂版) [J].中華結核和呼吸雜志,2011,19(8):356-362.
[4] Puddu P, Puddu GM, Cravero E, et al. The involvement of circulating microparticles in inflammation, coagulation and cardiovascular diseases[J]. Can J Cardiol, 2010,26(1):140-145.
[5] Kornek M, Lynch M, Mehta SH, et al. Circulating microparticles as disease-specific biomarkers of severity of inflammation in patients with hepatitis C or nonalcoholic steatohepatitis[J]. Gastroenterology, 2012,143(2):448-458.
[6] Martinez MC, Tual-Chalot S, Leonetti D, et al. Microparticles:targets and tools in cardiovascular disease[J]. Trends Pharmacol Sci, 2011,32(11):659-665.
[7] Buesing KL, Densmore JC, Kaul S, et al. Endothelial microparticles induce inflammation in acute lung injury[J]. J Surg Res, 2011,166(1):32-39.
[8] Jung C, Sorensson P, Saleh N, et al. Circulating endothelial and platelet derived microparticles reflect the size of myocardium at risk in patients with ST-elevation myocardial infarction[J]. Atherosclerosis, 2012,221(1):226-231.
[9] Pisetsky DS, Ullal AJ, Gauley J, et al. Microparticles as mediators and biomarkers of rheumatic disease[J]. Rheumatology (Oxford), 2012,51(10):1737-1746.
[10] 胡華.阻塞性睡眠呼吸暫停綜合征合并慢性阻塞性肺疾病的研究進展[J].山東醫藥,2009,49(5):107-109.
[11] Mieczkowski B, Ezzie ME. Update on obstructive sleep apnea and its relation to COPD[J]. Int J Chron Obstruct Pulmon Dis, 2014,8(9):349-362.
[12] Zhang W, Si LY. Obstructive sleep apnea syndrome and hypertension: pathogenic mechanisms and possible therapeutic approaches[J]. Ups J Med Sci, 2012,117(4):370-382.
[13] Li CJ, Liu Y, Chen Y, et al. Novel proteolytic microvesicles released from human macrophages after exposure to tobacco smoke[J]. Am J Pathol, 2013,182(5):1552-1562.
[14] Gordon C, Gudi K, Krause A, et al. Circulating endothelial microparticlesas a measure of early lung destruction in cigarette smokers[J]. Am J Respir Crit Care Med, 2011,184(2)224-232.
[15] Takahashi T, Kubo H. The role of microparticles in chronic obstructive pulmonary disease[J]. Int J Chron Obstruct Pulmon Dis, 2014,27(9):303-314.
[16] van Ierssel SH, Van Craenenbroeck EM, Conraads VM, et al. Flow cytometric detection of endothelial microparticles (EMP): effects of centrifugation and storage alter with the phenotype stuided[J]. Thromb Res, 2010,125(4):332-339.
[17] Maruyama K, Morishita E, Sekiya A, et al. Plasma levels of platelet-derived microparticles in patients with obstructive sleep apnea syndrome[J]. J Atheroscler Thromb, 2012,19(1):98-104.
[18] Wang ZY,Bai Y. Extravascular lung water and pulmonary vascular permeability index may inadvertently delay the identification of acute respiratory distress syndrome[J]. Crit Care, 2013,17(2):420.
武漢市醫療衛生科研項目(WX15D57)。
李承紅(E-mail: 15827636399@163.com)
10.3969/j.issn.1002-266X.2017.08.028
R563
B
1002-266X(2017)08-0086-03
2016-05-26)

