胃癌組織miR-215表達變化及其與患者預后的關系
刁卓,劉曉超,唐玉虎,范莉靜
(漢中市中心醫院,陜西漢中723000)
胃癌組織miR-215表達變化及其與患者預后的關系
刁卓,劉曉超,唐玉虎,范莉靜
(漢中市中心醫院,陜西漢中723000)
目的 探討miR-215在胃癌發生、發展中的作用。方法 選擇胃癌患者55例,取手術切除的胃癌組織及其配對的癌旁正常組織,采用qRT-PCR法檢測miR-215表達,并分析其與患者臨床病理參數及預后的關系。結果 胃癌組織miR-215的相對表達量明顯高于癌旁正常組織(P<0.05),且其表達與胃癌組織分化程度、淋巴結轉移、臨床病理分期等密切相關(P均<0.05),與患者性別、年齡無關(P均>0.05)。以miR-215相對表達量的中位值(2.83)為界值,胃癌患者miR-215高表達33例、miR-215低表達22例;生存分析顯示,miR-215高表達者中位生存時間顯著低于miR-215低表達者(P<0.05)。結論 miR-215在胃癌的發生、發展過程中起癌基因作用,其高表達者預后較差;miR-215有可能成為胃癌預后的監測指標。
胃癌;微小RNA-215;生存分析;預后
微小RNA(miRNA)是一類高度保守的小片段非編碼RNA,通過整合到RNA誘導的沉默復合物中,與其靶mRNA的3′非編碼區完全或不完全結合,降解靶mRNA或抑制翻譯,參與調節個體生長、發育及疾病發生過程相關基因的表達,在細胞分化、凋亡和腫瘤生成等過程中發揮重要作用[1]。有研究發現,在多種腫瘤組織中可檢測到異常表達的miRNAs,且其不易被RNA酶降解,在室溫放置超過24 h或反復凍融下仍十分穩定[2,3]。因此認為,miRNAs可作為理想的分子生物學標志物,用于腫瘤診斷、治療及預后評估等。miR-215是受p53誘導表達的一個miRNA,通過調控一系列細胞周期檢驗點蛋白表達,起到癌基因或抑癌基因作用[4]。大量研究證實,在結直腸癌、腎臟腫瘤、肝癌等組織中miR-215表達下調,發揮抑癌基因作用[3~6]。但在胃癌組織中miR-215表達上調,可能具有癌基因作用[7]。2010年1~4月,我們觀察了胃癌組織miR-215表達變化,并分析其表達與患者臨床病理參數及預后的關系。現分析結果并報告如下。
1 資料與方法
1.1 臨床資料 選擇同期在我院手術治療的胃癌患者55例,均經術后組織病理檢查明確診斷。所有患者臨床病理資料完整,術前未接受任何抗腫瘤治療,并排除遠處轉移者。其中,男31例、女24例,年齡30~69(56.09±8.26)歲;臨床分期:Ⅰ、Ⅱ期23例,Ⅲ、Ⅳ期32例;組織分化程度:中高分化21例,低分化34例;淋巴結轉移:有37例,無18例。本研究經醫院倫理委員會批準,患者均知情同意。
1.2 miR-215表達檢測 采用qRT-PCR法。取手術切除的胃癌組織及癌旁正常組織,TRIzol法提取組織總RNA,分光光度計檢測總RNA的濃度和純度合格后,-80 ℃冰箱保存。取總RNA約2 μg,采用逆轉錄酶逆轉錄成cDNA,-20 ℃冰箱保存。參照GeneBank提供的基因序列,由天根生化科技(北京)有限公司合成特異性目的基因引物。miR-215上游引物:5′-CTCGAGATGTCATCCTCAG-3′,下游引物:5′-GAATTCGTGAGTTCTTCTG-3′;內參GADPH上游引物:5′-AATCCCATCACCATCTTCCA-3′,下游引物:5′-CCTGCTYCAACCACCTTCTTG-3′。采用美國ABI StepOnePlus實時熒光定量PCR儀進行擴增反應。PCR反應體系:10×PCR buffer 2.5 μL,25 mmol/L MgCl21.5 μL,10 mmol/L dNTP 0.5 μL,5 U/μL Taq酶0.5 μL,10 mmol/L引物1 μL,cDNA 2 μL(相當于100 ng RNA),雙蒸水補足至25 μL。擴增條件:95 ℃熱啟動5 min,95 ℃變性20 s,60 ℃退火和延伸共1 min,共40個循環。在PCR擴增過程中,收集熒光信號,通過Bio-Rad CFX Manager軟件計算Ct值。以GADPH基因作為內參,采用2-ΔΔCt法計算miR-215的相對表達量。試驗重復3次,取平均值。
1.3 預后隨訪 所有患者術后定期電話隨訪,隨訪截至2016年4月。生存時間以月計算,以手術日至末次隨訪所獲得的截至時間為準。55例胃癌患者中,術后接受輔助化療38例,隨訪期間出現復發轉移43例,死亡39例;因其他疾病死亡2例,失訪1例。研究結束、其他原因死亡和失訪作為截尾數據處理。

2 結果
2.1 胃癌組織及癌旁正常組織miR-215表達比較 胃癌組織miR-215的相對表達量為3.18±0.36,癌旁正常組織為1.03±0.32,二者比較P<0.05。
2.2 胃癌組織miR-215表達與患者臨床病理參數的關系 見表1。
2.3 胃癌組織miR-215表達與患者預后的關系 以miR-215相對表達量的中位值(2.83)為界值,55例胃癌患者miR-215高表達33例、低表達22例。Kaplan-Meier生存曲線分析顯示,其中位生存時間分別為24.6、65.3個月,二者比較P<0.01。見圖1。
3 討論
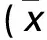
表1 胃癌組織miR-215表達與患者臨床病理參數的關系±s)

圖1 胃癌患者不同miR-215表達者的生存曲線
胃癌是源自胃黏膜上皮的惡性腫瘤,其發病率居所有消化系統惡性腫瘤的首位,是一種威脅人類健康的常見病、多發病[8]。胃癌的發生、發展是幽門螺桿菌感染、環境因素、遺傳因素共同作用的結果[9]。正常情況下,胃黏膜上皮細胞的增殖和凋亡保持動態平衡,而這種平衡的維持依賴于癌基因、抑癌基因及下游靶基因的共同調控。近年來,隨著醫療水平的不斷進步,胃癌患者的生存率有所提高,但5年生存率仍不足30%。侵襲和轉移是導致胃癌患者預后不良的主要原因[10,11]。由于胃癌的早期癥狀隱匿或無任何癥狀,易被誤診或漏診。 因此, 尋找敏感、 特異的分子生物學標志物一直是近年來研究的熱點。
miRNAs在進化過程中具有保守性,可參與細胞增殖、凋亡、分化及癌變等生命過程[12]。miR-215定位于人染色體1q41,在多種腫瘤組織中起癌基因或抑癌基因作用。Song等[3]研究發現,在骨肉瘤、結腸癌組織miR-215低表達,具有抑癌基因作用,并與化療耐藥有關。有研究發現,肺癌組織miR-215低表達,并通過下調靶基因ZEB2,參與腫瘤進展[13];還可通過調控相關靶基因TYMS、DHFR、TS及DTL表達,參與細胞增殖、凋亡等生物過程[13,14]。與其他實體腫瘤不同,miR-215在胃癌組織中高表達,具有癌基因作用,并與腫瘤侵襲和轉移明顯相關[15~17]。但目前其作用機制尚不清楚。有研究認為,miR-215可能通過下調靶基因活化白細胞黏附因子、MMP-9表達及抑制上皮間質轉化,參與胃癌的侵襲和轉移過程[18,19]。Jin等[18]通過miRNA芯片技術及實時熒光定量PCR技術證實,胃癌組織中miR-215的表達明顯高于癌旁正常組織,且其過表達可促進胃癌細胞HFE145的遷移。
本研究結果顯示,胃癌組織miR-215的相對表達量明顯高于癌旁正常組織,表明miR-215在胃癌的發生過程中起癌基因作用,與相關報道[20~22]基本一致。臨床分期Ⅲ、Ⅳ期者miR-215的相對表達量明顯高于Ⅰ、Ⅱ期者,組織分化程度低分化者明顯高于中高分化者,表明miR-215的相對表達量越高,腫瘤浸潤和侵襲能力越強;有淋巴結轉移者miR-215的相對表達量明顯高于無淋巴結轉移者,表明miR-215的相對表達量越高,腫瘤淋巴結轉移能力越強;但其表達與患者性別、年齡無關;與李良平等[23]報道基本一致。本研究還發現,miR-215高表達者中位生存時間明顯低于miR-215低表達者,提示miR-215表達越高,胃癌患者中位生存時間越短,預后越差。
綜上所述,miR-215在胃癌的發生過程中具有癌基因作用,可參與胃癌的侵襲和轉移過程,并與患者預后有關,有可能成為胃癌診斷及預后判斷的分子生物學標志物之一。
[1] Mitchell PS, Parkin RK, Kroh EM, et al. Circulating microRNA as stable blood-based markers for cancer detection[J]. Proc Natl Acad Sci U S A, 2008,105(30):10513-10518.
[2] Mongre RK, Sodhi SS, Ghosh M, et al. A new paradigm to mitigate osteosarcoma by regulation of microRNAs and suppression of the NF-κB signaling cascade[J]. Dev Reprod, 2014,18(4):197-212.
[3] Song B, Wang Y, Titmus MA, et al. Molecular mechanism of chemoresistance by miR-215 in osteosarcoma and colon cancer cells[J]. Mol Cancer, 2010(9):96.
[4] Georges SA, Biery MC, Kim SY, et al. Coordinated regulation of cell cycle transcripts by p53-inducible microRNAs, miRNA-192 and miRNA-215[J]. Cancer Res, 2008,68(24):10105-10112
[5] Khella HW, Bakhet M, Allo G, et al. miR-192, miR-194 and miR-215: a convergent microRNA network suppressing tumor progression in renal cell carcinoma[J]. Carcinogenesis, 2013,34(10):2231-2239.
[6] Liu F, You X, Chi X, et al. Hepatitis B virus X protein mutant HBxΔ127 promotes proliferation of hepatoma cells through up-regulating miR-215 targeting PTPRT[J]. Biochem Biophys Res Commun, 2014,444(2):128-134
[7] Deng Y, Huang Z, Xu Y, et al. MiR-215 modulates gastric cancer cell proliferation by targeting RB1[J]. Cancer Lett, 2013,342(1):27-35.
[8] Ferlay J, Autier P, Boniol M, et al. Eestimates of the cancer incidence and mortality in Europe in 2006[J]. Ann Oncol, 2007,18(3):581-592.
[9] 文亦磊,張錫流.EB病毒相關胃癌的研究新進展[J].廣東醫學,2015,36(8):1291-1293.
[10] Mahar AL, Mcleod RS, Kiss A, et al. A systematic review of the effect of institution and surgeon factors on surgical outcomes for gastric cancer[J]. J Am Coll Surg, 2012,214(5):860-868.
[11] Mcguill MJ, Byrne P, Ravi N, et al. The prognostic impact of occult lymph node metastasis in cancer of the esophagus or esophago-gastric junction: systematic review and meta-analysis[J]. Dis Esophagus, 2008,21(3):236-240.
[12] Wang D, Qiu C, Zhang H, et al. Human microRNA oncogenes and tumor suppressors show significantly different biological patterns: from functions to targets[J]. PLoS One, 2010,5(9):855-867.
[13] Hou Y, Zhen J, Xu X, et al. miR-215 functions as a tumor suppressor and directly targets ZEB2 in human non-small cell lung cancer[J]. Oncol Lett, 2015,10(4):1985-1992.
[14] Fassan M, Volinia S, Palatini J, et al. MicroRNA expression profiling in the histological subtypes of barrett′s metaplasia[J]. Clin Transl Gastroenterol, 2013(4):e34.
[15] Wang B, Herman-Edelstein M, Koh P, et al. E-cadherin expression is regulated by miR-192/215 by a mechanism that is independent of the profibrotic effects of transforming growth factor-beta[J]. Diabetes, 2010,59(7):1794-1802.
[16] Chiang Y, Zhou X, Wang Z, et al. Expression levels of microRNA-192 and -215 in gastric carcinoma[J]. Pathol Oncol Res, 2012,18(3):585-591.
[17] Ueda T, Volinia S, Okumura H, et al. Relation between microRNA expression and progression and prognosis of gastric cancer: a microRNA expression analysis[J]. Lancet Oncol, 2010,11(2):136-146.
[18] Jin Z, Selaru FM, Cheng Y, et al. MicroRNA-192 and -215 are upregulated in human gastric cancer in vivo and suppress ALCAM expression in vitro[J]. Oncogene, 2011,30(13):1577-1585.
[19] 周志威,聶玉強,杜艷蕾,等.活化白細胞黏附分子在胃癌組織中的表達及其調控機制[J].廣東醫學,2013,34(18):2784-2788.
[20] Xu YJ, Fan Y. MiR-215/192 participates in gastric cancer progression[J]. Clin Transl Oncol, 2015,17(1):34-40.
[21] 李良平,龍思澤,高采平.胃癌患者血清microRNA-192和microRNA-215的表達及臨床意義[J].中華臨床醫師雜志(電子版),2013,7(12):5223-5227.
[22] Chiang Y, Zhou X, Wang Z, et al. Expression levels of microRNA-192 and -215 in gastric carcinoma[J]. Pathol Oncol Res, 2012,18(3):585-591.
[23] 李良平,龍思澤,高采平.胃癌患者血清microRNA-192和microRNA-215的表達及臨床意義[J].中華臨床醫師雜志(電子版),2013,7(12):5223-5227.
10.3969/j.issn.1002-266X.2017.08.026
R735.2
B
1002-266X(2017)08-0080-03
2016-05-27)

