胃癌CINV患者血漿胃饑餓素水平變化及其臨床意義
王宏波,劉洋,公衍玲
(1即墨市人民醫院,山東青島266200;2青島科技大學化工學院)
胃癌CINV患者血漿胃饑餓素水平變化及其臨床意義
王宏波1,劉洋2,公衍玲2
(1即墨市人民醫院,山東青島266200;2青島科技大學化工學院)
目的 探討胃饑餓素(Ghrelin)在胃癌化療相關惡心嘔吐(CINV)發生中的作用。方法 選擇行根治性遠端胃切除術的胃癌患者102例,術后行FOLFOX4方案化療1周期,化療后出現CINV者74例(CINV組),未出現CINV者28例(非CINV組)。所有患者分別于化療前1天及化療第2、3、4、6、12天檢測血漿Ghrelin和胃排空率。血漿Ghrelin檢測采用ELISA法,胃排空率檢測采用標準試餐與鋇條行上腹部X線攝片法。 比較兩組化療前后血漿Ghrelin水平和胃排空率變化;分析CINV組胃排空率與血漿Ghrelin水平的關系。結果 CINV組血漿Ghrelin水平及胃排空率在化療第2~4天較化療前明顯下降(P<0.05或<0.01),非CINV組二者變化不明顯(P均>0.05);相關分析發現,CINV患者胃排空率與血漿Ghrelin水平下降呈直線相關關系(R2=0.814 3,P<0.05)。結論 Ghrelin可能參與胃癌CINV的發生;其機制可能與胃排空延緩有關。
胃癌;化療相關性惡心嘔吐;胃饑餓素;胃排空率
胃癌是臨床最常見的惡性腫瘤之一,病死率較高,外科手術是其主要治療手段[1]。輔助化療對于降低腫瘤的復發和轉移、提高患者5年生存率等具有重要意義[1,2]。化療相關惡心嘔吐(CINV)是化療過程中最常見的不良反應,嚴重者會導致患者發生脫水、電解質紊亂、營養缺乏,從而降低對化療的依從性,部分患者因此中止化療[3,4]。胃饑餓素(Ghrelin)是一種含有28個氨基酸的多肽,可促進生長激素釋放、調節食欲和營養攝入、促進胃腸運動和胃液分泌[5~7]。在嚙齒類動物發生CINV的早期階段,循環血中Ghrelin水平下降,給予外源性Ghrelin可明顯緩解CINV癥狀[8]。本研究探討血漿Ghrelin水平與胃癌CINV的關系,旨在為胃癌CINV的防治提供依據。
1 資料與方法
1.1 臨床資料 選擇2015年8月~2016年7月在即墨市人民醫院行根治性遠端胃切除術的胃癌患者102例,均經胃鏡活檢組織病理檢查明確診斷。納入標準:①遠端胃癌,組織學分型為胃腺癌;②國際抗癌聯盟/美國癌癥聯合委員會胃癌TNM分期標準(2010)Ⅱ期以上;③身體狀況較好,KPS評分≥90分。排除合并嚴重心、肝、肺、腎等重要臟器疾病者,血液系統疾病以及有其他部位惡性腫瘤者。所有患者術后3周行FOLFOX4方案化療:奧沙利鉑85 mg/m2靜滴2 h,第1天;亞葉酸鈣200 mg/m2靜滴,第1、2天;5-氟尿嘧啶(5-Fu)400 mg/m2靜推,第1、2天,5-Fu 600 mg/m2持續靜滴,第1、2天;14天為1周期。化療1周期結束,根據WHO關于化療藥物引起惡心、嘔吐的分級標準[9],出現CINV者74例(CINV組),男51例、女23例,年齡(50.7±14.9)歲;未出現CINV者28例(非CINV組),男18例、女10例,年齡(48.5±11.2)歲。兩組性別、年齡具有可比性。
1.2 血漿Ghrelin及胃排空率檢測 ①血漿Ghrelin檢測:所有患者于化療前1天及化療第2、3、4、6、12天清晨空腹采集肘靜脈血2 mL,離心取上層血漿,-20 ℃保存;采用雷杜RT-6100酶標儀、ELISA法檢測血漿Ghrelin。②胃排空率檢測:所有患者于化療前1天及化療第2、3、4、6、12天,采用標準試餐與鋇條行上腹部X線攝片法檢測胃排空率。檢測前禁食8 h,檢測時服用標準試餐,即康師傅排骨碗面1盒(80 g),100 ℃開水400 mL泡熟,15 min內食用完畢,進餐期間服用含25根鋇條的膠囊。進餐5 h后行上腹部X射線檢查,記錄胃內鋇條數量。胃排空率(%)=[(25-胃殘留鋇條數量)/25]×100%。以進餐后5 h胃排空率低于50%為胃排空延緩。分析CINV組血漿Ghrelin水平與胃排空率的關系。

2 結果
2.1 兩組化療前后血漿Ghrelin水平及胃排空率比較 見表1。
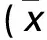
表1 兩組化療前后血漿Ghrelin水平及胃排空率比較±s)
注:與同組化療前1天比較,*P<0.05,#P<0.01;與同時間點非CINV組比較,△P<0.01。
2.2 CINV組血漿Ghrelin水平與胃排空率的關系 直線相關分析顯示,CINV組血漿Ghrelin水平與胃排空率呈直線相關關系(R2=0.814 3,P<0.05)。
3 討論
嘔吐是胃的逆蠕動,是胃的運動形式之一。嘔吐發生的不同時期均存在胃運動功能紊亂。Cabezos等[10]研究發現,惡心嘔吐的發生伴隨胃運動的停滯、胃排空延遲以及胃擴張,并呈劑量依賴關系。CINV是一個相當復雜的病理反射過程,其發生機制復雜,目前尚未完全闡明。一般認為,化療藥物主要通過以下三個途徑引發嘔吐[11,12]:①損傷消化道黏膜,促進腸嗜鉻細胞釋放5-羥色胺(5-HT)等物質,刺激腸壁傳入迷走神經上的5-HT受體,興奮延髓嘔吐中樞;②作用于第四腦室的催吐化學感受區;③感覺、精神因素直接刺激大腦皮質通路導致嘔吐,此類多見于預期性CINV,是一種條件反射,大多是因為患者在前一次化療時經歷了難以控制的CINV,在下一次化療開始之前即出現惡心嘔吐。
Ghrelin最早在大鼠胃組織提取物中分離、純化的一種含有28個氨基酸的多肽,是迄今為止發現的生長激素促分泌素受體惟一的天然內源性配體[13]。Ghrelin的組織分布較廣,如丘腦、垂體、甲狀腺、心臟、胰腺、肺、腎、胎盤、肌肉、生殖系統和脂肪組織等[13]。Ghrelin具有促進生長激素分泌,調節攝食及機體新陳代謝、促進胃酸分泌等一系列生物學活性[14]。近年發現,Ghrelin還是一種促食欲素,目前其在CINV中的作用越來越受到關注。有研究發現,在雪貂腦室內注射Ghrelin可顯著減少腹腔注射順鉑引起的干嘔和嘔吐次數[15];大鼠給予順鉑24、48 h,下丘腦Ghrelin分泌量顯著下降,側腦室微量注射Ghrelin可顯著增加攝食量[16];在腫瘤化療相關性消化不良的動物模型中,胃和下丘腦Ghrelin受體會發生適應性上調,同時伴有血漿乙酰化Ghrelin比例升高,但Ghrelin mRNA表達未見增加[17]。
本研究102例胃癌患者,化療后74例患者出現不同程度CINV,CINV的發生率與Mitchell等[18]報道相似;CINV組血漿Ghrelin水平及胃排空率在化療第2~4天較化療前明顯下降,而非CINV組二者變化不明顯;相關分析發現,CINV患者血漿Ghrelin水平與胃排空率呈直線相關關系。推測血漿Ghrelin水平降低與CINV的發生有關,化療藥物可導致血漿Ghrelin水平降低,進一步引起胃排空延遲。Ghrelin有可能成為治療CINV的一個新靶點。
[1] Brenkman HJ, Haverkamp L, Ruurda JP, et al. Worldwide practice in gastric cancer surgery[J]. World J Gastroenterol, 2016,22(15):4041-4048.
[2] de Mestier L, Lardière-Deguelte S, Volet J, et al. Recent insights in the therapeutic management of patients with gastric cancer[J]. Dig Liver Dis, 2016,48(9):984-994.
[3] Ballatori E, Roila F, Ruggeri B, et al. The impact of chemotherapy-induced nausea and vomiting on health related quality of life[J]. Support Care Cancer, 2007,15(2):179-185.
[4] Hesketh PJ. Chemotherapy-induced nausea and vomiting[J]. N Engl J Med, 2008,358(23):2482-2494.
[5] Kojima M, Kangawa K. Ghrelin: from gene to physiological function[J]. Results Probl Cell Differ, 2010(50):185-205.
[6] Taniguchi H, Ariga H, Zheng J, et al. Effects of ghrelin on interdigestive contractions of the rat gastrointestinal tract[J]. World J Gastroenterol, 2008,14(41):6299-6302.
[7] Perboni S, Inui A. Appetite and gastrointestinal motility: role of ghrelin-family peptides[J]. Clin Nutr, 2010,29(2):227-234.
[8] Liu YL, Malik NM, Sanger GJ, et al. Ghrelin alleviates canancer chemotherapy-associated dyspepsia in rodents[J]. Cancer Chemother Pharmacol, 2006,58(3):326-333.
[9] 黃回,胡雁.化療相關性惡心嘔吐評估工具的研究進展[J].護理與康復,2012,11(10):924-927.
[10] Cabezos PA, Vera G, Castillo M, et al. Radiological study of gastrointestinal motor activity after acute cisplatin in the rat[J]. Auton Neurosci, 2008,141(1-2):54-65.
[11] Galanski M. Recent developments in the field of anticancer platinum complexes[J]. Recent Pat Anticancer Drug Discov, 2006,1(2):285-295.
[12] Minami M, Endo T, Hamaue N, et al. Serotonin and anticancer drug-induced emesis[J]. Yakugaku Zasshi, 2004,124(8):491-507.
[13] Argilés JM, Stemmler B. The potential of ghrelin in the treatment of cancer cachexia[J]. Expert Opin Biol Ther, 2013,13(1):67-76.
[14] Seim I, El-Salhy M, Hausken T, et al. Ghrelin and the brain-gut axis as a pharmacological target for appetite control[J]. Curr Pharm Des, 2012,18(6):768-775.
[15] Rudd JA, Ngan MP, Wai MK, et al. Anti-emetic activity of ghrelin in ferrets exposed to the cytotoxic anti-cancer agent cisplatin[J]. Neurosci Lett, 2006,392(1-2):79-83.
[16] Yakabi K, Sadakane C, Noguchi M, et al. Reduced ghrelin secretion in the hypothalamus of rats due to cisplatin-induced anorexia[J]. Endocrinology, 2010,151(8):3773-3382.
[17] Malik NM, Moore GB, Kaur R, et al. Adaptive upregulation of gastric and hypothalamic ghrelin receptors and increased plasma ghrelin in a model of cancer chemotherapy-induced dyspepsia[J]. Regul Pept, 2008,148(1-3):33-38.
[18] Mitchell EP. Gastrointestinal toxicity of chemotherapeutic agents[J]. Semin Oncol, 1992,19(5):566-579.
國家自然科學基金資助項目(81300281);山東省高等學校科技計劃項目(J15LK12)。
公衍玲(E-mail: hanyu_ma@126.com)
10.3969/j.issn.1002-266X.2017.08.018
R735.2
B
1002-266X(2017)08-0059-03
2016-10-18)

