低頻超聲聯合載順鉑超聲微泡造影劑對卵巢癌細胞增殖和凋亡的影響
孫佳星,蔡愛露
(中國醫科大學附屬盛京醫院,沈陽110000)
低頻超聲聯合載順鉑超聲微泡造影劑對卵巢癌細胞增殖和凋亡的影響
孫佳星,蔡愛露
(中國醫科大學附屬盛京醫院,沈陽110000)
目的 探討低頻超聲聯合載順鉑超聲微泡造影劑對卵巢癌細胞增殖和凋亡的影響及機制。方法 體外培養人卵巢癌OVCAR-3細胞,隨機分為對照組、超聲組、順鉑組、超聲聯合順鉑組和超聲聯合順鉑微泡組。各組常規培養,順鉑組、超聲聯合順鉑組加入順鉑至終濃度為10 μg/mL;超聲聯合順鉑微泡組加入載順鉑超聲微泡造影劑至順鉑終濃度為10 μg/mL;超聲聯合順鉑組、超聲聯合順鉑微泡組同時予低頻超聲處理3 min。超聲組僅予低頻超聲處理3 min,對照組不予任何處理。培養24 h,采用 CCK-8法檢測各組細胞增殖能力;流式細胞術檢測各組細胞凋亡率;Western blotting法檢測各組Bax、Bcl-2和Caspase-3的相對表達量。結果 細胞增殖能力:超聲聯合順鉑微泡組<超聲聯合順鉑組<順鉑組<超聲組<對照組,組間兩兩比較P均<0.05。細胞凋亡率:超聲聯合順鉑微泡組>超聲聯合順鉑組>順鉑組>超聲組>對照組,組間兩兩比較P均<0.05。Bax、Caspase-3的相對表達量:超聲聯合順鉑微泡組>超聲聯合順鉑組>順鉑組>超聲組>對照組;Bcl-2的相對表達量:超聲聯合順鉑微泡組<超聲聯合順鉑組<順鉑組<超聲組<對照組;組間兩兩比較P均<0.05。結論 低頻超聲聯合載順鉑微泡造影劑可抑制卵巢癌細胞增殖,誘導其凋亡,其效果強于低頻超聲聯合順鉑、單用低頻超聲或順鉑;其機制可能與提高細胞內Caspase-3、Bax表達,降低Bcl-2表達有關。
卵巢癌;低頻超聲;順鉑;超聲微泡造影劑;細胞凋亡;細胞增殖
順鉑是治療卵巢癌的常見化療藥物[1],但其毒副反應多,且近年來耐藥率逐漸升高[2]。增加卵巢癌細胞對順鉑的敏感性、提高順鉑局部濃度是目前臨床研究的熱點。有研究證實,低頻超聲(頻率<1.5 MHz)可誘導腫瘤細胞凋亡[3~5],并促進某些腫瘤相關基因的表達[6]。Korosoglou等[7]研究發現,可將化療藥物置入微泡注入人體,然后用低頻超聲照射腫瘤組織,微泡在低頻超聲“空化效應”下發生不對稱的壓縮和膨脹,直至破裂,釋放出化療藥物,達到靶向治療的目的。目前低頻超聲聯合載順鉑超聲微泡造影劑已用于治療宮頸癌、腎癌等[8]。2016年1~8月,本研究探討低頻超聲聯合載順鉑微泡造影劑對卵巢癌細胞增殖和凋亡的影響,并對其作用機制進行初步探討。
1 材料與方法
1.1 材料 人卵巢癌細胞系OVACR-3購自中國科學院上海細胞生物研究所,置于含10% FBS的DMEM培養基中,37 ℃、5% CO2培養箱中培養。順鉑、載順鉑微泡和DMSO購自北京索萊寶科技有限公司;FBS和DMEM培養基購自美國Gibco公司;胰蛋白酶購自美國Sigma公司;超聲波治療儀購自深圳市圣祥高科技有限公司;CCK-8試劑盒和凋亡試劑盒購自沈陽萬類生物科技有限公司;流式細胞儀購自美國BD公司;多功能酶標儀購自美國Molecular Devices公司;兔抗人Bax、Bcl-2、Caspase-3和GAPDH多克隆抗體購自武漢三鷹生物技術有限公司;辣根酶標記的羊抗兔IgG購自北京中衫金橋生物技術有限公司。
1.2 細胞分組及處理 取對數生長期OVACR-3細胞制成密度為1×106個/mL的單細胞懸液。實驗前用DMEM溶解載順鉑超聲微泡和順鉑備用。 將OVCAR-3細胞隨機分為對照組、超聲組、順鉑組、超聲聯合順鉑組和超聲聯合順鉑微泡組,每組3管。對照組細胞常規培養,不作任何處理。順鉑組、超聲聯合順鉑組加入順鉑至終濃度為10 μg/mL,超聲聯合順鉑微泡組加入載順鉑超聲微泡造影劑至順鉑終濃度為10 μg/mL;超聲聯合順鉑組和超聲聯合順鉑微泡組同時予低頻超聲處理,頻率840 kHz,聲強0.75 W/cm2,時間3 min。超聲組僅予低頻超聲處理。各組繼續培養24 h。
1.3 相關指標觀察
1.3.1 細胞增殖能力 取各組細胞置入96孔板中,每孔100 μL(含1×104個細胞),加入10 μL CCK-8溶液,37 ℃孵育4 h。采用酶標儀測定各組450 nm 波長處的吸光度(OD)值。以OD值表示細胞增殖能力。
1.3.2 細胞凋亡率 取各組對數生長期細胞制成密度為1×106個/mL的細胞懸液。分別取100 μL細胞懸液置入5 mL離心管中,加入FITC Annexin V和PI各5 μL,混勻,避光,室溫孵育15 min,每管加400 μL的1×結合液。采用流式細胞儀檢測各組細胞凋亡率。
1.3.3 細胞內Bax、Bcl-2、Caspase-3表達 取各組細胞,RIPA裂解,超聲破碎細胞,11 000 r/min離心20 min,取上清,采用BCA蛋白濃度測定試劑盒檢測樣品蛋白濃度合格。取部分蛋白樣品加入5×上樣緩沖液煮沸5 min。然后行SDS-聚丙烯酰胺凝膠電泳分離后,轉印至聚偏二氟乙烯膜。5%脫脂奶粉封閉1.5 h,一抗孵育,4 ℃過夜。山羊抗兔二抗孵育2 h,ECL發光,顯影液顯影,定影液定影。用Image J軟件分析各條帶灰度值。以目的蛋白條帶灰度值與GAPDH蛋白條帶灰度值的比值作為目的蛋白的相對表達量。
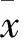
2 結果
2.1 各組細胞增殖能力比較 對照組、超聲組、順鉑組、超聲聯合順鉑組和超聲聯合順鉑微泡組OD450值分別為0.931±0.053、0.752±0.032、0.632±0.042、0.553±0.036、0.423±0.023。組間兩兩比較P均<0.05。
2.2 各組細胞凋亡率比較 對照組、超聲組、順鉑組、超聲聯合順鉑組和超聲聯合順鉑微泡組細胞凋亡率分別為(8.23±0.92)%、(10.21±1.02)%、(16.33±0.98)%、(20.54±1.33)%、(25.32±1.74)%。組間兩兩比較P均<0.05。
2.3 各組Bax、Bcl-2、Caspase-3表達比較 各組間Bax、Bcl-2、Caspase-3的相對表達量,兩兩比較P均<0.05。見表1。
3 討論
表1 各組Bax、Bcl-2、Caspase-3的相對表達量
隨著微泡造影劑研究的不斷進展,超聲聯合微泡造影劑在腫瘤性疾病中的應用越來越受到關注。超聲微泡造影劑發展經歷了三個階段,第一代為含空氣或氧氣的無包膜氣泡,尺寸較大,不穩定,不能由外周靜脈注入[9];第二代為外圍包裹一層白蛋白、脂類、聚合物或表面活性劑膜殼的空氣氣泡,穩定性較好且體積較小,在血液中僅持續5 min左右[10];第三代為含氟碳類氣體,外有膜包裹,在血液中可持續15 min以上,穩定性進一步提高[11]。微泡造影劑的不斷革新是超聲聯合微泡成為腫瘤輔助化療或靶向治療的基礎。攜帶化療藥物的微泡造影劑可在超聲“空化效應”的介導下破裂,在靶組織區域釋放藥物,不僅能增加局部藥物濃度,還可減輕化療藥物的毒副作用[12];同時微泡造影劑所產生的機械能可進一步增加細胞膜的通透性,促進藥物分子進入細胞內。低頻超聲聯合微泡的治療效果已在多種腫瘤中得到了驗證。王娜等[13]研究發現,利用小于1 MHz低頻超聲聯合紫杉醇微泡造影劑介導藥物釋放,可明顯抑制宮頸癌HeLa細胞增殖并能誘導其凋亡。Xu等[14]研究發現,低頻超聲輻照辛伐他汀微泡可通過下調Caveolin-1蛋白的表達,促進前列腺癌DU145細胞凋亡,并增強DU145細胞對化療藥物的敏感性。由此可見,低頻超聲聯合微泡造影劑在腫瘤治療中具有廣闊的應用前景。但其目前仍處于實驗階段,依然有較多問題亟待解決。
本研究結果顯示,低頻超聲聯合載順鉑超聲微泡可抑制卵巢癌OVCAR-3細胞增殖,并誘導其凋亡,其效果強于低頻超聲聯合順鉑及單用低頻超聲或順鉑。微泡造影劑是一種直徑為1~8 μm,內含高密度惰性氣體、外部有單層膜包裹的微氣泡,具有良好的彈性和穩定性,對聲壓具有較強的抵抗力。研究證實,低頻超聲可促使微泡造影劑發生周期性的壓縮和膨脹,當微泡的震蕩加劇到一定程度就會破裂,即“空化效應”[15]。將低頻超聲聯合攜帶某些藥物或基因微泡造影劑,然后將微泡造影劑靜脈注入體內,用低頻超聲照射特定組織,微泡在低頻超聲的“空化效應”下發生破裂,致使微泡所攜帶的藥物釋放到組織周圍,從而增加了局部的藥物濃度[16];與此同時,低頻超聲導致細胞膜產生一過性空隙,促使細胞膜的通透性增加,即所謂的“聲孔效應”[8]。這一效應進一步促進藥物分子的攝入。通過以上兩種作用,低頻超聲聯合微泡造影劑可增加藥物的靶向利用率,并能減輕其毒副反應。
本研究結果顯示,單純低頻超聲對卵巢癌細胞也具有促進凋亡、抑制增殖的作用。Sergeeva等[17]研究發現,頻率為26.5 kHz的低頻超聲處理MCF-7細胞15 s,MCF-7細胞增殖率降低;楊志宏等[18]研究發現,用低頻超聲處理的卵巢癌COC1細胞增殖能力降低,細胞凋亡率升高。有學者認為,這可能與低頻超聲的“空化效應”有關。低頻超聲處理使細胞產生大量的自由基,并通過打斷DNA雙鏈的聚合過程,阻斷腫瘤細胞正常復制,抑制腫瘤細胞增殖[19]。不僅如此,低頻超聲還可對細胞的結構和功能產生調節作用,如細胞膜通透性會在“聲孔效應”作用下發生一過性增加,導致細胞裂解[20]。
凋亡是細胞自我程序性死亡,是由基因控制的有序性死亡。細胞凋亡途徑包括內源性和外源性途徑[21]。外源性凋亡途徑是通過凋亡刺激因子與細胞表面相關受體結合,直接激活下游的Caspase效應分子而誘導凋亡[22]。內源性凋亡途徑是由線粒體激活的細胞凋亡過程,線粒體在此過程中具有核心作用。負責監管線粒體依賴凋亡途徑的是Bcl-2蛋白家族。 Bcl-2凋亡蛋白根據其結構可分為BH3-單域蛋白組和多域蛋白組[23]。BH3單域蛋白通常在胞質中無活性,當運至線粒體時,要么激活多域蛋白Bax和Bak,要么滅活Bcl-2抗凋亡蛋白Bcl-2和Bcl-xL[24]。本研究結果顯示,與其他各組相比,超聲聯合順鉑微泡組Caspase-3、Bax蛋白表達升高,Bcl-2表達下降,原因可能是超聲聯合順鉑微泡組卵巢癌OVCAR-3細胞凋亡率高于其余各組。
綜上所述,超聲聯合載順鉑超聲微泡造影劑可抑制卵巢癌細胞增殖,并誘導其凋亡。本研究為超聲聯合微泡造影劑在卵巢癌的臨床治療提供了理論依據。該方法對腫瘤的靶向治療具有廣闊的應用前景,但仍存在許多問題需要進一步研究與探索。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] van Haaften C, Boot A, Corver WE, et al. Synergistic effects of the sesquiterpene lactone, EPD, with cisplatin and paclitaxel in ovarian cancer cells [J]. J Exp Clin Cancer Res, 2015(34):38.
[3] 王婧,羅子國,李劍.低頻超聲增強雙氫青蒿素誘導前列腺癌PC-3細胞凋亡的生物學效應研究[J].重慶醫學,2013,42(23):2706-2709.
[4] 呂慧娜,任衛東,孫璐.低頻超聲聯合紫杉醇對人乳腺癌MCF-7細胞增殖和凋亡的影響[J].解剖科學進展,2015,21(3):256-259.
[5] 孫佳星,李經緯,蔡愛露.低頻超聲聯合苦參素對人卵巢癌OVCAR-3細胞生物學特性影響[J].臨床軍醫雜志,2016,44(1):14-18.
[6] Tabuchi Y, Takasaki I, Wada S, et al. Genes and genetic networks responsive to mild hyperthermia in human lymphoma U937 cells [J]. Int J Hyperthermia, 2008,24(8):613-622.
[7] Korosoglou G, Hardt SE, Bekeredjian R, et al. Ultrasound exposure can increase the membrane permeability of human neutrophil granulocytes containing microbubbles without causing complete cell destruction [J]. Ultrasound Med Biol, 2006,32(2):297-303.
[8] Frenkel V. Ultrasound mediated delivery of drugs and genes to solid tumors[J]. Adv Drug Deliv Rev, 2008,60(10):1193-1208.
[9] Deng CX, Lizzi FL. A review of physical phenomena associated with ultrasonic contrast agents and illustrative clinical applications [J]. Ultrasound Med Biol, 2002,28(3):277-286.
[10] Tinkov S, Bekeredjian R, Winter G, et al. Microbubbles as ultrasound triggered drug carriers[J]. J Pharm Sci, 2009,98(6):1935-1961.
[11] 王志剛.超聲微泡造影劑在疾病診斷與治療中的研究進展[J].中國醫學影像技術,2005,21(8):1148-1150.
[12] 張萍.超聲微泡造影劑在基因轉移中的應用[J].中國醫學影像技術,2004,20(3):362-364.
[13] 王娜,熊正愛,王志剛,等.超聲破壞載紫杉醇微泡對宮頸癌細胞株HeLa的抑制增殖及誘導凋亡作用[J].中國超聲醫學雜志,2008,24(8):692-695.
[14] Xu WP, Shen E, Bai WK, et al. Enhanced antitumor effects of low-frequency ultrasound and microbubbles in combination with simvastatin by downregulating caveolin-1 in prostatic DU145 cells[J]. Oncol Lett, 2014,7(6):2142-2148.
[15] 劉娟,吳鳳林.超聲激勵微泡“空化效應”在腫瘤治療方面的研究進展[J].重慶醫學,2014,43(3):358-361.
[16] Liu Y, Miyoshi H, Nakamura M. Encapsulated ultrasound microbubbles: therapeutic application in drug/gene delivery[J]. J Control Release, 2006,114(1):89-99.
[17] Sergeeva NS, Sviridova IK, Nikolaev AL, et al. Effects of various modes of sonication with low frequency ultrasound on in vitro survival of human tumor cells[J]. Bull Exp Biol Med, 2001,131(3):279-282.
[18] 楊志宏,王智彪,于廷和.低頻超聲對卵巢癌COC1細胞增殖和凋亡的影響[J].腫瘤防治研究,2004,31(5):249-251.
[19] 石林,姜藻,吳巍.低頻超聲治療腫瘤的機理研究進展[J].實用腫瘤學志,2006,20(1):73-75.
[20] Walton CB, Shohet RV. Tiny bubbles and endocytosis[J]. Circ Res, 2009,104(5):563-565.
[21] Bizzarri M, Proietti S, Cucina A, et al. Molecular mechanisms of the pro-apoptotic actions of melatonin in cancer: a review[J]. Expert Opin Ther Targets, 2013,17(12):1483-1496.
[22] Croce CM, Reed JC. Finally, an apoptosis-targeting therapeutic for cancer[J]. Cancer Res, 2016,76(20):5914-5920.
[23] Kiraz Y, Adan A, Kartal Yandim M, et al. Major apoptotic mechanisms and genes involved in apoptosis[J]. Tumour Biol, 2016,37(7):8471-8486.
[24] Wong RS. Apoptosis in cancer: from pathogenesis to treatment[J]. J Exp Clin Cancer Res, 2011(30):87.
蔡愛露(E-mail: caial1224@sina.com)
10.3969/j.issn.1002-266X.2017.08.013
R737.31
A
1002-266X(2017)08-0044-03
2016-09-22)
天津市應用基礎及前沿技術研究計劃(10JCYBJC13600);天津醫科大學科學基金青年項目(2014KYQ18)。

