食管間質成纖維細胞在裸鼠食管癌種植瘤形成中的作用
徐志彬,鄭秀麗,吳明利,王士杰,袁麗
(河北醫科大學第四醫院,石家莊050011)
食管間質成纖維細胞在裸鼠食管癌種植瘤形成中的作用
徐志彬,鄭秀麗,吳明利,王士杰,袁麗
(河北醫科大學第四醫院,石家莊050011)
目的 探討不同病變階段食管間質成纖維細胞對裸鼠食管癌種植瘤形成的影響。方法 從人正常食管組織、食管癌前病變組織、食管癌組織中分離、培養正常食管間質成纖維細胞(NFs)、食管不典型增生間質成纖維細胞(AFs)和食管癌相關纖維母細胞(CAFs),并與食管癌細胞ECa109按1∶1混合。選擇裸鼠80只,隨機分為ECa109組、NFs+ECa109組、AFs+ECa109組、CAFs+ECa109組,每組20只。分別于裸鼠右肩胛皮下接種ECa109、NFs+ECa109、AFs+ECa109、CAFs+ECa109。比較四組成瘤率、成瘤時間以及腫瘤組織α-SMA、PCNA陽性染色情況和腫瘤間質微血管密度(MVD)。結果 成瘤率:NFs+ECa109組、AFs+ECa109組、CAFs+ECa109組均為100%,ECa109組為80%。成瘤時間:AFs+ECa109組、CAFs+ECa109組明顯短于ECa109組、NFs+ECa109組(P均<0.05),而AFs+ECa109組與CAFs+ECa109組、ECa109組與NFs+ECa109組比較差異均無統計學意義(P均>0.05)。α-SMA染色:ECa109組為弱陽性,NFs+ECa109組、AFs+ECa109組、CAFs+ECa109組均為強陽性。PCNA陽性表達率:四組均為100%。MVD:AFs+ECa109組、CAFs+ECa109組明顯多于ECa109組、NFs+ECa109組(P均<0.05),AFs+ECa109組與CAFs+ECa109組、ECa109組與NFs+ECa109組比較差異均無統計學意義(P均>0.05)。結論 食管間質成纖維細胞與食管癌的發生和發展密切相關,其表型發生改變的AFs和CAFs促癌作用更強。
食管癌;種植瘤;成纖維細胞;裸鼠
在腫瘤-宿主界面微環境中的成纖維細胞具有獨特的生物學功能,在腫瘤微血管的形成和發展、腫瘤生長、侵襲過程中扮演重要角色[1~5]。研究證實,在癌組織微環境中存在癌相關纖維母細胞(CAFs),與正常間質成纖維細胞(NFs)的生物學特性明顯不同[6~8]。本課題組前期研究發現,在食管癌前病變組織中存在不典型增生間質成纖維細胞(AFs),其表型與NFs明顯不同,與CAFs趨向一致[9]。為研究這3種食管間質成纖維細胞的生物學特性,2014年3~12月,我們觀察了NFs、AFs、CAFs在裸鼠食管癌種植瘤形成中的作用。現分析結果并報告如下。
1 材料與方法
1.1 材料 人食管癌細胞株ECa109,購自中國科學院細胞中心。人食管間質成纖維細胞分別取自我院胸外科手術切除或內鏡下黏膜剝離的正常食管組織、食管癌前病變組織及食管癌組織,經分離、培養、純化后獲得NFs、AFs、CAFs,凍存于我院實驗動物中心。雄性BALB/c裸鼠80只,4~6周齡,體質量17~20 g,購自北京華阜康生物科技股份有限公司。所有裸鼠在我院實驗動物中心SPF條件下飼養;所需墊料、飼料和飲水經滅菌處理,高效過濾器換氣10~15次/h,相對濕度46%~60%,每日保持10 h光照、14 h無光的陰暗周期。α平滑肌肌動蛋白(α-SMA)鼠抗人單克隆抗體、增殖細胞核抗原(PCNA)鼠抗人單克隆抗體及CD34大鼠抗小鼠單克隆抗體均購自北京西雅金橋生物技術有限公司。櫻花全自動組織包埋機,日本櫻花公司;RM2135型切片機,德國Leica公司;CS-Ⅵ型攤片烤片機,孝感市宏業醫用儀器有限公司;BX光學顯微鏡,日本奧林巴斯公司;尼康Nikon顯微照相機,日本Nikon公司。
1.2 動物分組及處理 采用DMEM/F12培養基分別培養NFs、AFs、CAFs和ECa109細胞,于對數生長期消化細胞并計數;PBS洗滌后懸浮于PBS中,3種成纖維細胞與癌細胞分別按1∶1混合(細胞密度為1×107個/mL)備用,另取懸浮ECa109細胞5×106個/mL備用。隨機將80只裸鼠分為ECa109組、NFs+ECa109組、AFs+ECa109組、CAFs+ECa109組,每組20只。ECa109組、NFs+ECa109組、AFs+ECa109組、CAFs+ECa109組分別于裸鼠右肩胛皮下接種ECa109、NFs+ECa109、AFs+ECa109和CAFs+ECa109混懸液1 mL。
1.3 相關指標觀察
1.3.1 成瘤時間及瘤體體積 記錄四組接種后的成瘤時間,以瘤體直徑達到3 mm為成瘤標準。于接種第2、4、6周末用游標卡尺測量腫瘤長徑(a)、短徑(b),計算瘤體體積(V)。V=a×b2/2。
1.3.2 種植瘤形態學觀察 裸鼠自然死亡或種植8周末頭頸離斷后,完整剝離瘤體,觀察腫瘤形態。剖開瘤體,取部分腫瘤組織,甲醛固定,常規石蠟包埋,4 μm厚切片。二甲苯脫蠟,梯度乙醇脫水,蒸餾水沖洗2 min。蘇木素染色5 min,自來水沖洗。鹽酸乙醇分化30 s。自來水浸泡15 min或溫水(約50 ℃)浸泡5 min。伊紅染色2 min。常規脫水,透明,中性樹膠封片。光鏡下觀察病理形態變化。
1.3.3 瘤組織α-SMA、PCNA表達 取上述石蠟切片,貼附于APES處理過的載玻片上,置于烤箱內60 ℃烤片10 min。二甲苯脫蠟,梯度乙醇脫水,流水沖洗。將脫蠟水化后的組織切片置于緩沖液中煮沸處理,0.3% H2O2甲醇液阻斷內源性過氧化物酶活性,室溫孵育10 min,滴加50 μL非免疫性動物血清,室溫孵育20 min。然后滴加50 μL一抗,4 ℃冰箱過夜。PBS沖洗,滴加二抗。DAB顯色,蘇木素復染,乙醇脫水,二甲苯中性樹膠封片,顯微鏡下觀察。按照王立峰等[10]的標準:α-SMA陽性染色定位于間質成纖維細胞胞質,呈棕黃色顆粒。隨機選取5個高倍鏡(×400)視野,根據陽性染色范圍:無陽性染色為-,局灶陽性(陽性染色細胞團簇狀但面積不大)為+,彌漫陽性(廣泛陽性染色細胞)為++。PCNA陽性染色定位于間質成纖維細胞胞質及胞膜,呈棕黃色顆粒。隨機在染色均勻區域選取5個高倍鏡(×400)視野,陽性細胞所占比例<1/3為陰性表達、≥1/3為陽性表達。
1.3.4 微血管密度(MVD)觀察 采用鏈霉素抗生物素蛋白-過氧化物酶連接(SP)法。取裸鼠種植瘤組織,石蠟包埋后切片,行HE染色。石蠟切片→常規脫蠟至水→抗原修復→3% H2O2阻斷內源性過氧化物酶活性→山羊血清封閉→滴加一抗、二抗及鏈霉素、SP復合物→DAB顯色→復染封片。參照Maeda等[11]的方法,先在100倍視野下尋找CD34陽性染色的微血管高密度區,即熱點區。然后在400倍視野下,計數MVD。凡與周圍細胞或結締組織成分有明顯區別的單個內皮細胞或內皮細胞簇作為一個微血管;管腔直徑>8個紅細胞或肌層較厚的血管均不計數。記錄3個高倍鏡(×400)視野下的微血管數,取平均值作為每例的MVD。

2 結果
2.1 各組成瘤時間及瘤體體積比較 種植第2周,NFs+ECa109組、AFs+ECa109組、CAFs+ECa109組均種瘤成功,成瘤率為100%,以CAFs+ECa109組成瘤時間最短;種植第3周,ECa109組才見腫瘤形成,成瘤率為80%。各組癌細胞種植6周內,裸鼠生長狀態良好,體質量持續增加;種植8周初,裸鼠情緒焦躁,食欲不佳,體質量不再增加,甚至會下降;種植8周末,部分裸鼠自然死亡。具體結果見表1。
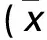
表1 各組成瘤時間及瘤體體積比較±s)
注:與ECa109組比較,*P<0.05。
2.2 各組腫瘤形態觀察 肉眼觀察,腫瘤形態接近于球形,外被包膜,局部可見結節,質韌,表面可見血管,腫瘤外緣為實性呈灰白色,腫瘤中間大片狀出血壞死,呈暗紫紅色,部分腫瘤可見膿腔。光鏡下觀察,ECa109組腫瘤細胞主要分布在腫瘤邊緣,腫瘤中央區為大片紅色絮狀壞死物,在腫瘤細胞團中可見紅色角化珠,在腫瘤團邊緣可見少許成纖維細胞;NFs+ECa109組、AFs+ECa109組、CAFs+ECa109組在成團的腫瘤細胞間可見大量纖維組織,纖維組織呈條束狀分布。
2.3 各組瘤組織α-SMA、PCNA陽性表達及腫瘤MVD比較 ECa109組α-SMA染色為局灶陽性。而NFs+ECa109組、AFs+ECa109組、CAFs+ECa109組α-SMA染色均為彌漫陽性。四組PCNA陽性表達率均為100%。ECa109組、NFs+ECa109組、AFs+ECa109組、CAFs+ECa109組MVD分別(5.3±0.31)、(15.4±0.22)、(17.1±0.42)、(20.2±0.28)條,AFs+ECa109組、CAFs+ECa109組明顯多于ECa109組、NFs+ECa109組(P均<0.05),AFs+ECa109組與CAFs+ECa109組、ECa109組與NFs+ECa109組比較差異均無統計學意義(P均>0.05)。
3 討論
食管癌的發生是一個多階段的病理過程,歷經炎癥和癌前病變,再到原位癌,直至進展期癌。在這一過程中將病變阻抑至癌前病變階段,甚至逆轉,可預防食管癌的發生。以往研究發現,在食管病變不同的發展階段,NFs、AFs和CAFs的形態及生物學特性具有明顯差異[12]。但其在腫瘤發生和發展過程中的作用尚未明確。
研究證實,腫瘤間質微環境在腫瘤進展過程中具有重要作用。CAFs是腫瘤間質微環境的重要成分。有研究發現,CAFs具有強大的內分泌功能,可分泌血管內皮生長因子(VEGF)、肝細胞生長因子(HGF)、基質細胞衍生因子1等多種細胞因子和生長因子,作用于內皮細胞表面的受體,促進內皮細胞募集、增殖、遷移,參與內皮細胞活化及腫瘤血管生成等過程[13]。本研究結果顯示,AFs+ECa109組和CAFs+ECa109組成瘤時間較ECa109組、NFs+ECa109組明顯縮短,而AFs+ECa109組與CAFs+ECa109組、ECa109組與NFs+ECa109組成瘤時間比較均無統計學差異,說明活化的間質成纖維細胞AFs和CAFs均可促進癌細胞的分裂和增殖。NFs+ECa109組、AFs+ECa109組、CAFs+ECa109組成瘤率高于ECa109組,且這3組瘤體體積增長速度均明顯快于ECa109組,尤其是在成瘤4周后。種植瘤形態學觀察發現,AFs+ECa109組和CAFs+ECa109組腫瘤間質內可見較多成纖維細胞和新生血管,較NFs+ECa109組和ECa109組明顯增多,說明惡變的間質成纖維細胞可促進腫瘤血管生成,在腫瘤快速生長過程中起到至關重要的作用。
在正常狀態下,成纖維細胞處于非激活-靜止狀態,其表型為α-SMA陰性表達。而在許多腫瘤中,處于活化狀態的CAFs表型為α-SMA陽性表達[14]。PCNA可反映細胞增殖活性,其陽性表達表明癌細胞為高活動期[15]。瘤體的增長離不開充足的血供,腫瘤MVD可反映腫瘤的血供情況。Micke等[16]將CAFs與腫瘤細胞混合后注射于小鼠體內,發現實驗組MVD較對照組MVD明顯增多,實驗組成瘤時間短于對照組成瘤時間。本研究結果顯示,NFs+ECa109組α-SMA染色原為陰性表達,而在腫瘤形成后,其表型轉變為α-SMA陽性表達。說明在腫瘤形成過程中,食管癌細胞可作用于正常的食管間質成纖維細胞,使NFs表型發生活化而轉變為α-SMA陽性表達的CAFs,這一改變可能與食管癌細胞分泌的細胞因子有關,如TGF-β。本研究四組PCNA陽性表達率均為100%,但NFs+ECa109組、AFs+ECa109組、CAFs+ECa109組PCNA染色強度是逐漸增強的,提示活化的間質成纖維細胞可能會刺激癌細胞的增殖分裂。本研究還發現,AFs+ECa109組與CAFs+ECa109組MVD較ECa109組、NFs+ECa109組明顯增多,這是實驗后期AFs+ECa109組、CAFs+ECa109組瘤體增長速度較ECa109組、NFs+ECa109組明顯加快的原因,提示間質成纖維細胞能為癌細胞提供適宜生長的微環境,成纖維細胞旁分泌的生長因子(如TGF-β1、HGF等)在刺激腫瘤細胞分裂增殖的同時,能直接或間接刺激腫瘤細胞表達VEGF[17],從而促進微血管生成,為腫瘤細胞的生長提供氧和營養。雖然有學者提出,NFs能夠抑制惡變上皮細胞的增殖,但本研究初期瘤體增長緩慢,一旦惡變的上皮細胞誘導NFs發生惡變而活化,二者之間形成正反饋促進增殖環節后,惡變的間質成纖維細胞能加速腫瘤的生長、浸潤和轉移。
綜上所述,食管癌細胞可能通過直接接觸NFs,誘導其表型發生轉變而活化;活化后的間質成纖維細胞可分泌大量的細胞因子、生長因子,促進腫瘤微環境的形成,有利于腫瘤細胞增殖,直接或間接誘導腫瘤血管生成,為腫瘤的生長提供充足的營養。
[1] 房麗君,李劍.來源于間充質干細胞的CAFs促進腫瘤生長[J].基礎醫學與臨床,2014,34(10):1442-1445.
[2] Berdiel-Acer M, Sanz-Pamplona R, Calon A, et al. Differences between CAFs and their paired NCF from adjacent colonic mucosa reveal functional heterogeneity of CAFs, providing prognostic information[J]. Mol Oncol, 2014,8(7):1290-1305.
[3] Pupo M, Vivacqua A, Perrotta I, et al. The nuclear localization signal is required for nuclear GPER translocation and function in breast cancer-associated fibroblasts (CAFs)[J]. Mol Cell Endocrinol, 2013,376(1-2):23-32.
[4] Luo H, Tu G, Liu Z, et al. Cancer-associated fibroblasts: a multifaceted driver of breast cancer progression[J]. Cancer Lett, 2015,361(2):155-163.
[5] Taddei ML, Giannoni E, Comito G, et al. Microenvironment and tumor cell plasticity: an easy way out[J]. Cancer Lett, 2013,341(1):80-96.
[6] 高海,呂常帥,王金申.CAFs在胃癌組織中的表達及與臨床病理特征的關系[J].中國現代普通外科進展,2012,15(10):796-799.
[7] 李崖青,李帥,劉芳芳,等.癌相關肌纖維母細胞與乳腺癌的研究進展[J].中華病理學雜志,2012,41(2):142-144.
[8] 蔡偉,康驊,劉晨,等.CAFs對乳腺癌細胞生物學特性的影響及機制探討[J].現代腫瘤醫學,2014,22(6):1249-1253.
[9] 曾偉偉,吳明利,徐志彬,等.食管鱗狀上皮癌變過程中間質纖維母細胞的平滑肌肌動蛋白α和CD34表達及意義[J].臨床薈萃,2011,26(22):1955-1960.
[10] 王立峰,王瑞芬,郝兆星,等.胃癌中腫瘤相關纖維母細胞蛋白表達改變及意義[J].世界華人消化雜志,2007,15(20):2263-2267.
[11] Maeda K, Chung YS, Ogawa Y, et al. Prognostic value of vascular endothelial growth factor expression in gastric carcinoma[J]. Cancer, 1996,77(5):858-863.
[12] 徐志彬,袁麗,鄭秀麗,等.食管癌前病變組織間質成纖維細胞的形態變化及生物學特征[J].山東醫藥,2016,56(40):32-35.
[13] 肖光,熊小亮,羅達亞,等.非小細胞肺癌中TGF-β1與腫瘤相關纖維母細胞α-SMA及CD34表達的相關性和意義[J].廣東醫學,2011,32(14):1866-1869.
[14] 趙晶潔,李建華,王洪,等.乳腺癌中α-SMA蛋白與MMP3蛋白的表達及其生物學行為[J].臨床與實驗病理學雜志,2015,31(5):584-586.
[15] Bradley WH, Lima PH, Rodgers L, et al. Endometrial carcinoma expresses an increased cathepsin B/D ratio[J]. Gynecol Oncol, 2008,108(1):84-89.
[16] Micke P, Ostman A. Tumor-stoma interaction:cancer-associated fibroblasts as novel targets in anti-cancer therapy[J]. Lung Cancer, 2004,45(Suppl 2):163-175.
[17] 徐麗南,姚志成,陳淑琴,等.腫瘤相關成纖維細胞培養液上清促進腫瘤細胞增殖和血管生成的研究[J].中華實驗外科雜志,2012,29(6):1167-1169.
河北省醫學科學研究重點課題計劃(20160656)。
王士杰(E-mail: xzblxh@sina.com)
10.3969/j.issn.1002-266X.2017.08.010
R735.1
A
1002-266X(2017)08-0035-04
2015-11-09)

