外源性硫化氫對肝星狀細胞TGF-β1表達的影響
程敏,鄭勇,陳衛剛,康馨丹,張迪,徐麗紅
(1石河子大學醫學院,新疆石河子832000;2石河子大學醫學院第一附屬醫院)
·基礎研究·
外源性硫化氫對肝星狀細胞TGF-β1表達的影響
程敏1,鄭勇2,陳衛剛2,康馨丹1,張迪1,徐麗紅2
(1石河子大學醫學院,新疆石河子832000;2石河子大學醫學院第一附屬醫院)
目的 探討外源性硫化氫(H2S)對大鼠肝星狀細胞(HSC)轉化生長因子β1(TGF-β1)表達的影響。方法 體外培養大鼠HSC-T6,隨機將細胞分為5組:空白對照組和硫氫化鈉(NaHS)50、75、100、200 μmol/L組,空白對照組僅給予L-DMEM,NaHS 50、75、100、200 μmol/L組分別給予含相應濃度NaHS的L-DMEM,培養48 h。采用Western blotting法和qRT-PCR法檢測各組TGF-β1蛋白及其mRNA表達。結果 各組均可見TGF-β1表達,證實各組HSC-T6均處于活化狀態,可模擬肝纖維化狀態下的HSC。培養48 h,NaHS 50 μmol/L組TGF-β1蛋白和mRNA表達最低,NaHS 75 μmol/L組TGF-β1蛋白和mRNA表達已明顯升高,但仍低于空白對照組(P均<0.01);NaHS 100、200 μmol/L組TGF-β1蛋白和mRNA表達明顯高于空白對照組(P均<0.01)。結論 在一定濃度范圍內外源性H2S可延緩肝纖維化的進展,其機制與抑制TGF-β1表達有關。
肝纖維化;硫化氫;肝星狀細胞;轉化生長因子β1
肝纖維化是以細胞外基質(ECM)在肝臟彌漫性過度沉積為病理特征,其形成主要是由于肝臟受到外界刺激因子損傷后,肝星狀細胞(HSC)活化,ECM過度生成,降解相對不足,導致ECM在肝內大量沉積所致[1]。肝纖維化如得不到有效逆轉,最終將演變為肝硬化。因此,肝纖維化是慢性肝損傷轉變為不可逆性肝硬化的必經之路。有研究發現,轉化生長因子β1(TGF-β1)在HSC活化到ECM過度沉積的過程中具有重要作用[2]。本課題組前期研究發現,硫化氫(H2S)作為繼NO、CO之后第3種內源性氣體信號分子,能夠延緩肝纖維化的進展[3,4]。在體內H2S以兩種形式存在,大部分以HS-形式存在并發揮生理作用,小部分以H2S氣體形式存在。硫氫化鈉(NaHS)在溶液中解離為Na+和HS-,HS-與H+結合生成H2S,從而使液體中NaHS和H2S保持動態平衡。與H2S相比,NaHS更能保證溶液中H2S濃度的穩定性和精確性,常被用于外源性H2S的供體。2016年1~6月,本研究觀察了NaHS對HSC TGF-β1表達的影響,旨在進一步明確外源性H2S的作用及其機制。現分析結果并報告如下。
1 材料與方法
1.1 材料 大鼠HSC-T6,購自自廣州吉妮歐生物科技有限公司;FBS、L-DMEM,購自美國Hyclone公司;NaHS,購自美國Sigma公司;TGF-β1抗體,購自美國Abcam公司;小鼠抗β-actin單克隆抗體,山羊抗小鼠、山羊抗兔IgG均購于北京中杉金橋生物技術有限公司;TRIzol,購自美國Invitrogen公司;逆轉錄試劑盒,購自美國Thermo公司;SYBR Gene PCR試劑盒,購自德國QIAGEN公司;異丙醇、三氯甲烷,購自上海化學試劑研究所有限公司;TGF-β1、β-actin引物自行設計,并由上海生工生物工程股份有限公司合成;Bio-Rad電泳儀、轉膜儀、凝膠成像儀,均購自美國Bio-Rad公司;核酸蛋白測定儀、SYBR Green Ⅰ實時定量PCR儀,購自美國Thermo公司;PCR擴增儀,購自日本TaKaRa公司。
1.2 細胞培養及分組處理 取HSC-T6約2×106個,接種于細胞培養皿中,用含10%FBS的L-DMEM完全培養基培養至細胞80%~90%融合時,0.25%胰蛋白酶消化成單個細胞,1 000 r/min離心5 min,棄去上清液,用1 mL完全培養基重懸細胞。將細胞懸液接種至新的培養皿中,細胞貼壁6~8 h,PBS清洗2次,去除漂浮死細胞及殘存血清,換用無任何血清添加的L-DMEM,同步化處理12 h。隨機將細胞分為空白對照組和NaHS 50、75、100、200 μmol/L組,空白對照組僅給予L-DMEM,NaHS 50、75、100、200 μmol/L組分別給予含相應濃度NaHS的L-DMEM,培養48 h。
1.3 TGF-β1蛋白表達檢測 采用Western blotting法。取各組細胞,用冰冷PBS洗滌2~3次,冰上裂解,機械勻漿,4 ℃ 12 000 r/min離心15 min,取上清液,BCA法蛋白定量。取總蛋白10 μL,行10% SDS-聚丙烯酰氨凝膠電泳(80 V 30 min,110 V 100 min),半干法轉印至PVDF膜(23 V 50 min),5%脫脂奶粉封閉2 h,4 ℃ 20 r/min搖床一抗(TGF-β1、β-actin均為1∶1 000)孵育過夜。次日,1×TBST洗脫一抗5~6次,5 min/次,常溫下二抗(1∶20 000)孵育2 h,1×TBST洗脫5~6次,5 min/次,將發光試劑混勻后滴加到PVDF膜上,暗室曝光。Bio-Rad凝膠成像儀采集圖像后,采用Gel-Proanalyzer軟件分析各泳道條帶灰度值。以目的蛋白與β-actin條帶灰度值之比表示目的蛋白的相對表達量。實驗重復3次,取平均值。
1.4 TGF-β1mRNA表達檢測 采用qRT-PCR法。利用TRIzol法提取各組總RNA,經核酸蛋白測定儀檢測,OD260/OD280在1.8~2.0,瓊脂糖凝膠電泳鑒定總RNA完整,可滿足實驗要求。采用RevertAidTMH Minus First Strand cDNA Synthesis Kit試劑盒將總RNA逆轉錄為cDNA。PCR擴增:TGF-β1上游引物:5′-ATTCCTGGCGTTACCTTGG-3′,下游引物:5′-AGCCCTGTATTCCGTCTCCT-3′,產物片段120 bp;β-actin上游引物:5′-CGTAAAGACCTCTATGCCAACA-3′,下游引物5′-AGCCACCAATCCACACAGAG-3′,產物片段163 bp;PCR反應體系20 μL,其中cDNA 3 μL、上下游引物各1 μL、2×Synthesis qPCR Master Mix混合物10 μL、DEPC水5 μL;擴增條件:95 ℃預變性3 min,95 ℃變性10 s,55 ℃退火延伸30 s,共39個循環。每個樣本設3個復孔。以β-actin為內參,2-ΔΔCt法計算TGF-β1mRNA的相對表達量。

2 結果
各組均可見TGF-β1表達,證實各組HSC-T6均處于活化狀態,可模擬肝纖維化狀態下的HSC。培養48 h,NaHS 50 μmol/L組TGF-β1蛋白和mRNA表達最低,NaHS 75 μmol/L組TGF-β1蛋白和mRNA表達已明顯升高,但仍低于空白對照組(P均<0.01);NaHS 100、200 μmol/L組TGF-β1蛋白和mRNA表達明顯高于空白對照組(P均<0.01)。結果見表1。
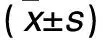
表1 各組TGF-β1蛋白和mRNA的相對表達量比較
注:與空白對照組比較,*P<0.01;與NaHS 50 μmol/L組比較,#P<0.01;與NaHS 75 μmol/L組比較,△P<0.01;與NaHS 100 μmol/L組比較,▲P<0.01。
3 討論
肝纖維化是由多種損傷因素,包括病毒、藥物、膽汁淤積、自身免疫等引起的病理過程,在TGF-β1、血小板衍生生長因子、結締組織生長因子及炎性因子等相互作用下, HSC直接或間接被激活并分泌大量ECM[5],致使肝臟結構被破壞及肝實質被損傷。其中,TGF-β1是肝纖維化形成過程中最核心的細胞因子。TGF-β1一方面可不斷促進ECM的合成與分泌[6],另一方面抑制ECM的降解,破壞基質的平衡狀態[7]。作為致肝纖維化最強的細胞因子,TGF-β1在體內分布以肝臟居首,且肝內TGF-β1活性明顯高于其他組織。因此,抑制肝臟TGF-β1表達,減少HSC TGF-β1生成,對延緩肝纖維化進程尤為重要。
在有關肝纖維化模型的研究中,經常用到原代或傳代HSC。原代培養的HSC通常用于研究相對靜止的HSC狀態,而傳代培養的HSC常被用來模擬肝纖維化狀態下的急性模型。在正常肝臟中,HSC比例僅占非實質細胞的5%~10%,且提取原代HSC的效率較低;同時,原代細胞的純化技術及培養條件對HSC狀態的影響較大,容易對實驗結果造成影響。因此,目前有關肝纖維化的研究多選用傳代的HSC。HSC-T6是一種永生系細胞,經過SV40病毒轉染后形成,可模擬肝纖維化狀態下的HSC,具有無限傳代的特性。故本研究選用HSC-T6進行后續實驗。
H2S是繼NO、CO之后發現的第3種具有類似生理效應的氣體分子。有研究發現,H2S具有調節細胞增殖、控制細胞周期、抗氧化應激、擴張血管等多種生物學效應[8,9]。在體內生理環境下,H2S在胱硫醚-B-合成酶、胱硫醚-C-裂解酶體系的作用下生成并發揮生理作用[10]。有研究發現,體內H2S含量隨著肝硬化程度的加重逐漸降低[11]。丁彥光等[12]研究發現,給予肝纖維化大鼠充足的外源性H2S,可清除自由基、提高抗氧化物酶活性、抑制HSC膠原合成、減少肝組織ECM沉積,抑制大鼠肝纖維化進展。Song等[13]研究發現,NaHS用于TGF-β1誘導的腎纖維化大鼠,可使腎組織α-平滑肌肌動蛋白、纖維黏連蛋白、Ⅰ型膠原表達明顯降低。自發性高血壓大鼠經NaHS處理后,心肌組織TGF-β1表達及心肌膠原明顯降低[14]。大鼠血漿中H2S濃度一般為(41±5) μmol/L[15],本課題組前期研究發現,NaHS 200 μmol/L以下時對HSC及肝細胞凋亡無明顯誘導作用[16,17]。故本研究選取50~200 μmol/L的NaHS作用于HSC,觀察其對TGF-β1表達的影響,為NaHS在延緩肝纖維化方面的研究提供一定的理論依據。
在正常未活化的HSC中,TGF-β1表達極少,很難被檢測到,而HSC活化后可大量分泌[18]。本研究各組均可見TGF-β1表達,表明本研究所用的HSC已經活化,可模擬肝纖維化狀態下的HSC。本研究選擇50、75、100、200 μmol/L NaHS作用于HSC-T6 48 h,結果發現,NaHS 50 μmol/L時TGF-β1蛋白和mRNA表達最低, NaHS 75 μmol/L時TGF-β1蛋白和mRNA表達已明顯升高,但仍低于空白對照組;當NaHS 100、200 μmol/L時TGF-β1蛋白和mRNA表達明顯高于空白對照組。表明在一定濃度范圍內外源性H2S可抑制TGF-β1表達。Song等[13]將外源性H2S腹腔注射至單側輸尿管梗阻大鼠中,發現H2S的保護作用表現為“鐘型”量效關系,即NaHS的保護效應起于5.6 g/(kg·d),達峰于56 g/(kg·d),并于560 g/(kg·d)時發生逆轉。本研究與Song等[13]報道類似。其原因可能與H2S的“鐘型”量效關系有關,但其具體機制尚需進一步探討。有研究證實,NF-κB具有多向調節作用,可調控多種細胞因子的轉錄,包括促進TGF-β1基因的表達[19]。外源性H2S調節大鼠肝纖維化的過程中,可降低肝組織勻漿上清液中細胞因子TNF-α表達[20],而TNF-α表達與NF-κB p65的表達呈正相關關系[21]。因此,NaHS可能通過抑制TNF-α、NF-κB的表達,影響TNF-α/NF-κB信號通路,進而抑制TGF-β1的表達。
綜上所述,在一定濃度范圍內外源性H2S可延緩肝纖維化的進展,其機制可能與抑制TGF-β1表達有關。
[1] Friedman SL. Liver fibrosis——from bench to bedside[J]. J Hepatol, 2003,38(Suppl 1):38-53.
[2] Friedman SL. Cytokines and fibrogenesis[J]. Semin Liver Dis, 1999,19(2):129-140.
[3] 趙強,陳衛剛,趙瑾,等.硫化氫對肝纖維化大鼠肝臟Ⅰ、Ⅲ型膠原表達的影響[J].世界華人消化雜志,2013,21(4):300-306.
[4] 劉維國,鄭勇,李文娟,等.硫化氫對大鼠實驗性肝硬化門靜脈壓力的影響[J].山東醫藥,2010,50(24):39-40.
[5] Fan XQ, Chen XH, Qi XY. Research progress on targeted connective tissue growth factor of siRNA for hepatic stellate cell mediated liver fibrosis[J]. China Medical Herald, 2012,9(35):58-60.
[6] Zheng S, Xing X, Han Y, et al. The effect of TGF-β1on cell proliferation, cell cycle regulation and collagen expression in HSC-T6 cells[J]. J Clin Hepatol, 2012,15(4):327-331.
[7] Lapperre TS, Willems LN, Timens W, et al. Small airways dysfunction and neutrophilic inflammation in bronchial biopsies and BAL in COPD[J]. Chest, 2007,131(1):53-59.
[8] Kimura Y, Kimura H. Hydrogen sulfide protects neurons from oxidative stress[J]. FASEB J, 2004,18(10):1165-1167.
[9] 陽丹才讓,鄧勇,任利,等.硫化氫在大鼠肝星狀細胞氧應激中對ɑ-SMA與細胞周期影響的實驗研究[J].現代生物醫學進展,2010,10(12):2205-2208.
[10] Truong DH, Mihajlovic A, Gunness P, et al. Prevention of hydrogen sulfide (H2S)-induced mouse lethality and cytotoxicity by hydroxocobalamin (vitamin B 12a)[J]. Toxicology, 2007,242(1-3):16-22.
[11] 張寧,鄭勇,王于理,等.內源性硫化氫在不同時期大鼠肝硬化中的作用[J].世界華人消化雜志,2009,17(3):307-311.
[12] 丁彥光,鄭如恒,肖祥之,等.硫化氫對大鼠肝纖維化的抑制作用及機制探討[J].山東醫藥,2014,54(11):31-34.
[13] Song K, Wang F, Li Q, et al. Hydrogen sulfide inhibits the renal fibrosis of obstructive nephropathy[J]. Kidney Int, 2013,85(6):1318-1329.
[14] Sun L, Jin H, Sun L, et al. Hydrogen sulfide alleviates myocardial collagen remodeling in association with inhibition of TGF-β/Smad signaling pathway in spontaneously hypertensive rats[J]. Mol Med, 2013,20(1):503-515.
[15] 耿彬,杜軍保,唐朝樞.敏感硫電極法在測定心血管組織細胞及血漿胱硫醚-γ-裂解酶/硫化氫的應用[J].北京大學學報:醫學版,2005,37(5):545-548.
[16] 任嬙,李睿,趙強,等.LY294002在外源性H2S預處理肝纖維化大鼠肝星狀細胞增殖、凋亡中的作用[J].胃腸病學和肝病學雜志,2013,22(8):804-807.
[17] 鄭娜娜,岳雅倫,鄭勇,等.硫化氫通過p38MAPK信號通路對肝纖維化大鼠肝細胞增殖、凋亡的影響[J].世界華人消化雜志,2015,23(6):901-906.
[18] 沈欽海,秦召敏,逯愛梅.硫化氫對大鼠肝纖維化的預防作用[J].中南大學學報:醫學版,2012,37(9):911-915.
[19] Chen X, Liu C, Lu Y, et al. Paeoniflorin regulates macrophage activation in dimethylnitrosamine-induced liver fibrosis in rats[J]. BMC Complement Altern Med, 2012(12):254.
[20] 薛建紅,吳雅紅,付紅莉.硫化氫通過氧化應激及細胞因子調控小鼠肝纖維化的進程[J].廣東醫學院學報,2016,34(1):33-36.
[21] 賈玉杰,趙芳,張彩華,等.肝復康對乙醛刺激肝星狀細胞NF-κB通路活化的抑制作用[J].中國微生態學雜志,2015,27(7):774-777.
國家自然科學基金資助項目(81170402、81360076)。
鄭勇(E-mail: zy2850@126.com)
10.3969/j.issn.1002-266X.2017.08.008
R575.2
A
1002-266X(2017)08-0029-03
2016-07-13)

