小G蛋白Rab5對表達在HEK293細胞上的大電導鈣激活鉀通道的影響
周丹,劉雪茹,李濤,劉力,譚曉秋,劉玉林
(1西南醫科大學附屬醫院,四川瀘州646000;2西南醫科大學心血管醫學研究所)
小G蛋白Rab5對表達在HEK293細胞上的大電導鈣激活鉀通道的影響
周丹1,劉雪茹1,李濤2,劉力1,譚曉秋2,劉玉林1
(1西南醫科大學附屬醫院,四川瀘州646000;2西南醫科大學心血管醫學研究所)
目的 探討小G蛋白Rab5對HEK293細胞大電導鈣激活鉀通道(BKCa)的影響。方法 將對數生長期HEK293細胞,隨機分為Control組、Rab5WT組、Rab5CA組和Rab5DN組。采用脂質體轉染法進行轉染,Control組轉染Flag-hSlo1-GFP質粒和對照質粒pcDNA3.1,Rab5WT組轉染Flag-hSlo1-GFP質粒和Rab5WT質粒,Rab5CA組轉染Flag-hSlo1-GFP質粒和Rab5CA質粒,Rab5DN組轉染Flag-hSlo1-GFP質粒和Rab5DN質粒,每組兩種質粒總量為4 μg,按質量比1∶1共轉染至3.5 mm培養皿中。轉染72 h、熒光顯微鏡下觀察轉染效率在70%以上時,采用膜片鉗、Western blotting法和流式細胞術觀察Rab5對HEK293細胞BKCa的作用。結果 與Control組比較,Rab5WT組、Rab5CA組BKCa全細胞電流密度明顯增加,而Rab5DN組明顯降低;Rab5WT組、Rab5CA組BKCa膜蛋白的相對表達量明顯升高,而Rab5DN組明顯降低(P均<0.05);Rab5WT組、Rab5CA組Flag+/GFP+明顯增加,而Rab5DN組明顯降低(P均<0.05)。結論 Rab5能夠明顯增加表達在HEK293細胞上的BKCa電流及細胞膜上的表達,并可促進BKCa向質膜的轉運過程。
小G蛋白家族;大電導鈣激活鉀通道;蛋白轉運;基因轉染
大電導鈣激活鉀通道(BKCa)是血管平滑肌細胞膜上重要的離子通道, 可攜帶70%~80%的外向
電流,在調節血管張力和血壓中發揮重要作用[1]。我們前期研究發現, BKCa是眾多舒血管藥物的作用靶點,其功能活動異常與高血壓等密切相關[2,3]。BKCa蛋白在內質網合成、高爾基體加工后,需經過一系列復雜機制組裝并轉運到質膜上,才能發揮生理功能;因此,細胞膜上BKCa蛋白的表達水平及調控對其功能的發揮至關重要。小G蛋白家族成員Rab在質膜內側及多種胞內囊泡結構中存在,具有調節囊泡轉運和離子通道活動等功能。既往研究發現,Rab蛋白可參與多種離子通道轉運的調控過程[4]。2012年9月~2015年12月,本研究觀察了Rab5對表達在HEK293細胞上BKCa轉運過程的影響,并探討其可能的作用機制。
1 材料與方法
1.1 材料 HEK293細胞,購自美國ATCC公司。含人血管平滑肌BKCaα亞單位的表達質粒pcDNA3.1-hSlo1,由本實驗室保存。Flag和GFP雙標記hSlo1表達質粒(簡稱Flag-hSlo1-GFP質粒),含有人Rab5小G蛋白野生型(WT)、顯性負向型(DN)、持續激活型(CA)的表達質粒(pcDNA3.1),由本實驗室通過逆轉錄PCR和定點突變完成,并經測序驗證。EPC-10膜片鉗系統,德國HEKA公司;凝膠成像系統,美國Bio-Rad公司;流式細胞儀,美國BD公司;CO2培養箱,美國Thermo公司。質粒提取試劑盒,美國Omega公司;Lipotamine2000脂質體轉染試劑,美國Life Science公司;Western blotting凝膠配制試劑,江蘇碧云天生物技術研究所;膜蛋白提取試劑盒,美國Pierce公司;APC標記的Flag一抗,日本MBL公司;其余常用試劑購自上海生工生物工程股份有限公司。
1.2 細胞培養和轉染 HEK293細胞置于含10% FBS的DMEM高糖培養基中,37 ℃、5% CO2培養箱中傳代培養。當細胞培養至對數生長期,細胞融合至80%時,隨機分為Control組、Rab5WT組、Rab5CA組和Rab5DN組,采用脂質體轉染法進行轉染。Control組轉染Flag-hSlo1-GFP質粒和對照質粒pcDNA3.1,Rab5WT組轉染Flag-hSlo1-GFP質粒和Rab5WT質粒,Rab5CA組轉染Flag-hSlo1-GFP質粒和Rab5CA質粒,Rab5DN組轉染Flag-hSlo1-GFP質粒和Rab5DN質粒,每組兩種質粒總量為4 μg,按質量比1∶1共轉染至3.5 mm培養皿中。轉染72 h,熒光顯微鏡下觀察轉染效率在70%以上時進行下一步實驗。
1.3 BKCa電流記錄 使用全細胞膜片鉗記錄BKCa電流,電極阻抗3~5 mΩ。記錄BKCa電流的浴液:NaCl 137.0 mmol/L、KCl 5.9 mmol/L、MgCl21.2 mmol/L、CaCl21.8 mmol/L、HEPES 10.0 mmol/L,使用NaOH將浴液pH調至7.4;電極液:KCl 128.0 mmol/L,NaCl 12.0 mmol/L,MgCl24.0 mmol/L,HEPES 10.0 mmol/L,EGTA 1.0 mmol/L,使用KOH將電極液pH調至7.2,根據文獻[5]加入適量的CaCl2,使細胞內游離Ca濃度為0.1 μmol/L。鉗制電位為-80 mV,刺激方案采用階躍刺激方案:-80~60 mV,時程400 ms。
1.4 BKCa膜蛋白表達檢測 采用生物素化方法提取細胞膜蛋白,分離、純化,Western blotting法檢測。所有操作步驟嚴格按照Pierce? Cell Surface Protein Isolation Kit試劑盒說明書進行[5]。主要步驟:①生物素化:收集待處理細胞,加入冰預冷的PBS溶液輕輕洗滌2次;加入冰預冷的生物素化溶液,4 ℃輕輕搖晃混勻,孵育30 min;生物素化標記結束,加入終止液終止反應。將細胞收集到離心管中,用冰預冷的TBS溶液洗滌細胞,3 000 r/min離心5 min,沉淀細胞;②細胞裂解:使用含有蛋白酶抑制劑的細胞裂解液,冰上30 min裂解細胞,4 ℃ 10 000 g離心2 min,收集上清;③分離生物素化標記的膜蛋白:將NeutrAvidin瓊脂糖珠子置于收集的上清中,加入蛋白裂解液,室溫振蕩,孵育60 min,1 000 g離心1 min,棄掉上清,wash buffer洗滌;④蛋白洗脫:將蛋白樣品加入50 mmol/L DTT的SDS-PAGE 1×上樣緩沖液,室溫搖晃混勻,孵育60 min,1 000 g離心2 min,收集上清蛋白樣品(即膜蛋白),采用Western blotting法檢測[5]。具體步驟:SDS-PAGE電泳,轉膜,5%脫脂奶粉封閉,4 ℃一抗(rabbit anti-hslo1 antibody,1∶1 000)孵育過夜,二抗(HRP tagged anti-rabbit antibody,1∶2 500)室溫孵育1 h,ECL顯影,采用Bio-Lab成像系統進行圖像采集,所得圖像采用Quantity One軟件進行灰度值分析。
1.5 BKCa蛋白轉運檢測 采用流式細胞術。收集Control組、Rab5WT組、Rab5CA組和Rab5DN組轉染后細胞,加入APC標記Flag一抗的熒光抗體(1∶400),4 ℃孵育2 h。然后加入100 μL冰預冷的PBS重懸細胞,200目銅網過濾。另設置陰性對照(未轉染的HEK293細胞)。使用流式細胞儀檢測,通過計算得到Flag陽性細胞數與GFP陽性細胞數的比值,以此反映BKCa蛋白由細胞膜向質膜的轉運。

2 結果
2.1 Rab5對BKCa電流的影響 與Control組比較,Rab5WT組、Rab5CA組BKCa電流明顯增加,而Rab5DN組明顯降低。結果見圖1、表1。
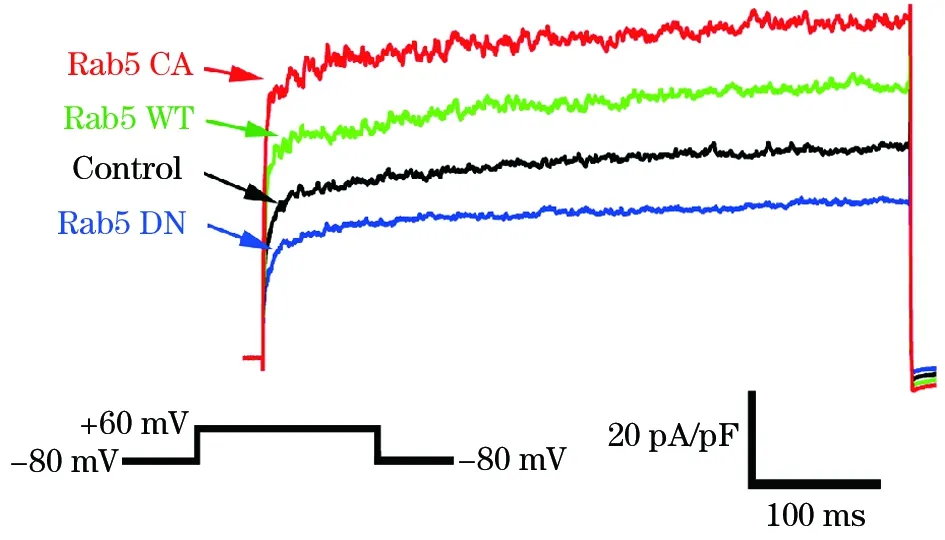
注:全細胞構型下,膜電位(Vm)去極化到+60 mV時Rab5對BKCa全細胞電流的原始記錄。

圖1 Rab5對表達在HEK293細胞上的BKCa全細胞電流的影響
注:與Control組比較,*P<0.05,#P<0.01。
2.2 Rab5對BKCa膜蛋白表達的影響 以Control組BKCa膜蛋白的相對表達量為1,Rab5WT組、Rab5CA組、Rab5DN組BKCa膜蛋白的相對表達量分別為1.24±0.08、1.42±0.13、0.73±0.11。與Control組比較,Rab5WT組、Rab5CA組BKCa膜蛋白的相對表達量明顯升高,而Rab5DN組BKCa膜蛋白的相對表達量明顯降低(P均<0.05)。
2.3 Rab5對BKCa蛋白轉運的影響 見插頁Ⅰ圖1。未轉染BKCa的HEK293細胞主要集中在第三象限,而Flag和GFP雙陰性、轉染BKCa(Flag-hSlo-GFP雙標記)的HEK293細胞則分布在第一、三、四象限。其中第一象限為Flag和GFP雙陽性細胞,即能夠檢測到BKCa蛋白在細胞膜上表達的細胞;第四象限為GFP陽性、Flag陰性細胞,即雖然轉染BKCa通道,但由于大多數通道表達主要集中在細胞內,未被Flag抗體檢測到。因此,分析Flag陽性與GFP陽性細胞的比值(即第一象限與第一、四象限之和的比值),可反映BKCa蛋白的轉運情況。Control組、Rab5WT組、Rab5CA組、Rab5DN組Flag+/GFP+分別為42.37±4.86、53.74±5.48、62.83±4.93、31.47±4.71。與Control組比較,Rab5WT組、Rab5CA組Flag+/GFP+均明顯增加,而Rab5DN組明顯降低(P<均0.05)。
3 討論
BKCa在多種組織細胞中均有表達,在血管平滑肌細胞上分布極為豐富。在血管平滑肌細胞上,BKCa激活可引起細胞膜超極化,通過抑制L型鈣通道而舒張血管[6,7]。BKCa同時還可偶聯胞內鈣和膜電位,在調控血管平滑肌功能中發揮重要作用。膜離子通道的功能很大程度上依賴于其在細胞膜上的表達豐度。有研究證實,多種心血管系統疾病與細胞膜離子通道的表達豐度改變密切相關;而離子通道在細胞膜上的表達一方面取決于通道蛋白通過靶向運輸機制轉運到細胞膜的數量,另一方面又受到膜上蛋白內吞循環途徑的調控。我們前期研究發現,高血壓患者細胞膜BKCa轉運功能存在異常[2,8]。但目前對血管平滑肌細胞上BKCa功能的調控,尤其是通道蛋白轉運機制尚不完全清楚。故闡明BKCa在血管平滑肌功能調控中的作用具有重要意義,且對其轉運的調控還有可能成為臨床心血管疾病治療的靶點[9~11]。
小G蛋白因其分子量只有20~40 kD而得名,目前已經發現的Rab蛋白超過60種。Rab在細胞內多種細胞器中表達,包括內質網、高爾基體和細胞膜,從而參與蛋白質轉運。Rab調節大部分胞內轉運事件,在囊泡的定向運輸中發揮重要作用。不同的Rab蛋白可能在不同的離子通道蛋白轉運過程中作用不同;而同一Rab蛋白對不同離子通道的調控作用亦可能不同[4,12]。如離子通道CFTR從內質網向高爾基體的轉運是一種不依賴Rab1/2,而是依賴COPⅡ的囊泡轉運方式[13];而Kv4.2/KChIP1從內質網向高爾基體的轉運則是依賴Rab1和COPⅠ,而不依賴COPⅡ的轉運途徑[14]。Rab5作為在囊泡上表達十分豐富的小G蛋白,調控一些離子通道蛋白轉運,包括通道蛋白經囊泡由細胞質轉運到細胞膜的過程以及轉運到細胞膜上的通道蛋白內吞進入細胞質的過程。既往研究發現,Rab5參與CFTR、GluT4、KCNQ1/KCNE1通道的內吞作用;而對于Kv1.5通道的內吞作用結果并不一致。McEwen等[15]研究發現,Kv1.5通道內吞與Rab5有關,通過采用表達Rab5顯性負性(DN)的質粒,可明顯抑制通道內吞而增加在細胞膜上的表達。但也有研究認為,Kv1.5的內化過程并不需要Rab5參與,而是以一種不依賴Rab5的含小窩蛋白的脂筏轉運方式[16]。Sokolowski等[17]研究發現,小G蛋白Rab11b可與耳蝸細胞的BKCa共定位,使用Rab11b的siRNA可明顯減少BKCa在細胞膜上的表達,進一步發現,Rab11b通過晚期包涵體發揮促進BKCa在細胞膜上表達的作用。但目前關于Rab5對BKCa蛋白轉運調控的研究鮮見報道。
本研究在BKCa的胞外S1~S2環插入了Flag標簽,利用Flag的熒光一抗檢測BKCa蛋白在細胞膜上的表達水平,而在BKCa的胞內C端連接有GFP,其熒光強度能反映BKCa蛋白在細胞上整體的表達水平。李濤等[18]研究表明,Flag和GFP標簽并不影響BKCa電流和在細胞膜上的表達。本研究結果顯示,與Control組比較,Rab5WT組、Rab5CA組BKCa電流明顯增加,而Rab5DN組明顯降低;與Control組比較,Rab5WT組、Rab5CA組BKCa膜蛋白的相對表達量明顯升高,而Rab5DN組明顯降低;與Control組比較,Rab5WT組、Rab5CA組Flag+/GFP+明顯增加,而Rab5DN組明顯降低。這些結果均提示Rab5WT或Rab5CA促進了BKCa蛋白在細胞膜上的表達。
綜上所述,Rab5可促進BKCa蛋白由細胞質向質膜的轉運過程,從而增加BKCa蛋白在細胞膜上的表達豐度。Rab蛋白是一個大家族,但本研究僅關注了Rab5對BKCa蛋白的調控過程,其他Rab蛋白對于BKCa蛋白的轉運調控及其對BKCa的功能調控尚需進一步研究。
[1] Eichhorn B, Dobrev D. Vascular large conductance calcium-activated potassium channels:functional role and therapeutic potential[J]. Naunyn Schmiedebergs Arch Pharmacol, 2007,376(3):145-55.
[2] Yang Y, Li PY, Cheng J, et al. Function of BKCa channels is reduced in human vascular smooth muscle cells from han Chinese patients with hypertension[J]. Hypertension, 2013,61(2):519-525.
[3] Tan X, Yang Y, Cheng J, et al. Unique action of sodium tanshinone Ⅱ-A sulfonate (DS-201) on the Ca(2+) dependent BK(Ca) activation in mouse cerebral arterial smooth muscle cells[J]. Eur J Pharmacol, 2011,656(1-3):27-32.
[4] Hutagalung AH, Novick PJ. Role of Rab GTPases in membrane traffic and cell physiology[J]. Physiol Rev, 2011,91(1):119-149.
[5] Tan X, Cheng X, Yang Y, et al. Tanshinone Ⅱ-A sodium sulfonate (DS-201) enhances human BKCa channel activity by selectively targeting the pore-forming α subunit[J]. Acta Pharmacol Sin, 2014,35(11):1351-1363.
[6] Contreras GF, Castillo K, Enrique N, et al. A BK (Slo1) channel journey from molecule to physiology[J]. Channels (Austin), 2013,7(6):442-458.
[7] Toro L, Li M, Zhang Z, et al. Maxik channel and cell signaling[J]. Pflugers Arch, 2014,466(5):875-886.
[8] Cheng J, Mao L, Wen J, et al. Different effects of hypertension and age on the function of large conductance calcium- and voltage-activated potassium channels in human mesentery artery smooth muscle cells[J]. J Am Heart Assoc, 2016,5(9):e003913.
[9] Joseph BK, Thakali KM, Moore CL, et al. Ion channel remodeling in vascular smooth muscle during hypertension: implications for novel therapeutic approaches[J]. Pharmacol Res, 2013,70(1):126-138.
[10] Smyth JW, Shaw RM. Forward trafficking of ion channels: what the clinician needs to know[J]. Heart Rhythm, 2010,7(8):1135-1140.
[11] Schumacher SM, Martens JR. Ion channel trafficking: a new therapeutic horizon for atrial fibrillation[J]. Heart Rhythm, 2010,7(9):1309-1315.
[12] Pochynyuk O, Stockand JD, Staruschenko A. Ion channel regulation by Ras, Rho, and Rab small GTPases[J]. Exp Biol Med (Maywood), 2007,232(10):1258-1265.
[13] Okiyoneda T, Harada K, Yamahira K, et al. Characterization of the trafficking pathway of cystic fibrosis transmembrane conductance regulator in baby hamster kidney cells[J]. J Pharmacol Sci, 2004,95(4):471-475.
[14] Flowerdew SE, Burgoyne RD. A VAMP7/Vti1a SNARE complex distinguishes a non-conventional traffic route to the cell surface used by KChIP1 and Kv4 potassium channels[J]. Biochem J, 2009,418(3):529-540.
[15] McEwen DP, Schumacher SM, Li Q, et al. Rab-GTPase-dependent endocytic recycling of Kv1.5 in atrial myocytes[J]. J Biol Chem, 2007,282(40):29612-29620.
[16] Zadeh AD, Xu H, Loewen ME, et al. Internalized Kv1.5 traffics via Rab-dependent pathways[J]. J Physiol, 2008,586(20):4793-4813.
[17] Sokolowski S, Harvey M, Sakai Y, et al. The large conductance calcium-activated K(+) channel interacts with the small GTPase Rab11b[J]. Biochem Biophys Res Commun, 2012,426(2):221-225.
[18] 李濤,程秀麗,黃文俊,等. Flag和GFP雙標記的BKca通道α亞基表達質粒的構建、鑒定和序列分析[J].中國應用生理學雜志,2016,32(3):279-282.
Effect of Rab5 on large-conductance Ca2+-actived K+channels (BKca) expressed in HEK293 Cells
ZHOUDan1,LIUXueru,LITao,LIULi,TANXiaoqiu,LIUYulin
(1TheAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,China)
Objective To investigate the effect of Rab5 on large-conductance Ca2+-activated K+channels (BKCachannels) expressed in HEK293 cells. Methods HEK293 cells in the logarithmic phase were randomly divided to four groups: the control group, Rab5WT group, Rab5CA group and Rab5DN group. HEK293 cells were transfected with Flag-hSlo-GFP plasmid in each group and with pcDNA3.1 for control group, Rab5WT for Rab5WT group, Rab5CA for Rab5CA group and Rab5DN for Rab5DN group, respectively. Total 4 μg plasmid with 1∶1 to each plasmid was transfected into 3.5 mm dish. Transfection rate was observed under fluorescence microscopy and the effect of Rab5 on BKCachannels was detected by patch clamp technique, Western blotting and flow cytometry when the trasfection rate was above 70%. Results Compared with the control group, Rab5 WT and Rab5 CA significantly increased BKCamacroscopic currents, while BKCacurrents were decreased in the Rab5DN group. Rab5 WT and Rab5 CA increased the expression of membranous BKCaprotein in HEK293 cells, while Rab5DN decreased the expression (allP<0.05). Rab5 WT and Rab5 CA increased the Flag+/GFP+ratio (allP<0.05), while Rab5DN decreased the ratio (P<0.05). Conclusion Rab5 significantly increases BKCacurrents and channel expression on cell surface and may promote the transport process of BKCacurrents to cell membrane in HEK293 cells.
small G protein family; large-conductance Ca2+-activated K+channels; protein transport; gene transfection
國家自然科學基金資助項目(31300948)。
周丹(1981-),男,碩士研究生,研究方向為麻醉學。E-mail: dyzhoudan@163.com
劉玉林(1968-),男,副教授,研究方向為麻醉學。E-mail: anesthesia2000@163.com
10.3969/j.issn.1002-266X.2017.08.006
R331.3+6
A
1002-266X(2017)08-0021-04
2016-09-06)

