清熱解毒扶正顆粒對ETM大鼠血清IL—1β、IL—12及TNF—α含量的影響
萬啟南+韋袞政+李黔云
摘要:目的 探討清熱解毒扶正顆粒對ETM大鼠血清IL-1β、IL-12及TNF-α含量的影響。方法 90只大鼠隨機分為正常組、模型對照組、西藥組以及中藥低、中、高劑量組,采用腹腔注射脂多糖法(LPS)復制大鼠內毒素血癥模型。正常組、模型對照組予生理鹽水1ml/100g灌胃,每天1次;西藥組給甲基強的松龍1.17mg/100g灌胃,每天1次;中藥組給清熱解毒扶正顆粒1ml/100g灌胃,每天1次;實驗結束后,用ELISA法測定各組血清IL-1β、IL-12、TNF-α的水平。結果 與模型組比較,各治療組均有效降低了血清中IL-1β濃度(P<0.05);甲強龍組、中藥組高、中劑量組能有效降低血清IL-12濃度(P<0.05),低劑量組則不能有效降低血清IL-1β濃度(P>0.05);中藥中、高劑量組能有效降低血清TNF-α濃度(P<0.05),低劑量組、甲強龍組不能有效降低血清TNF-α濃度(P>0.05)。結論 清熱解毒扶正顆粒中、高劑量組能有效下調ETM大鼠血清中IL-1β、IL-12等炎性因子的含量,從而在某種程度上達到對內毒素血癥的治療作用。
關鍵詞:清熱解毒扶正顆粒;內毒素血癥;白介素-1β;白介素-12;腫瘤壞死因子-α
中圖分類號:R285.5 文獻標志碼:A 文章編號:1007-2349(2017)02-0087-03
現代醫學認為,內毒素血癥(Endotoxeamia,ETM)發生原因是在嚴重創傷、感染等應激狀態下全身的網狀內皮系統功能障礙,免疫機能下降,腸腔革蘭陰性細菌內毒素從腸道移位進入血液及機體組織,誘導內毒素血癥及全身免疫反應的發生,導致機體組織、細胞的損傷,造成機體死亡[1]。其誘導的大量炎性介質失控性釋放所致的全身炎性反應綜合征(SIRS),以及進一步惡化發展成為的多臟器功能失常綜合征(MODS)是嚴重感染患者走向死亡的主要途徑,而該惡性進展的關鍵啟動因子為內毒素及其誘導的失控性大量炎性介質。因此,拮抗內毒素及調控其誘導的失控性大量炎性介質具有重要臨床意義。本研究通過腹腔注射脂多糖(lipopo-lysaccharide,LPS)誘導大鼠內毒素血癥模型,觀察各處理組大鼠血清中白介素-1β(IL-1β)、白介素-12(IL-12)、腫瘤壞死因子-α(TNF-α)的濃度水平,旨在了解清熱解毒扶正顆粒對大鼠ETM模型中炎性介質的影響,并探討其部分藥效。現報道如下。
1 材料
1.1 實驗動物 選擇Wistar大鼠(SCXK{川}2013-24,001643)90只,體重(200±20)g。
1.2 實驗試劑 LPS(sigma公司,L2630),大鼠(Rat)白介素1β(IL-1β)、白介素12(IL-12)、腫瘤壞死因子α(TNF-α)ELISA檢測試劑盒(Biocalvin,蘇州卡爾文生物科技有限公司,20250802A)。
1.3 實驗藥品 ①清熱解毒扶正顆粒:由翼首草,荷葉頂,魚腥草,柴胡,葛根,太子參,麥冬,丹皮,薏苡仁等14味藥組成。以上14味藥由云南中醫學院第一附屬醫院中藥房鑒定為正品;薏苡仁、葛根、丹皮粉碎成細粉,其余翼首草等11味加水煎煮3次,每次1 h,合并煎液,濾過,濃縮至相應密度為1.30~1.35(500C)的浸膏1份,蔗糖3份,糊精1份,及上述細粉混勻,制成顆粒,干燥既得。1 g相當于原生藥1.26 g。相當于15 g/袋含生藥18.9 g,1日服生藥56.7 g。低劑量組含生藥為0.5 g/ml,中劑量組含生藥為1 g/mL,高劑量組含生藥為2 g/mL。4℃保存;②甲基強的松龍(國藥集團容生制藥有限公司,40 mg,國藥準字H20030727)。
1.4 主要實驗儀器及設備 ①酶標儀(450nm,spectraMax i3x,美國MOLECULAR DEVICES公司)。②恒溫箱(3111,美國Thermo公司)。③離心機(1.0R,美國Thermo公司)。④電子天平(YP3000型,上海精科天平廠)。
2 方法
2.1. 實驗動物造模 除正常組外,其余大鼠根據文獻[1]采用腹腔注射脂多糖(LPS)致大鼠內毒素血癥模型。具體操作方法是先每日測量大鼠體溫(肛溫)2次,連續2 d,取2次體溫的平均值記為基礎體溫。單次體溫超過38℃或2次體溫差超過0.5℃的動物剔除。實驗前6 h禁食不禁水。然后腹腔注射LPS,誘導動物發熱,注射LPS后每隔30 min測一次體溫,連續測8h。
2.2 實驗動物分組與處理 90只大鼠進行編號,查隨機數字表分為正常組、模型對照組、西藥組、中藥低劑量組、中藥中劑量組、中藥高劑量組。(1)正常組每日予生理鹽水1ml /100g灌胃,每天1次;(2)其余大鼠均腹腔注射脂多糖(LPS)制成大鼠內毒素血癥模型,脂多糖用生理鹽水配制成10mg/ml溶液,參照文獻1造模方法造模成功后分為模型對照組、西藥組、中藥低、中、高劑量組。①模型對照組予生理鹽水1ml/100g灌胃,每天1次;②西藥組給甲基強的松龍:1.17mg/100g體重灌胃,每天1次;③中藥組每日灌胃1次,按照人與大鼠劑量換算標準并適當調整確定灌胃劑量:給藥劑量(g/kg)=給出的人的劑量(g)×系數(0.018)/所求動物體重(kg);1ml/100g灌胃,每天1次;中藥低、中、高劑量分別相當于5、10、20g/kg。分別于3d、7d和14d每組各處死大鼠1只,4周后(28天)處死所有大鼠。
2.3 觀察檢測指標 實驗結束后,將抽取的小鼠血液放入血清分離管中,室溫放置30min,以3000r·min-1離心10min分離血清,吸取血清放入1.5mL 離心管中,4℃保存,用ELISA法測定血清IL-1β、IL-12、TNF-α的水平。嚴格按照試劑盒說明書步驟操作。
2.4 統計學方法 結果以(x±s)表示,采用One-Way ANOVA檢驗并對樣本進行方差齊性檢驗;樣本方差不具有齊性時,采用Kruskal-Wallis H test進行檢驗,并進行組間的多重比較[2]。數據使用SPSS 19.0統計軟件進行處理,以P<0.05為差異有統計學意義。
3 結果
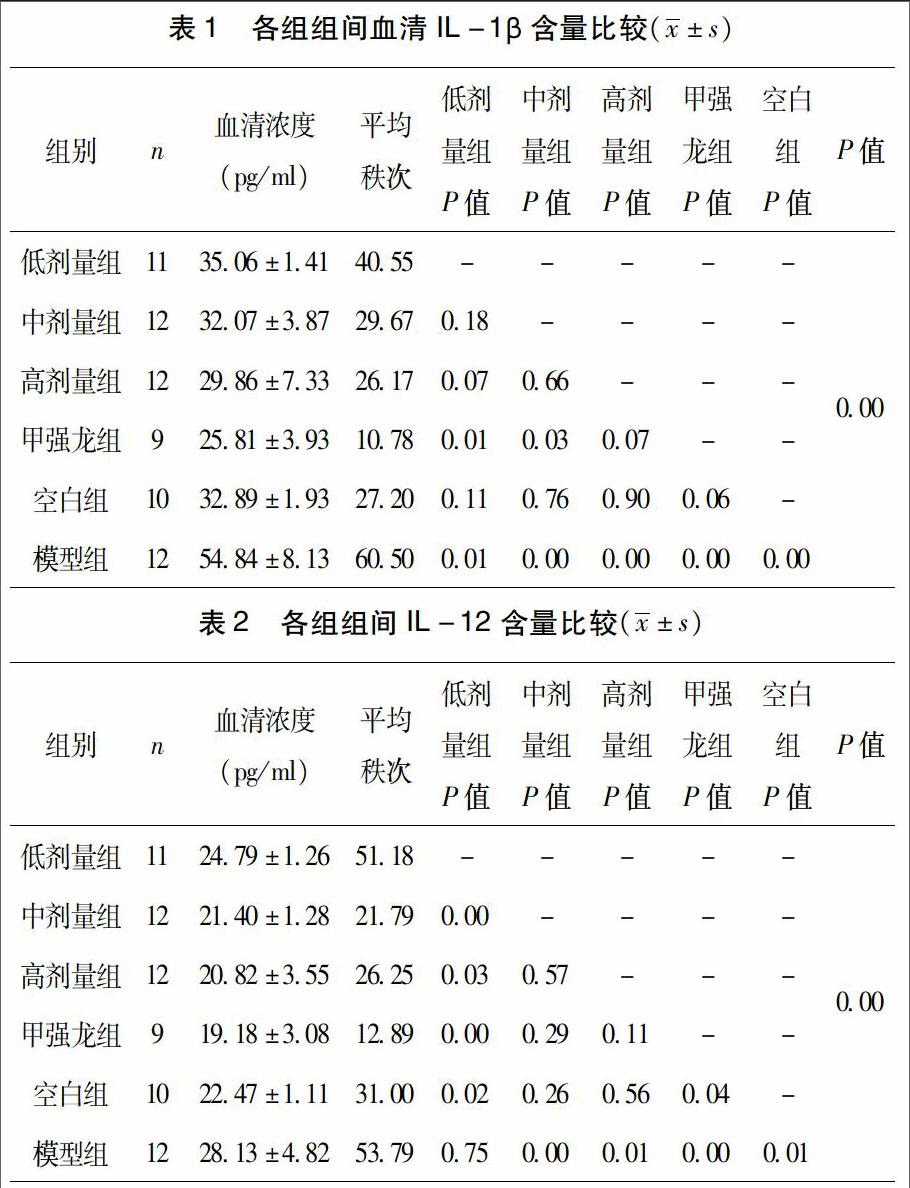
3.1 IL-1β各組間比較 經One-Way ANOVA檢驗,方差不具有齊性,組間多重比較采用Kruskal-Wallis H test進行檢驗,結果如下:P<0.05,各組之間差異有顯著統計學意義。見表1。
各組間兩兩比較(Kruskal-Wallis H test):各組與模型組比較,均表現出了顯著差異性(P<0.05);各組與空白對照組比較,除模型對照組外(P<0.01),差異均不顯著(P>0.05),提示中藥組和甲強龍組均有效降低了血清中IL-1β濃度;甲強龍組和中藥組比較,與中藥高劑量組差異不顯著(P>0.05),與中、低劑量組差異顯著(P<0.05),提示甲強龍組降低血清IL-1β濃度作用優于中藥中、低劑量組;中藥組之間兩兩比較,無統計學差異(P>0.05),亦提示中藥組高、中、低劑量對于均有效降低了血清中IL-1β濃度。
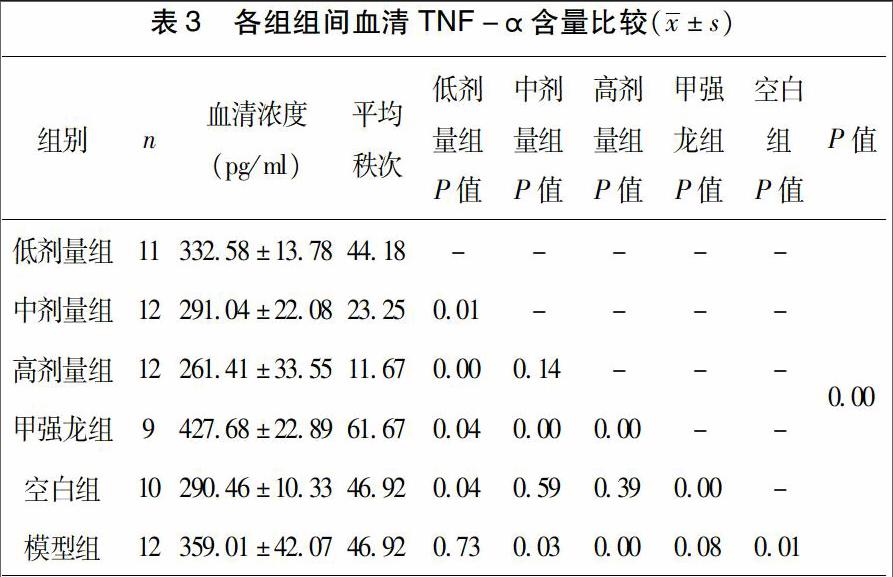
3.2 IL-12各組組間比較 經One-Way ANOVA檢驗,方差不具有齊性,組間多重比較采用Kruskal-Wallis H test進行檢驗,結果如下:P<0.05,各組之間差異有顯著統計學意義。見表2。
各組間兩兩比較(Kruskal-Wallis H test):各組與模型組比較,除低劑量組外(P>0.05)均表現出了顯著差異性(P<0.05),提示甲強龍組、中藥組高、中劑量組能有效降低血清IL-12濃度,低劑量組則不能有效降低血清IL-12濃度。各組與空白對照組比較,高劑量組、中劑量組無統計學差異(P>0.05);甲強龍組、低劑量組均差異顯著(P<0.05),表明中藥組高、中劑量組調控血清IL-12濃度效果要優于甲強龍組;甲強龍組和中藥組比較,與中藥中、高劑量組差異不顯著(P>0.05),與低劑量組差異顯著(P<0.05),提示甲強龍組降低血清IL-12濃度作用優于低劑量組。中藥各組兩兩比較,[HJ2mm]中藥高、中劑量組未見明顯差異(P>0.05),表明2組降低血清IL-12濃度的作用無明顯差異,兩組與低劑量組比較差異均顯著(P<0.05),亦提示低劑量組不能有效降低血清IL-12濃度。
3.3 TNF-α各組組間比較 經One-Way ANOVA檢驗,方差不具有齊性,組間多重比較采用Kruskal-Wallis H test進行檢驗,結果如下:P<0.05,各組之間差異有顯著統計學意義。見表3。
各組間兩兩比較(Kruskal-Wallis H test):各組與模型組比較,中劑量組、高劑量組表現出了顯著差異性(P<0.05),低劑量組、甲強龍組差異不顯著(P>0.05);各組與空白對照組比較,高劑量組、中劑量組無明顯差異(P>0.05),甲強龍組、低劑量組差異顯著(P<0.05),提示中藥中、高劑量組能有效降低血清TNF-α濃度,中藥低劑量組、甲強龍組則不能有效降低血清TNF-α濃度;中藥各組與甲強龍組比較,均差異顯著(P<0.05),提示中藥組低劑量組降低血清TNF-α濃度亦顯著優于甲強龍組;中藥各組兩兩比較,中藥高、中劑量組未見明顯差異(P>0.05),表明兩組降低血清TNF-α濃度的作用無明顯差異,2組與低劑量組比較差異均顯著(P<0.05),亦提示低劑量組不能有效降低血清TNF-α濃度。
4 討論
內毒素血癥多與中醫學“溫病”、“瘟疫”、“熱毒”等過程的一些重癥相似。其病例特點多屬初時邪盛而正氣抵抗力亦強,形成高熱;其后熱盛耗損津液,劫灼營陰,直至動血耗血,終至氣陰耗竭。故內毒素血癥在病機上屬“正虛邪實”,對應的治療原則應是“扶正”和“祛邪”并舉。現代醫學中單純抗生素的應用只能解決“祛邪”的問題,而忽視了“扶正”的保護性治療的重要性。所以不少醫家提出熱毒內盛、瘀血阻滯、氣陰兩虛是內毒素血癥的重要病機,當治以清熱解毒、活血化瘀、益氣養陰[3]。
本研究在中醫的整體論指導下,從整體上把握疾病“證”的變化,制定出以扶正祛邪為治療原則,以清熱解毒、涼血化瘀、益氣養陰為治法的復方中藥制劑——清熱解毒扶正顆粒,為感染性疾病的中醫藥治療提供了有效方法。本制劑由翼首草、芙蓉葉、魚腥草、麥冬、太子參、丹參等14味中藥組成,臨床觀察對外感高熱、肺炎等具有較好的療效[4-5]。方中君藥翼首草為藏藥,生長于高寒地區如西藏各地、青海、四川西部和北部、云南西北部等,具有清熱解毒、祛風濕、止痛等作用,有研究表明對急性炎癥的滲出和水腫有明顯的抑制作用,因此具有顯著的抗炎活性[6]。麥冬中的麥冬皂苷及麥冬多糖可顯著增加小鼠器官胸腺、脾臟重量,并激活小鼠網狀內皮系統的吞噬功能,提高血清溶血素抗體水平.增加機體的免疫力[7]。太子參多糖具有抗疲勞、抗應激和增強機體免疫功能的作用[8]。丹參有效成分丹參酮、丹酚酸類化合物有改善血液循環、抗菌和抗炎、抗氧化、抗凝血和細胞保護等作用[9]。另外魚腥草、芙蓉葉等不僅具有抗病毒、抗菌、抗炎等功效,且均有調節免疫功能的作用。
本次研究結果表明,甲基強的松龍能有效降低血清IL-12濃度,且在降低血清IL-1β濃度方面優于中藥中、低劑量組,和中藥高劑量組則無統計學差異。但甲基強的松龍在本次研究中未見明顯降低血清中TNF-α的水平的作用,甚至在部分ETM大鼠血清中有所升高,這可能與甲基強的松龍對ETM大鼠的免疫抑制引起的免疫調控系統紊亂有關。清熱解毒扶正顆粒中、高劑量組均能有效降低血清中IL-1β、IL-12及TNF-α的濃度水平,且在調控血清IL-12水平方面優于甲基強的松龍,低劑量組能有效降低血清中IL-1β的水平,而對于IL-12及TNF-α則無明顯效果,結合本藥的解熱、抗炎作用的前期研究[4-5],表明清熱解毒扶正顆粒可以通過調節血清中IL-1β、TNF-α等炎性因子在機體的平衡達到對內毒素血癥的治療作用。關于本藥治療內毒素血癥的分子機制及其作用靶點,尚有待于進一步研究探索。
參考文獻:
[1]Brunn CJ,Platt JL.The etiology of sepsis tumed inside out Trends.MolMed,2006,12(1):10-16.
[2]祁海萍,申希平.Kruskal-Wallis H檢驗平均秩多重比較在SPSS軟件中的實現[J].蘭州工業學院學報,2015,02:76-78.
[3]蒲曉東.內毒素血癥中醫病機及治法探討[J].中國中醫急癥,2005,14(12):1190-1192.
[4]萬啟南,陳曉華,等.清熱解毒扶正顆粒治療老年人肺炎59例療效觀察[J].光明中醫,2007,22(7):59.
[5]萬啟南,陳曉華,葉勇,等.清熱解毒扶正顆粒治療外感高熱癥36例[J].中醫研究,2007,20(7):20.
[6]關昕璐,閻玉凝,魏太明,等.翼首草的抗炎作用與急性毒性實驗研究[J].北京中醫藥大學學報,2004.27(2):71-73.
[7]韓風梅,劉春霞,陳勇,等.山麥冬多糖對免疫低下小鼠的保護作用[J].中國醫藥學報,2004,19(6):347-348.
[8]劉訓紅,陳彬,王玉璽.太子參多糖抗應激和免疫增強作用的實驗研究[J].江蘇中醫,2000,21(10):53-54.
[9]杜冠華,張均田.丹參現代研究概況與進展(續前)[J].醫藥導報,2004,07:435-440.
(收稿日期:2016-10-31)

