高產細菌素植物乳桿菌的誘變選育研究
王 芳,陸文俊,楊 靜,別小妹
(南京農業大學食品科技學院,江蘇南京 210095)
高產細菌素植物乳桿菌的誘變選育研究
王 芳,陸文俊,楊 靜,別小妹*
(南京農業大學食品科技學院,江蘇南京 210095)
為獲得細菌素高產菌株,以植物乳桿菌(Lactobacillusplantarum)JLA-9為出發菌株,對其進行亞硝基胍(NTG)誘變、常壓室溫等離子體(ARTP)誘變,以及基因組改組。結果表明,亞硝基胍誘變的最佳濃度為4 mg/mL,經篩選得到兩株突變株N4-26、N4-27,其抑菌效價分別為2531.93、3057.32 IU/mL;常壓室溫等離子體誘變最佳時間為10 s,經篩選得到兩株突變株ARTP10-37、ARTP10-61,其抑菌效價分別為2974.27、3261.62 IU/mL。將上述抑菌效價提高的菌株經四輪基因組改組后,得到一株突變株F4-2,其抑菌效價達到7374.76 IU/mL,相對于原始菌株提高了2.35倍,且遺傳穩定性良好。研究表明理化誘變結合基因組改組的方式是快速獲得理想菌株的有效方法。
細菌素,植物乳桿菌,誘變,基因組改組
細菌素是由核糖體合成的一些有生物活性的多肽或蛋白質,對親緣關系較近的微生物有較強的抑制作用[1-2],還有一些有廣譜抑菌活性[3-7]。幾乎所有細菌都能產生細菌素[8-9],因為其蛋白特性,可被蛋白酶降解,因此被廣泛研究。但從自然界分離得到的菌株產細菌素能力較低,無法滿足工業生產的需要,通過傳統理化誘變及復合誘變獲得高產菌株的研究較多[10],但因其周期長、工作量大、誘變效率低[11],人們開始尋找其他更有效的方法。
基因組改組被譽為菌株改良技術和代謝工程中的里程碑[12],它是以原生質體融合的方式對親本菌株進行整個基因組的隨機重組,以期獲得目的性狀富集的菌株[13]。與傳統誘變方法相比,基因組改組更高效,更方便,不要求了解菌株的遺傳背景、代謝途徑等,可以避開公眾對基因修飾菌的反感[11,14-15]。許多研究者先采用理化誘變方法獲得性狀提升的菌株,再經過幾輪的基因組改組獲得理想菌株,為了提高產物產量[15-18],或為了提高菌株對不良環境耐性[16-17],或為了提高底物轉化率[15,19-20]等等。實踐證明,通過傳統理化誘變與基因組改組相結合的方式改造菌株,是獲得高產細菌素菌株的有效方式[18,21]。
前期研究中,已分離出一株產廣譜細菌素的植物乳桿菌,命名為LactobacillusplantarumJLA-9[22]。本研究的目的是通過基因組改組提高該菌株的抑菌能力,用于基因組改組的菌株是原始菌株經亞硝基胍(NTG)和常壓室溫等離子體(ARTP)誘變得到的,以蠟樣芽孢桿菌(AS 1.1846)作為指示菌。本研究將以L.plantarumJLA-9為原始菌株,通過亞硝基胍(NTG)和常壓室溫等離子體(ARTP)誘變得到細菌素產量提高的菌株,并以此為親本庫進行基因組改組,獲得抑菌能力顯著提高的菌株,并測試其遺傳穩定性。
1 材料與方法
1.1 材料與儀器
植物乳桿菌(Lactobacillusplantarum)JLA-9 由南京農業大學食品科學與技術學院酶工程實驗室分離保藏,已保存于中國普通微生物菌種保藏管理中心(CGMCC No.10686);指示菌蠟樣芽孢桿菌(AS 1.1846) 來源于中國普通微生物菌種保藏中心;MRS、NA培養基、生理鹽水 參考文獻配制[10];Nisin標準品 抑菌效價1000000 IU/g,Sigma公司。
SW-CJ-1FD型單人單面凈化工作臺 蘇州凈化設備有限公司;LDZX-50KBS立式壓力蒸汽滅菌器 上海申安醫療器械廠;隔水式電熱恒溫培養箱 上海躍進醫療器械廠;Anke DL-5-B離心機 上海安亭科學儀器廠;UV-2450紫外可見分光光度計 SHIMADZU;DK-8D型電熱恒溫水槽 上海森信實驗儀器有限公司;ARTP誘變育種儀 無錫源清天木生物科技有限公司;數顯游標卡尺 上海恒量量具制造有限公司。
1.2 實驗方法
1.2.1LactobacillusplantarumJLA-9生長曲線測定 將于-20 ℃甘油管保存的L.plantarumJLA-9劃線接種于MRS固體培養基平板上,37 ℃培養24 h。然后將活化好的菌株接種于MRS液體培養基中(1%,v/v),在0、2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、36、40、44、48 h時間點取樣,測定其OD值、pH。以培養時間為橫坐標,OD值、pH分別為縱坐標,繪制生長曲線。
1.2.2 Nisin效價標準曲線測定 通常情況下,細菌素以Nisin效價標準曲線法測定其相對抑菌效價。Nisin效價標準曲線建立方法如下[10]:準確稱取0.10 g Nisin溶于10 mL 0.02 mol/L的稀鹽酸中,得到效價為10000 IU/mL的母液,通過稀釋分別得到效價為5000、2500、1000、500、250 IU/mL的Nisin溶液。采用牛津杯法做抑菌實驗,以蠟樣芽孢桿菌為指示菌,繪制Nisin效價對數值和抑菌圈直徑之間的散點圖,添加趨勢線,得到Nisin效價標準曲線為:Y=0.2976X-1.6382,R2=0.9974,式中:Y代表Nisin效價對數值;X代表抑菌圈直徑,mm。
1.2.3 誘變方法 將培養至對數后期(16 h)的菌液離心(8000 r/min,10 min),棄上清液,用生理鹽水洗滌2次并重懸得到菌懸液(108CFU/mL)。
1.2.3.1 亞硝基胍(NTG)誘變 移取1 mL菌懸液于2 mL滅菌離心管中,加入亞硝基胍母液(50 mg/mL)使其終濃度為1.0、2.0、3.0、4.0、5.0、6.0 mg/mL。混勻后37 ℃水浴20 min,處理完成后立即用無菌生理鹽水稀釋至合適的梯度(10-5~10-6),取100 μL涂布于MRS固體培養基,于 37 ℃培養箱避光培養,以未經亞硝基胍處理的菌懸液作為對照,培養24 h后菌落計數[23]并計算致死率。挑取單菌落發酵(37 ℃培養箱靜置培養48 h)并進行抑菌實驗[24],計算正突變率。通過致死率和正突變率確定最佳的亞硝基胍誘變濃度。多次在最佳亞硝基胍誘變濃度下誘變原始菌株,通過初篩和復篩篩選抑菌效價明顯提高的菌株。
亞硝基胍母液(50 mg/mL):稱取500 mg亞硝基胍固體,溶于10 mL丙酮,經0.45 μL濾膜過濾待用。
1.2.3.2 常壓室溫等離子體(ARTP)誘變 將小鐵片在酒精燈上灼燒滅菌,置于滅過菌的培養皿中,待小鐵片冷卻后取10 μL菌懸液均勻涂在其上,放入ARTP誘變育種儀進行處理。處理時間分別為2、3、5、10、12、15 s,處理相應時間后用生理鹽水稀釋至合適的梯度(10-5~10-6),取100 μL涂布于MRS固體培養基,于37 ℃培養箱培養,以未經ARTP誘變處理的菌懸液作對照,培養24 h后菌落計數并計算致死率。挑取單菌落發酵并進行抑菌實驗,計算正突變率。通過致死率和正突變率確定最佳的ARTP誘變時間。多次在最佳ARTP誘變時間下誘變原始菌株,通過初篩和復篩篩選抑菌效價明顯提高的菌株。
1.2.3.3 基因組改組 原生質體制備、滅活與融合:將理化誘變得到的優良菌株培養至對數生長后期,離心收集菌體,用原生質體緩沖液洗滌兩次并重懸。向重懸菌液中加入溶菌酶溶液(50 mg/mL,20 μL),并于37 ℃水浴中處理10 min,處理完畢后立即離心(4000 r/min,15 min)去除酶液,并用原生質體緩沖液洗滌兩次并重懸,得到原生質體液。將原生質體液分別采用紫外滅活(紫外照射距離為30 cm,照射時間為210 s)和熱滅活(58 ℃水浴中處理50 min)方法進行滅活。取等量經紫外滅活和熱滅活得到的原生質體液混合,離心去上清,重懸于一定量原生質體緩沖液中,加入9倍原生質體緩沖液體積的促融劑PEG6000,體積分數為40%,37 ℃水浴6 min,結束后立即用原生質體緩沖液稀釋,離心重懸于原生質體緩沖液中。將融合后的原生質體溶液稀釋一定倍數,涂于再生平板,37 ℃培養得到融合菌落。將融合后的原生質體溶液稀釋到10-3~10-4,涂于再生平板,37 ℃培養48 h得到融合菌落。基因組改組:將NTG、ARTP誘變得到的菌株進行原生質體融合,將得到的融合子發酵進行抑菌實驗,選擇抑菌效價高的作為第一輪改組菌株F1。將F1再次進行原生質體制備、滅活、融合,篩選抑菌效價高的菌株作為第二輪改組菌株F2,以此類推。
溶菌酶溶液(50 mg/mL):1 g溶菌酶(索萊寶)溶于5 mL原生質體緩沖液,0.22 μL水相濾膜過濾除菌,-20 ℃冰箱保存。
原生質體緩沖液配制:Tris-HCl 1.21 g,蔗糖171.14 g,MgCl2·6H2O 4.07 g,雙蒸水1 L,pH6.8,115 ℃,20 min滅菌備用。
再生培養基配制:在MRS培養基基礎上,不加吐溫-80,另加入明膠2.5%,25 mmol/L MgCl2,25 mmol/L CaCl2,0.5 mol/L蔗糖,1.7%瓊脂,115 ℃,30 min滅菌備用。
1.2.4 致死率與正突變率的計算 致死率(%)=(未處理平板菌落數-處理平板菌落數)/未處理平板菌落數×100
正突變率(%)=抑菌效價提高菌落數/用于測定效價菌落數×100
1.2.5 細菌素高產菌株篩選
1.2.5.1 初篩 挑取單菌落用2 mL離心管進行發酵(37 ℃培養箱靜置培養48 h),采用打孔法[10]進行抑菌實驗,初步篩選出抑菌活性較好的菌株。
1.2.5.2 復篩 將初篩得到的菌株用三角瓶發酵,采用牛津杯法[10]進行抑菌實驗,篩選得到抑菌相對效價明顯提高的菌株,用甘油管于-20 ℃保藏。
1.2.6 細菌素高產菌株遺傳穩定性測試 將復篩得到的抑菌效價最高的菌株連續傳代5次,于37 ℃發酵培養48 h后測定其相對抑菌效價變化。
1.3 數據處理
所有數據都做三組平行實驗,結果以平均值±標準差表示(SD)。數據采用Excel進行分析。
2 結果與分析
2.1LactobacillusplantarumJLA-9生長曲線測定
L.plantarumJLA-9接種后,在0~2 h處于延滯期,生長緩慢,OD值無明顯變化;在2 h之后,菌株生長進入對數期,菌體密度迅速增加,pH迅速降低;16 h之后,菌株生長進入穩定期,OD值與pH均維持穩定狀態,發酵產物開始積累。菌株在對數生長期對誘變劑較敏感,且生長狀態比較同步,為了保障一定的菌體量,因此選擇對數生長后期進行誘變處理。對于菌株L.plantarumJLA-9,選擇16 h作為進行理化誘變和原生質體制備的菌株培養時間。

圖1 Lactobacillus plantarum JLA-9生長曲線Fig.1 The growth curve of Lactobacillus plantarum JLA-9
2.2 亞硝基胍(NTG)誘變
選用終濃度為1.0~6.0 mg/mL的亞硝基胍對原始菌株進行誘變處理,涂布培養后結果如圖2所示。從圖2中可以看出,隨著亞硝基胍濃度的增加,乳酸菌致死率不斷提高,當亞硝基胍濃度達到4 mg/mL時,致死率達到75.5%,正突變率相對較高,為16.7%,因此選取4 mg/mL為最佳亞硝基胍誘變濃度。在此條件下進行誘變,經篩選得到8株抑菌活性提高的菌株(見圖3),其中兩株抑菌活性提高較大的菌株N4-26、N4-27,其抑菌效價分別為2531.93、3057.32 IU/mL,相對于原始菌株分別提高了14.94%、38.79%。

圖2 NTG誘變致死率與正突變率曲線Fig.2 The fatality rate curve and positive mutation rate curve of NTG mutagenesis

圖3 Lactobacillus plantarum JLA-9原始菌株與NTG誘變突變菌株相對效價的比較Fig.3 Comparison of the wild-type and mutant strains of Lactobacillus plantarum JLA-9 with NTG for relative potency
2.3 常壓室溫等離子體(ARTP)誘變
選用ARTP誘變處理時間分別為2、3、5、10、12、15 s對原始菌株進行誘變處理,涂布培養后結果如圖4所示。從圖4中可以看出,隨著處理時間的增加,乳酸菌致死率不斷提高,當處理時間為10 s時致死率為87.8%。此時菌株發生正向突變的概率為34.375%,因此選擇10 s作為ARTP最佳誘變時間。在此條件下進行誘變,經篩選得到8株抑菌活性提高的菌株(見圖5),其中兩株抑菌活性提高較大的菌株ARTP10-37、ARTP10-61,其抑菌效價分別為2974.27、3261.62 IU/mL,相對于原始菌株分別提高了35.02%、48.06%。
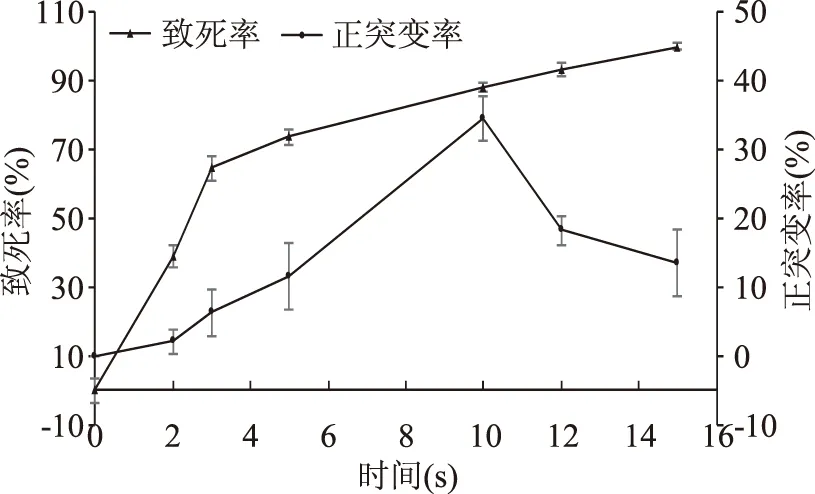
圖4 ARTP誘變致死率與正突變率曲線Fig.4 The fatality rate curve and positive mutation rate curve of ARTP mutagenesis

圖5 Lactobacillus plantarum JLA-9原始菌株與ARTP誘變突變菌株相對效價的比較Fig.5 Comparison of the wild-type and mutant strains of Lactobacillus plantarum JLA-9 with ARTP for relative potency
2.4 基因組改組
以NTG、ARTP誘變獲得的四株抑菌效價相對較高的菌株N4-26、N4-27、ARTP10-37、ARTP10-61為出發菌株進行基因組改組。經第一輪基因組改組,篩選到四株抑菌效價高的菌株,其中F1-23效價為2895.45 IU/mL,相對于原始菌株提高了31.44%;經第二輪基因組改組,篩選到效價最高的菌株為F2-4,其效價為4026.17 IU/mL,相對于原始菌株提高了82.77%;以此類推,經過四輪基因組改組,篩到一株抑菌效價最高的菌株F4-2,其效價達到7374.76 IU/mL,相對于原始菌株提高了2.35倍(見圖6)。

圖6 Lactobacillus plantarum JLA-9原始菌株與突變菌株相對效價的比較Fig.6 Comparison of the wild-type and mutant strains of Lactobacillus plantarum JLA-9 for relative potency
2.5 細菌素高產菌株遺傳穩定性測試
為觀察篩選到的細菌素高產菌株F4-2的遺傳穩定性,將其連續傳代5次,以蠟樣芽孢桿菌為指示菌,測定其相對抑菌效價變化。從圖7可以看出,菌種傳代5次以后抑菌效價無顯著差異(p<0.05),說明該菌有較好的遺傳穩定性,可作為后續應用研究的出發菌株。

圖7 F4-2遺傳穩定性Fig.7 Genetic stability of F4-2 after five generation注:不同小寫字母表示差異顯著(p<0.05)。
3 結論
采用NTG、ARTP兩種理化方式對植物乳桿菌JLA-9(抑菌效價為2202.84 IU/mL)進行誘變,以期獲得高產細菌素菌株。以致死率和正突變率為指標,發現NTG濃度為4 mg/mL、ARTP處理時間為10 s時,兩種誘變方式均能獲得較好的誘變效果。經過篩選,得到4株效價有所提高的菌株,分別為N4-26、N4-27、ARTP10-37、ARTP10-61,其抑菌效價分別為2531.93、3057.32、2974.27、3261.62 IU/mL。將上述4株菌株進行基因組改組,經4次改組后,獲得一株抑菌效價明顯提高的菌株F4-2,其效價達到7374.76 IU/mL,相較于原始菌株,其效價提高了2.35倍。實踐證明,理化誘變結合基因組改組的方式是快速獲得理想菌株的有效方法。
[1]Inglis R F,Bayramoglu B,Gillor O,et al. The role of bacteriocins as selfish genetic elements[J]. Biology Letters,2013,9(3):156-166.
[2]Micenkova L,Staudova B,Bosak J,et al. Bacteriocin-encoding genes and ExPEC virulence determinants are associated in human fecalEscherichiacolistrains[J]. Bmc Microbiology,2014,14(1):1.
[3]Gupta A,Tiwari S K. Plantaricin LD1:A Bacteriocin Produced by Food Isolate ofLactobacillusplantarumLD1[J]. Applied Biochemistry and Biotechnology,2014,172(7):3354-3362.
[4]Miao J Y,Guo H X,Ou Y W,et al. Purification and characterization of bacteriocin F1,a novel bacteriocin produced byLactobacillusparacaseisubsp tolerans FX-6 from Tibetan kefir,a traditional fermented milk from Tibet,China[J]. Food Control,2014,42:48-53.
[5]Lu X,Yi L H,Dang J,et al. Purification of novel bacteriocin produced byLactobacilluscoryniformisMXJ 32 for inhibiting bacterial foodborne pathogens including antibiotic-resistant microorganisms[J]. Food Control,2014,46:264-271.
[6]Lu X,Hu P,Dang Y,et al. Purification and partial characterization of a novel bacteriocin produced byLactobacilluscaseiTN-2 isolated from fermented camel milk(Shubat)of Xinjiang Uygur Autonomous region,China[J]. Food Control,2014,43:276-283.
[7]Zhu X,Zhao Y Z,Sun Y L,et al. Purification and characterisation of plantaricin ZJ008,a novel bacteriocin againstStaphylococcusspp. fromLactobacillusplantarumZJ008[J]. Food Chemistry,2014,165:216-223.
[8]Majeed H,Lampert A,Ghazaryan L,et al. The weak shall inherit:bacteriocin-mediated interactions in bacterial populations[J]. PloS one,2013,8(5):e63837.
[9]O’Connor P M,O’Shea E F,Guinane C M,et al. Nisin H Is a New Nisin Variant Produced by the Gut-Derived StrainStreptococcushyointestinalisDPC6484[J]. Applied and Environmental Microbiology,2015,81(12):3953-3960.
[10]黨麗娟,高鈺淇,別小妹,等. Co60γ射線復合硫酸二乙酯誘變選育高產新型細菌素Plantaricin 163-1 菌株的研究[J]. 食品工業科技,2015(15):174-179.
[11]Gong J X,Zheng H J,Wu Z J,et al. Genome shuffling:Progress and applications for phenotype improvement[J]. Biotechnology Advances,2009,27(6):996-1005.
[12]Stephanopoulos G. Metabolic engineering by genome shuffling-Two reports on whole-genome shuffling demonstrate the application of combinatorial methods for phenotypic improvement in bacteria[J]. Nature Biotechnology,2002,20(7):666-668.
[13]Hida H,Yamada T,Yamada Y. Genome shuffling ofStreptomycessp U121 for improved production of hydroxycitric acid[J]. Applied Microbiology and Biotechnology,2007,73(6):1387-1393.
[14]Skelley A M,Kirak O,Suh H,et al. Microfluidic control of cell pairing and fusion[J]. Nature Methods,2009,6(2):147-152.
[15]John R P,Gangadharan D,Nampoothiri K M. Genome shuffling of Lactobacillus delbrueckii mutant and Bacillus amyloliquefaciens through protoplasmic fusion for L-lactic acid production from starchy wastes[J]. Bioresource Technology,2008,99(17):8008-8015.
[16]Yu L,Pei X,Lei T,et al. Genome shuffling enhanced L-lactic acid production by improving glucose tolerance of Lactobacillus rhamnosus[J]. Journal of Biotechnology,2008,134(1-2):154-159.
[17]Wang Y H,Li Y,Pei X L,et al. Genome-shuffling improved acid tolerance and L-lactic acid volumetric productivity in Lactobacillus rhamnosus[J]. Journal of Biotechnology,2007,129(3):510-515.
[18]Wang H K,Sun Y,Chen C,et al. Genome shuffling of Lactobacillus plantarum for improving antifungal activity[J]. Food Control,2013,32(2):341-347.
[19]Dai M H,Copley S D. Genome shuffling improves degradation of the anthropogenic pesticide pentachlorophenol by Sphingobium chlorophenolicum ATCC 39723[J]. Applied and Environmental Microbiology,2004,70(4):2391-2397.
[20]Kumar M. Improving polycyclic aromatic hydrocarbons degradation by genome shuffling[J]. Asian J Microbiol Biotechnol Environ Sci,2007,9(1):145-149.
[21]Zheng H J,Gong J X,Chen T,et al. Strain improvement ofSporolactobacillusinulinusATCC 15538 for acid tolerance and production of D-lactic acid by genome shuffling[J]. Applied Microbiology and Biotechnology,2010,85(5):1541-1549.
[22]Zhao S M,Han J Z,Bie X M,et al. Purification and Characterization of Plantaricin JLA-9:A Novel Bacteriocin againstBacillusspp. Produced byLactobacillusplantarumJLA-9 from Suan-Tsai,a Traditional Chinese Fermented Cabbage[J]. Journal of Agricultural and Food Chemistry,2016,64(13):2754-2764.
[23]劉慧. 現代食品微生物學實驗技術[M]. 北京:中國輕工業出版社,2006.
[24]Gong H S,Meng X,Wang H. Plantaricin MG active against Gram-negative bacteria produced byLactobacillusplantarumKLDS1.0391 isolated from “Jiaoke”,a traditional fermented creamfrom China[J]. Food Control,2010,21(1):89-96.
Study on screeging of high-yield bacteriocin producingLactobacillusplantarumstains induced by mutations
WANG Fang,LU Wen-jun,YANG Jing,BIE Xiao-mei*
(College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
In order to obtain a high-yield bacteriocin producing strain,LactobacillusplantarumJLA-9 was used as the starting stain and mutagenized with nitrosoguanidine(NTG),atmospheric and room temperature plasma(ARTP)and genome shuffling. The results showed that the optimal concentration of NTG was 4 mg/mL,and two mutants named N4-26,N4-27 were obtained,the antibacterial titer of which were 2531.93 IU/mL,3057.32 IU/mL respectively. The optimal irradiation time of ARTP was 10 s,and two mutants named ARTP10-37,ARTP10-61 were obtained,the antibacterial titer of which were 2974.27 IU/mL,3261.62 IU/mL respectively. The four strains with higher inhibitory activity were subjected to recursive protoplast fusion. After four rounds of genome shuffling,a strain named F4-2 was screened. The antibacterial titer of strain F4-2 was increased to 7374.76 IU/mL,2.35 times compared with the wild-type strain. Research showed that physical and chemical mutagenesis combined with genome shuffling was an effective method for obtaining ideal strains.
bacteriocin;Lactobacillusplantarum;mutagenesis;genome shuffling
2016-06-13
王芳(1990-),女,在讀碩士研究生,研究方向:發酵工程,E-mail:2014108001@njau.edu.cn。
*通訊作者:別小妹(1964-),女,博士,研究方向:食品微生物與生物技術,E-mail:bxm43@njau.edu.cn。
TS201.3
A
1002-0306(2017)02-0191-05
10.13386/j.issn1002-0306.2017.02.028

