攜目的基因的靶向超聲微泡對肝癌HepG2細胞增殖活性的影響
李 炯,顧海濤,孫 勇
(1.重慶市渝北區人民醫院外科 401120;2.重慶醫科大學附屬第二醫院普通外科 400010; 3.重慶市巴南區中醫院 401320)
攜目的基因的靶向超聲微泡對肝癌HepG2細胞增殖活性的影響
李 炯1,顧海濤2△,孫 勇3▲
(1.重慶市渝北區人民醫院外科 401120;2.重慶醫科大學附屬第二醫院普通外科 400010; 3.重慶市巴南區中醫院 401320)
目的 制備一種靶向肝癌HepG2細胞的載單純皰疹病毒胸腺嘧啶核苷激酶(HSV-TK)基因超聲微泡,并考察其體外尋靶能力及對HepG2細胞的增殖抑制作用。方法 用機械振蕩法制備超聲微泡,生物素-親和素橋連方式構建靶向載HSV-TK超聲微泡。檢測其一般特性,并進行體外實驗檢測其對HepG2細胞增殖的影響。結果 靶向載HSV-TK超聲微泡可較多地聚集在HepG2細胞表面,通過檢測增殖細胞核抗原(PCNA)及噻唑藍(MTT)法,發現載基因靶向微泡組的增殖能力明顯下降,細胞凋亡明顯增加,細胞侵襲實驗表明載基因靶向微泡組(22.18±2.01)較對照組及載基因非靶向微泡組明顯減少,對HepG2細胞增殖及侵襲能力有較好的抑制作用。結論 攜目的基因靶向超聲微泡對肝癌HepG2細胞在體外有較好抑制效果。
肝腫瘤;細胞增殖;超聲微泡;GPC3;HepG2細胞
肝癌在全球發病率呈逐年上升趨勢,并逐步年輕化,其危害性大,治愈率低,病情進展較快,被稱為“癌中之王”。外科手術雖然能夠提供較好的治療效果,但受制于較多其他因素,適合并接受手術者僅為20%。隨著超聲分子顯像技術的不斷發展,靶向超聲造影劑的設計及制備已得到極大的進步。靶向超聲造影劑可以作為治療藥物或基因的載體,通過血液循環特異性地聚集于靶組織,從而達到靶向治療的目的。已有研究發現,脂酰肌醇蛋白聚糖3(GPC-3)特異性地在肝癌細胞中表達,以此作為靶點進行載藥或載基因靶向治療有較好的臨床應用前景。
1 材料與方法
1.1 材料與儀器 抗人GPC-3單克隆抗體(美國R&D systems);二棕櫚酰磷脂酰乙醇胺(DSPE-PEG)(2000)Biotin(美國Avanti);二棕櫚酰磷脂酰膽堿(DPPC)、二棕櫚酰磷脂酰乙醇胺(DPPE)、疊氮磷酸二苯酯(DPPA)(德國Lipoid);單純皰疹病毒胸腺嘧啶核苷激酶(HSV-TK)質粒(重慶醫科大學附屬第二醫院超聲影像研究所惠贈);鏈酶親和素(美國Sigma);N-羥基琥珀酰亞胺生物素酯(美國Sigma);熒光染料DiI(美國Sigma);THZ-C恒溫振蕩器(江蘇太倉實驗設備廠);高速離心機(德國Eppendorf);倒置熒光顯微鏡(日本Olympus);肝癌HepG2細胞株(重慶醫科大學生物工程研究所惠贈)。
1.2 方法
1.2.1 超聲微泡的制備 稱量成膜磷脂材料DSPE-PEG(2000)Biotin、DPPC、DPPE、DPPA,按一定比例混合,加入少量熒光染料,溶于定量的甲醛和三氯甲烷混合溶液中,甲醛和三氯甲烷揮發完全后,加入甘油和磷酸鹽緩沖液(PBS),在45 ℃水浴箱中孵育30 min,再次使用氟碳氣體置換空氣,在振蕩器中振蕩50 s得到脂質超聲微泡。
1.2.2 攜帶GPC-3抗體及HSV-TK基因的靶向超聲微泡的制備 取適量(約含3.0×108微泡)已制備好的微泡,將其加入2 mL EP管中;加入90 μg 鏈霉親和素,輕輕反復顛倒搖勻,置于4 ℃冰箱,孵育30 min;然后在4 ℃環境下離心,棄下清液,PBS輕輕漂洗后離心2次,棄下清液、去除過量的鏈霉親和素;加入20 μg 生物素化GPC-3抗體輕輕顛倒搖勻,4 ℃孵育30 min;4 ℃ 500 r/min離心4 min,PBS漂洗離心2次,棄下清液,去除過量的GPC-3抗體,即可得到攜GPC-3抗體的靶向超聲微泡。取適量異硫氰酸熒光素(FITC)標記的山羊抗兔IgG作為二抗,攜GPC-3抗體的超聲微泡中,4 ℃孵育30 min;4 ℃ 500 r/min離心4 min,棄下清液,PBS漂洗離心2次,棄下清液,去除過量的二抗;取出提取的HSV-TK質粒20 μg,加入上述已連接GPC-3抗體的微泡溶液共孵育,去除下清液得到靶向攜基因超聲微泡。將微泡涂片,熒光顯微鏡下觀察。
1.2.3 熒光顯微鏡下觀察靶向載基因超聲微泡對肝癌HepG2細胞的結合情況 取對數生長期HepG2細胞,在6孔板底部以1×104/孔進行接種,細胞培養貼壁后,繼續培養,制備細胞爬片,設置對照組和靶向微泡組,每組各5張,對照組加入非靶向微泡200 μL,靶向組加入靶向載基因超聲微泡200 μL,于5% CO2、37 ℃培養箱中共孵育2 h,取出爬片,PBS反復沖洗5次,在熒光顯微鏡下觀察結合情況。
1.2.4 逆轉錄聚合酶鏈反應(RT-PCR)及Western blot 檢測肝癌HepG2細胞中增殖細胞核抗原(PCNA)表達情況 將靶向超聲微泡與對數生長期HepG2細胞在5% CO2、37 ℃培養箱中共孵育30 min,給予超聲輻射(1 MHz,2 W/cm2,間隔30 s,持續5 min),基因轉染完成后,加入羥甲基無環鳥苷(GCV)溶液100 μL(濃度為10 mg/L)。超聲輻照后,再次孵育48 h,收集細胞,分別提取總RNA和蛋白,RT-PCR及Western blot 檢測肝癌HepG2細胞中PCNA表達情況。
1.2.5 噻唑藍(MTT)法檢測各組細胞凋亡 HSV-TK質粒在超聲作用下轉染進入細胞后,加入GCV,繼續培養72 h,進行MTT實驗,每孔加入MTT溶液20 μL,繼續孵育4 h,終止培養,吸取上清液,每孔加入150 μL二甲基亞砜(DMSO),振蕩10 min,使晶體充分降解,然后進行比色,在490 nm波長下測定各組細胞光吸收值并記錄實驗結果。
1.2.6 細胞侵襲實驗 將冰凍BD matrigel置于4 ℃,待其變成液體后,將其與無血清1640培養基按1∶2比例稀釋,transwell置于24孔板中,加入稀釋后的matrigel(每孔100 μL)于transwell上室,置于37 ℃孵箱中4 h;HepG2細胞重懸于含1%胎牛血清(FBS)的RPMI-1640培養基中,調整濃度為5×105/mL,每孔200 μL接種于預先鋪好matrigel的transwell上室中;HepG2細胞轉染后72 h,收集各組培養液,按照分組以每孔600 μL加入transwell下室中,繼續在37 ℃、5% CO2孵箱中培養24 h;棉簽拭去上室殘留未侵襲細胞,transwell小室中加入0.1%結晶紫,置于37 ℃孵箱中30 min,倒置顯微鏡下(200×)觀察腫瘤細胞侵襲能力,隨機選擇5個視野進行計數。
2 結 果
2.1 超聲微泡特征 白光下觀察超聲微泡大小均一,分布均勻,見圖1。
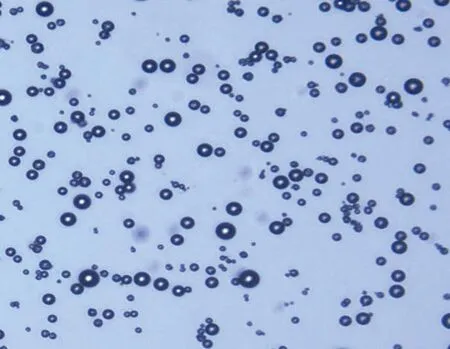
圖1 微泡在激光共聚焦顯微鏡下成像特征(白光,×1 000)
2.2 微泡造影劑粒徑及表面電位特征 微泡造影劑粒徑(Diameter)為(512.57±25.18)nm,其表面電位(Zeta-potential)為(-2.54±0.75)mV。
2.3 超聲微泡與GPC-3抗體連接情況 超聲微泡與GPC-3抗體結合后在激光共聚焦顯微鏡下成像情況,白光下觀察大小一致,分布均勻,激光激發后,周圍呈現綠色熒光,表明靶向載基因微泡成功構建(圖2)。
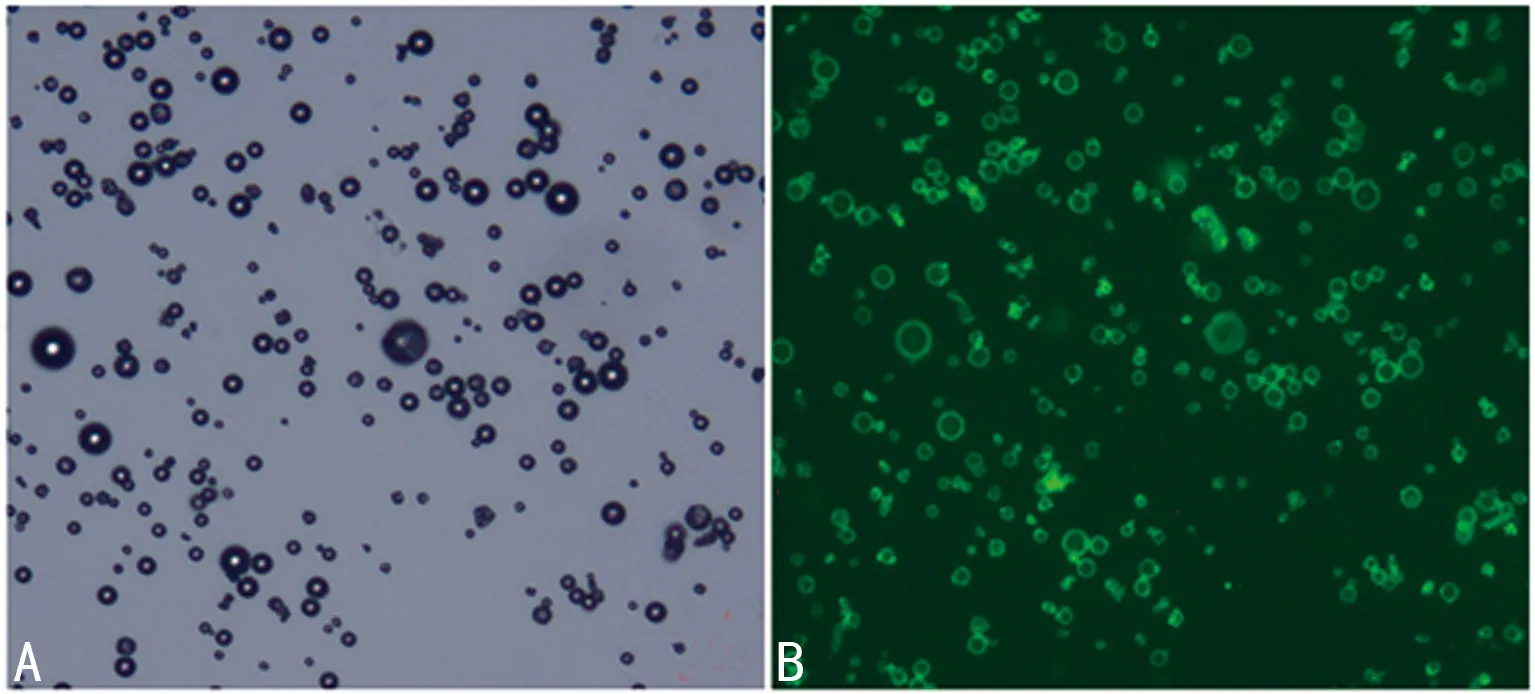
A:MB的白光圖像;B:MB-GPC-3與二抗連接后在激光激發下呈現綠色熒光。
圖2 超聲微泡在激光共聚焦顯微鏡下成像(×1 000)
2.4 靶向載基因超聲微泡體外尋靶 400倍光鏡下觀察到:(1)載基因靶向微泡組(MB-GPC-3組),較多量載基因靶向微泡造影劑與肝癌HepG2細胞緊密結合,主要分布在細胞周邊及細胞壁游離面上(圖3B);(2)載基因非靶向微泡組(MB組),在PBS 的反復沖洗下,細胞周圍觀察不到或僅見少量造影劑黏附(圖3A)。

A:MB組;B:MB-GPC-3組。
圖3 體外尋靶實驗(白光,×400)
2.5 攜HSV-TK質粒的不同微泡的轉染效率 由于構建質粒是已將綠色熒光蛋白(GFP)連接進入質粒,因此當HSV-TK質粒成功轉染進入細胞后,熒光顯微鏡下會見到綠色熒光,此時就可表明質粒轉染成功。轉染24 h后,熒光顯微鏡下觀察見對照組無熒光表達,MB組和MB-GPC-3組熒光表達較多,其中MB-GPC3組表達最高。各組轉染效率分別為(0.26±0.05)%、(2.73±0.34)%、(20.53±2.15)%,MB-GPC3組轉染效率最高,差異有統計學意義(P<0.01),見圖4。

圖4 轉染質粒后各組細胞熒光表達(×400)
2.6 RT-PCR及Western blot 檢測靶向轉染HSV-TK質粒后HepG2細胞中PCNA表達 轉染后48 h測PCNA mRNA和蛋白表達情況,對照組mRNA和蛋白表達最高,MB組和MB-GPC3組表達水平降低,其中MB-GPC3組表達水平最低,見圖5、6。

a:P<0.05,與對照組比較;b:P<0.01,與對照組和MB組比較。
圖5 PCNA mRNA表達情況
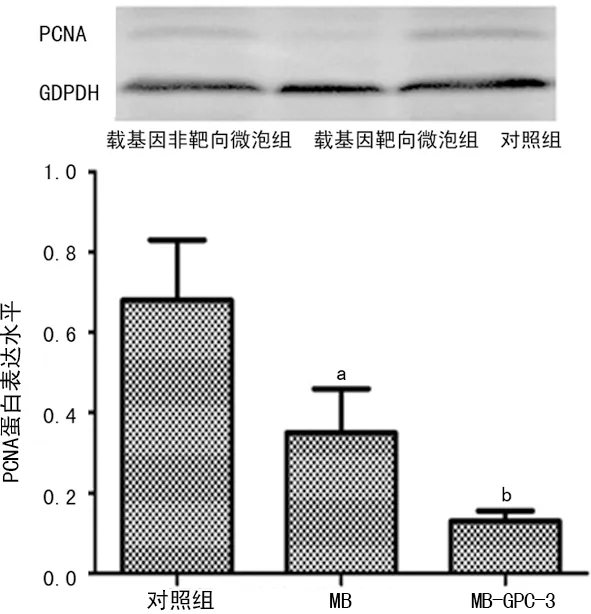
a:P<0.05,與對照組比較;b:P<0.01,與對照組和MB組比較。
圖6 PCNA蛋白表達情況
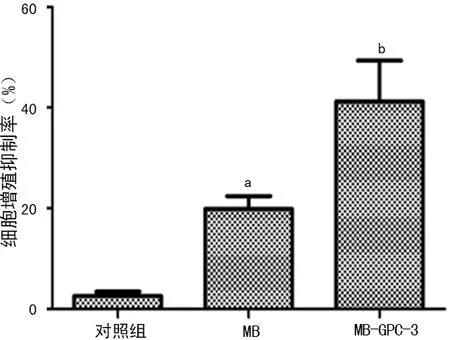
a:P<0.05,與對照組比較;b:P<0.01,與對照組和MB組比較。
圖7 細胞增殖抑制率
2.7 MTT檢測細胞增殖抑制 MTT法檢測轉染HSV-TK質粒對HepG2細胞的增殖抑制作用,結果顯示,各實驗組對HepG2細胞均有不同抑制,MB組和MB-GPC-3組抑制最為明顯,與對照組比較差異有統計學意義(P<0.01),見圖7。
2.8 Transwell法檢測轉染HSV-TK質粒后對HepG2細胞侵襲力的影響 各組經過相應處理的HepG2細胞穿過transwell上下室之間聚碳酸酯膜的結果如下,對照組(57.63±4.61)及MB組(49.16±3.89)穿過室膜的細胞數量較多,而MB組和MB-GPC-3組穿過的細胞數量較少,其中MB-GPC-3組穿過的細胞數最少(22.18±2.01)。兩組與對照組相比,差異均具有統計學意義(P<0.05),而MB-GPC-3組侵襲細胞數量最低,差異有統計學意義(P<0.05),見圖8。
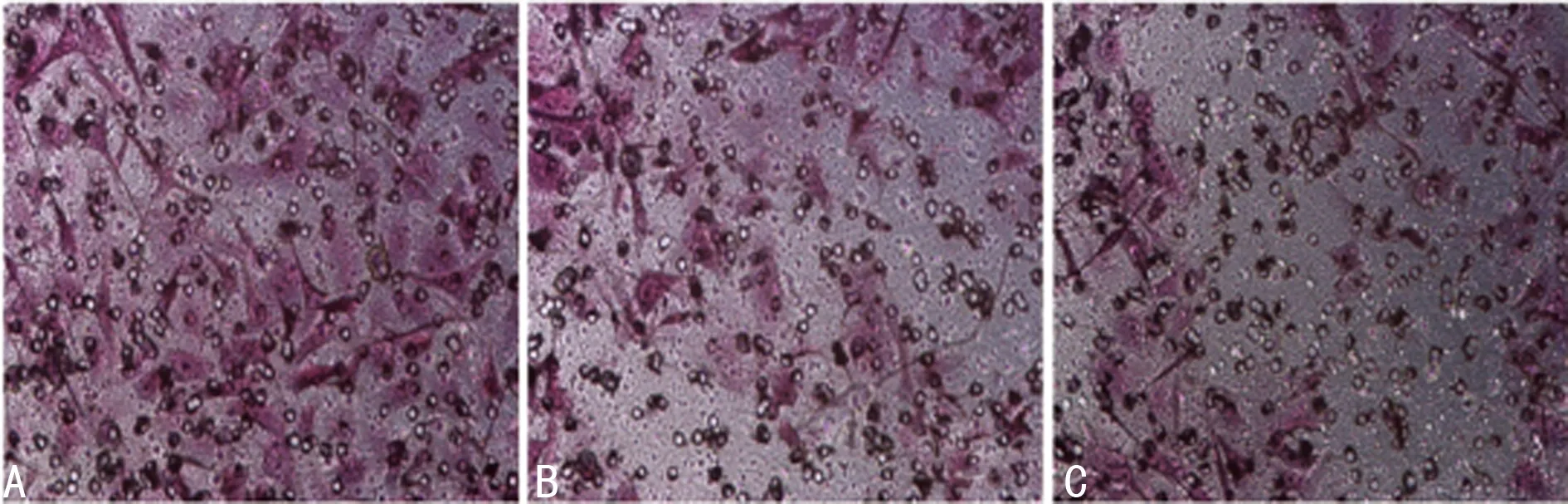
A:對照組;B:MB組;C:MB-GPC-3組。
圖8 Transwell法檢測HepG2細胞侵襲力(伊紅染色×400)
3 討 論
隨著科學技術發展,人們對腫瘤研究的逐步深入,發現從分子水平對腫瘤進行特異性殺傷成為新的治療策略[1],但如何將用于治療的基因高效、安全地轉染進入細胞是目前研究的熱點和難點。就目前而言,病毒載體是最高效的轉染方式,但其本身會引起機體的免疫反應及不確定的致瘤性也限制了它的發展和應用。于是結合當前研究熱點,選擇非病毒載體來攜帶目的基因進行轉染,但它們普遍存在攜載率低等缺陷[2]。超聲微泡靶向破壞技術是利用超聲輻照破壞微泡時產生的空化效應及聲孔效應使內皮細胞間隙擴大,細胞膜產生可逆性的小孔,有利于胞外的物質進入細胞,由此提供新的思路[3-6]。
超聲微泡作為超聲造影劑被廣泛應用于超聲診斷[7],其同時也具備攜載基因及藥物的功能,因其具備安全、高效、簡單便捷等優點[8],已被眾多研究者用于體內、體外靶向轉染,并在多種疾病的診斷及治療方面展現出極好的優勢[9-10]。超聲微泡是有被膜及核心氣體構成小的氣泡[11],目前以脂質微泡為主,脂質微泡較其他微泡比較具有穩定性好、持續時間長、制備工藝簡單等優勢,但也存在攜載率低、靶向性差等缺點[12-14]。因此如何提高其攜載率及改變其靶向性成為研究目標。普通超聲微泡由DSPE-PEG(2000)、DPPC、DPPE及DPPA等按一定比例混合后,在機械振蕩作用下構建而成[15]。由于其膜性成分決定了其表面為負電荷或中性,多肽、抗體等有機成分均為負電荷,因此二者之間結合較為困難,目前最常用的連接方法為通過多聚賴氨酸轉化電荷進行橋連。攜載質粒的靶向微泡在體外可順利達到靶標,并與靶標通過抗原抗體反應進行特異性結合,然后在超聲作用下爆破微泡釋放HSV-TK質粒,進而促進轉染。
本實驗中證實轉染后有TK蛋白表達,在MB-GPC3組呈現高表達,高于其他各組,說明靶向微泡可以明顯地促進基因轉染。HSV-TK質粒進入細胞后并沒有直接殺傷腫瘤細胞作用,在給予前藥GCV后,HSV-TK可以將無毒的GCV轉化成細胞毒性藥物從而進行殺傷。MTT實驗證實MB及MB-GPC3組細胞凋亡較多,其中MB-GPC3組凋亡細胞最多,高達49%;與此同時細胞的侵襲能力得以降低。
綜上所述,本研究成功制備了可以攜帶目的基因的靶向超聲微泡,并在體外可特異性地與靶細胞結合,在超聲輻射下靶向釋放目的基因,從而提高了轉染效率,為腫瘤靶向治療提供了新思路。
[1]Marukawa Y,Nakamoto Y,Kakinoki K,et al.Membrane-bound form of monocyte chemoattractant protein-1 enhances antitumor effects of suicide gene therapy in a model of hepatocellular carcinoma[J].Cancer Gene Ther,2012,19(5):312-319.
[2]Taniyama Y,Azuma J,Kunugiza Y,et al.Therapeutic option of plasmid-DNA based gene transfer[J].Curr Top Med Chem,2012,12(15):1630-1637.
[3]Porter TR,Iversen PL,Li S,et al.Interaction of diagnostic ultrasound with synthetic oligonucleotide-labeled perfluorocarbon-exposed sonicated dextrose albumin microbubbles[J].J Ultrasound Med,1996,15(8):577-584.
[4]Greenleaf WJ,Bolander ME,Sarkar G,et al.Artificial cavitation nuclei significantly enhance acoustically induced cell transfection[J].Ultrasound Med Biol,1998,24(4):587-595.
[5]Miller DL,Pislaru SV,Greenleaf JE.Sonoporation:mechanical DNA delivery by ultrasonic cavitation[J].Somat Cell Mol Genet,2002,27(1/6):115-134.
[6]Nomikou N,Tiwari P,Trehan T,et al.Studies on neutral,cationic and biotinylated cationic microbubbles in enhancing ultrasound-mediated gene delivery in vitro and in vivo[J].Acta Biomater,2012,8(3):1273-1280.
[7]Nomikou N,Mchale AP.Exploiting ultrasound-mediated effects in delivering targeted,site-specific cancer therapy[J].Cancer Lett,2010,296(2):133-143.
[8]張清鳳,王志剛,冉海濤,等.一種載基因陽離子微泡超聲造影劑的制備及特性研究[J].中國超聲醫學雜志,2012,28(6):485-488.
[9]Dang SP,Wang RX,Qin MD,et al.A novel transfection method for eukarotic cells using polythylenimine coated albumin microbubbles[J].Plasmid,2011,66(1):19-25.
[10]Frenkel V.Ultrasound mediated delivery of drugs and genes to solid tumors[J].Adv Drug Deliv Rev,2008,60(10):1193-1208.
[11]張清鳳,王志剛,李攀,等.超聲聯合陽離子微泡造影劑體外增強基因轉染[J].中國醫學影像技術,2012,28(2):211-215.
[12]Wang DS,Panje C,Pysz MA,et al.Cationic versus neutral microbubbles for ultrasound-mediated gene delivery in cancer[J].Radiology,2012,264(3):721-732.
[13]Sun L,Huang CW,Wu J,et al.The use of cationic microbubbles to improve ultrasound-targeted gene delivery to the ischemic myocardium[J].Biomaterials,2013,34(8):2107-2116.
[14]Chung DJ,Cho SH,Lee JM,et al.Effect of microbubble contrast agent during high intensity focused ultrasound ablation on rabbit liver in vivo[J].Eur J Radiol,2012,81(4):519-523.
[15]Kiessling F,Huppert J,Palmowski M.Functional and molecular ultrasound imaging:concepts and contrast agents[J].Curr Med Chem,2009,16(5):627-642.
Effect of targeted ultrasound microbubble carrying target gene on the proliferation of HepG2 cells in human hepatocellular carcinoma
LiJiong1,GuHaitao2△,SunYong3▲
(1.DepartmentofSurgery,thePeople′sHospitalofYubeiDistrict,Chongqing401120,China; 2.DepartmentofSurgery,theSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China; 3.TranditionalChineseMedicineHospitalofBananDistrict,Chongqing401320,China)
Objective To prepare a targeted ultrasound micro bubble,which carried the HSV-TK gene,and investigate the in vitro target searching ability of the micro bubbles and inhibitory effect on the proliferation of HepG2 cells.Methods Ultrasonic micro bubbles were prepared by mechanical vibration method,construction of targeted HSV-TK ultrasound micro bubbles by biotin affinity bridge construction.To detect the general characteristics of ultrasound micro bubbles,and to test its effect on the proliferation of HepG2 cells in vitro.Results HSV-TK targeted ultrasound microbubbles more gathered on the surface of HepG2 cells,through detection of PCNA and MTT,it was found that the proliferation of gene targeting microbubble group was obviously decreased,cell apoptosis increased significantly,Cells invade experiments showed that the number of cells in genetic microbubble group (22.18±2.01)decreased significantly compared with the control group and the nontargeted group,can effectively inhibit the proliferation and invasive ability of HepG2 cells.Conclusion Targeted ultrasound microbubble carrying target gene have better inhibitory effect on HepG2 cells in vitro.
liver neoplasms;cell proliferation;ultrasound micro bubble;GPC3;HepG2 cell
李炯(1981-),主治醫師,碩士,主要從事肝膽胸外科的研究。△
,E-mail:664186632@qq.com。▲共同通信作者,E-mail:404818126@qq.com。
??·基礎研究
10.3969/j.issn.1671-8348.2017.05.008
R735.7
A
1671-8348(2017)05-0600-04
2016-07-09
2016-09-07)

