下調CENP-W對人腦膠質瘤U87細胞的影響*
汲乾坤, 李建斌, 范陽華, 徐 斌, 柴 毅, 紀晨星, 祝新根△
(1新鄉醫學院第一附屬醫院神經外科, 河南 新鄉453100; 2南昌市第二醫院神經外科,3南昌大學第二附屬醫院神經外科, 江西 南昌 330006)
下調CENP-W對人腦膠質瘤U87細胞的影響*
汲乾坤1, 李建斌2, 范陽華3, 徐 斌3, 柴 毅3, 紀晨星3, 祝新根3△
(1新鄉醫學院第一附屬醫院神經外科, 河南 新鄉453100;2南昌市第二醫院神經外科,3南昌大學第二附屬醫院神經外科, 江西 南昌 330006)
目的: 研究下調著絲粒蛋白W(centromere protein W,CENP-W)的表達水平對人腦膠質瘤U87細胞的影響。 方法:采用小干擾RNA(small interfering RNA,siRNA)抑制人腦膠質瘤U87細胞CENP-W的表達,采用RT-qPCR和Western blot法評價siRNA的干擾效果,采用MTT法、BrdU實驗和平板集落形成實驗測定細胞的增殖,Transwell小室檢測細胞侵襲力的變化,劃痕實驗檢測細胞遷移能力的變化,流式細胞術檢測細胞周期及細胞凋亡的改變。 結果:MTT實驗、平板集落形成實驗和BrdU實驗顯示轉染siRNA的實驗組U87細胞的增殖能力、集落形成能力較空白對照組及陰性對照組明顯降低;Transwell實驗和劃痕實驗顯示實驗組細胞的遷移、侵襲能力較空白對照組及陰性對照組明顯減弱;流式細胞術分析表明實驗組細胞的細胞周期被阻滯在G0/G1期;實驗組細胞凋亡比例較對照組增多(P<0.05)。 結論:下調CENP-W的表達可抑制人腦膠質瘤細胞的增殖、遷移和侵襲能力并促進細胞的凋亡,提示CENP-W有望成為人腦膠質瘤基因治療的候選靶點。
著絲粒蛋白W; 小干擾RNA; 細胞增殖; 細胞侵襲
腦膠質瘤是一種源自神經膠質細胞而主要發生在人大腦中的腫瘤[1]。腦膠質瘤具有無控性增殖、侵襲性生長、易復發的特點[2-3]。目前研究表明,腫瘤的發生發展與多種致癌基因過度表達及抑癌基因的失活密切相關[4]。因此尋找具有抑制膠質瘤細胞惡性表型的相關基因,深入揭示其作用機制,對膠質瘤的治療具有重要意義。
著絲粒蛋白W(centromere protein W,CENP-W)作為一個新發現的蛋白,主要分布于細胞核中,在哺乳動物細胞著絲粒中,CENP-W參與DNA結合復合物的形成,在維持細胞正常有絲分裂雙極紡錘體的形成過程中具有重要作用。目前國內外對于CENP-W與膠質瘤的相關研究較少。本研究采用小干擾RNA(small interfering RNA,siRNA)下調CENP-W的表達,觀察CENP-W對腦膠質瘤U87細胞的增殖、凋亡和侵襲等生物學表型的影響,期望為腦膠質瘤的治療提供新的治療靶點。
材 料 和 方 法
1 主要材料和試劑
人腦膠質瘤細胞株U87細胞購于南昌長城生物試劑中心;轉染試劑Lipofectamine 2000和RNA抽提試劑TRIzol購自Invitrogen;cDNA逆轉錄試劑盒和RT-qPCR試劑盒購自TaKaRa;BCA蛋白質定量試劑盒和細胞總蛋白抽提試劑盒購自Abcam;兔抗人CENP-W多克隆抗體購自RayBiotech,鼠抗人β-actin 抗體購自北京長城生物產業責任有限公司;細胞培養所用的DMEM購自Gibco;Transwell板購自Corning;針對CENP-W基因序列的特異性siRNA以及CENP-W 和β-actin的PCR引物均由Invitrogen設計并合成。FACSCalibur流式細胞儀為BD產品。
2 主要方法
2.1 細胞培養及siRNA 轉染 細胞培養于含10%滅活的新生小牛血清、100 mg/L鏈霉素和1×105U/L青霉素的DMEM培養液中,在37 ℃、5% CO2和95%濕度的條件下培養。細胞種植于6孔板,培養至60%~80%融合時進行轉染,轉染方法參照LipofectamineTM2000說明書進行。siRNA轉染實驗分3組:未轉染對照組、轉染陰性對照組和轉染siRNA實驗組。CENP-W siRNA的序列為5’- GCAGAAGAG-TCCAGGACAA-3’,陰性對照序列為5’-GCATGGAGAGAGCAACCAA-3’。轉染后6 h,將細胞置于熒光顯微鏡下觀察,細胞內可見點狀熒光,若熒光細胞比例占50%以上則判斷為轉染成功。無血清培養基稀釋Lipofectamine 2000 轉染試劑,輕輕混勻,5 min后輕輕混勻稀釋的siRNA寡核苷酸和Lipofectamine 2000稀釋液,室溫放置20 min,使之充分結合,加入細胞中,輕輕混勻。37 ℃、5% CO2溫箱中孵育6 h,加入與每孔中液體等體積的含20%胎牛血清的培養基,12 h后更換含10%胎牛血清的培養基,繼續培養24 h后采用下述方法進行相關檢測。
2.2 RT-qPCR檢測轉染后U87細胞中CENP-W的mRNA表達 提取細胞總RNA,用TaKaRa的逆轉錄試劑盒合成cDNA。以RT-qPCR檢測各組CENP-W mRNA的表達量。總反應體系20 μL,其中SYBR Premix Ex Taq 10 μL,上、下游引物各0.5 μL(2.5 μmol/L),cDNA模板1 μL,RNase-free H2O加至20 μL。反應條件為95 ℃ 2 min;95 ℃ 30 s, 58.8 ℃ 30 s, 72 ℃ 30 s,共40個循環;72 ℃ 5 min。CENP-W的上游引物為5’-AGTGGTGACTTATTGGTCCATCTG-3’,下游引物為5’-AAGCGTTTGTCCTGGACTCTTC-3’。整個反應過程中熒光信號的變化由qPCR儀監測。反應結束后,電腦自動分析并顯示計算結果,2-ΔΔCt為CENP-W的 mRNA相對表達量。
2.3 Western blot法檢測轉染后U87細胞中CENP-W蛋白的表達 用細胞裂解液裂解細胞,離心15 min取上清液,進行聚丙烯酰胺凝膠電泳,電泳結束后將蛋白膠條轉移至PVDF膜,TBST洗膜后加入5%脫脂奶粉封閉液中37 ℃封閉2 h,TBST洗膜3次,加Ⅰ抗4 ℃過夜孵育。TBST 漂洗后,加入辣根過氧化物酶標記的山羊抗兔和山羊抗鼠Ⅱ抗(工作液稀釋比例均為1∶5 000),室溫孵育1 h,TBST洗膜3次,置增強化學發光試劑ECL底物中反應5 min,暗室曝光顯示特異的蛋白信號,依據ECL化學發光試劑盒操作說明進行顯影、定影。利用凝膠圖像分析系統對膠片進行灰度掃描和凈光密度值分析。
2.4 MTT法檢測siRNA轉染對細胞活力的影響 U87細胞轉染后1 d,按每孔100 μL細胞懸液接種于96孔培養板內,每組設5個復孔。siRNA轉染U87細胞株12 h、24 h、48 h和72 h,每孔加入5 g/L的MTT溶液20 μL,室溫下再培養4 h后,吸棄孔內培養液,每孔加150 μL DMSO,紫外分光光度計570 nm波長測各孔吸光度值。
2.5 BrdU實驗檢測U87細胞增殖活性 轉染后24 h的細胞按2×104細胞接種于6孔板,培養24 h后,加入10 μmol/L的BrdU,繼續培養24 h,吸除細胞培養液,用PBS 洗滌2 次,40 g/L多聚甲醛固定30 min,PBS沖洗3次,2 mol/L鹽酸作用40 min,血清封閉后加入抗BrdU 抗體,4 ℃過夜,室溫復溫后加入羅丹明標記的熒光Ⅱ抗,DAPI復染后,任取5個視野計數BrdU陽性細胞數量,并進行統計學分析。
2.6 Transwell實驗檢測轉染后U87細胞侵襲能力的變化 轉染48 h后在Transwell上室中加入1∶2(基質膠∶DMEM)稀釋后的基質膠60 μL,37 ℃ 30 min使其聚合成凝膠。在下室中加入細胞條件培養液600 μL。待檢細胞用無血清培養基制成單細胞懸液,上室中加入1×105個細胞,24 h后棄上室液體,擦去Transwell小室上室面未穿過膜的細胞,甲醇固定30 min風干后用0.1 %的結晶紫染色20 min。200倍下計數上、中、下、左、右5個視野中黏附細胞數,計算平均值,每組設4個復孔,以上所有實驗均重復3次。
2.7 劃痕實驗檢測細胞遷移能力 用標記筆在6孔板背面均勻劃橫線,兩兩相隔0.6 cm左右,每孔穿過5~6條橫線。在6孔板的每個孔中加入約3×105個細胞。次日用細胞刮劃痕,劃痕和背面的橫線相互垂直,清理掉劃痕時劃下的細胞,添加純培養基置溫箱培養。按0 h、6 h、12 h、24 h取樣測距,觀察時間不要超過1個細胞周期,可避免假陽性結果。
2.8 平板集落形成實驗檢測CENP-W對細胞增殖能力的作用 取轉染48 h后處于對數期的細胞,消化成單細胞懸液,按設計好的梯度稀釋,接種于6孔板中。置細胞培養箱中培養2周左右,細胞培養過程中,細心觀察,當6孔板中出現可見的克隆時,培養即可終止。PBS液清洗后用多聚甲醛固定細胞,清除固定液,加一定量的GIMSA染色液染色20 min,洗去染色液,晾干,觀察計數細胞的克隆情況,以大于30個細胞作為一個成功的克隆。
2.9 流式細胞術檢測細胞周期 U87細胞接種于6孔培養板,每組設3個復孔。siRNA轉染U87細胞2 d后收集細胞,PBS洗滌細胞3次,加入預冷75%乙醇固定,4 ℃過夜。每孔加入100 mg/L的RNase 10 μL及50 mg/L的碘化丙啶緩沖液300 μL,4 ℃避光30 min,使用FACS Calibur流式細胞儀檢測。
2.10 細胞凋亡的檢測 siRNA轉染細胞,待細胞密度為70~80%時將細胞消化成單細胞懸液,調整細胞濃度為1×109/L。取0.5 mL細胞懸液,1 000 r/min離心4 min,棄上清,加0.5 mL binding buffer 重懸細胞,加入1 μL熒光標記的Annexin V試劑,混勻后避光室溫下孵育20 min,加入5 μL PI,混勻后避光4 ℃下孵育5 min,加入0.5 mL binding buffer,行流式細胞術分析。
3 統計學處理
所有實驗數據均經SPSS 20.0統計軟件分析。計量資料以均數±標準差(mean±SD)表示,比較采用單因素方差分析。進一步兩兩比較采用SNK-q檢驗,百分數的比較采用2檢驗。以P<0.05為差異有統計學意義。
結 果
1 用Lipofectamine 2000對人腦膠質瘤U87細胞進行CENP-W siRNA轉染
CENP-W siRNA轉染人腦膠質瘤U87細胞6 h后,在熒光顯微鏡下觀察轉染效率,可見絕大多數細胞都熒光著色,被轉染細胞有明顯的細胞輪廓,見圖1。

Figure 1.The green fluorescence in the U87 cells transfeced with CENP-W siRNA after 6 h (×100).
圖1 人腦膠質瘤U87細胞轉染6 h后熒光表達的改變
2 RT-qPCR檢測轉染后U87細胞CENP-W的mRNA表達
RT-qPCR檢測結果顯示空白對照組(blank組)、陰性對照組(NC siRNA組)和轉染組(CENP-W si-RNA組)的值分別為1.04±0.16、1.12±0.12和0.42±0.07,與空白對照組和陰性對照組比較,CENP-W siRNA組細胞CENP-W的mRNA表達降低,差異有統計學顯著性(P<0.05);空白對照組與陰性對照組相比差異無統計學顯著性,見圖2。
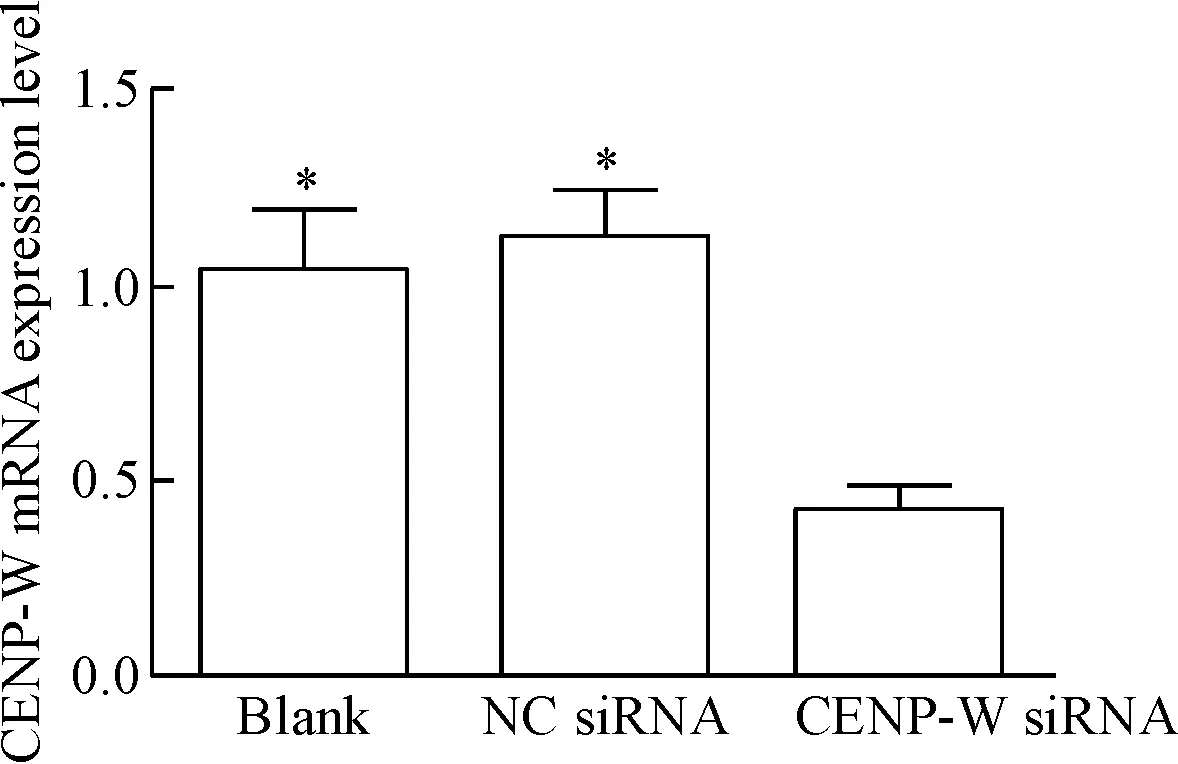
Figure 2.The mRNA expression levels of CENP-W in the U87 cells after transfection with CENP-W siRNA detected by RT-qPCR. Mean±SD.n=3.*P<0.05vsCENP-W siRNA.
圖2 CENP-W siRNA 轉染U87細胞對CENP-W mRNA表達的影響
3 Western blot檢測轉染后U87細胞CENP-W蛋白的表達
Western blot檢測結果顯示空白對照組、陰性對照組和CENP-W siRNA轉染組的CENP-W蛋白相對表達量分別為0.96±014、1.12±0.19和0.27±0.08,與空白對照組和陰性對照組比較,CENP-W siRNA組細胞的CENP-W蛋白的表達降低,差異有統計學顯著性(P<0.05),空白對照組與陰性對照組相比差異無統計學顯著性,見圖3。
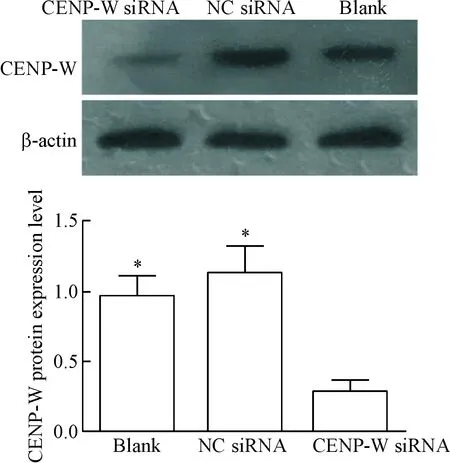
Figure 3.The protein levels of CENP-W in the U87 cells after transfection with CENP-W siRNA detected by Western blot. Mean±SD.n=3.*P<0.05vsCENP-W siRNA.
圖3 CENP-W siRNA轉染U87細胞對CENP-W蛋白表達的影響
4 MTT法檢測細胞活力的變化
與空白對照組及陰性對照組比較,轉染后24 h,轉染CENP-W siRNA組U87細胞的細胞活力明顯減弱(P<0.05),空白對照組與陰性對照組相比差異無統計學顯著性,見圖4。
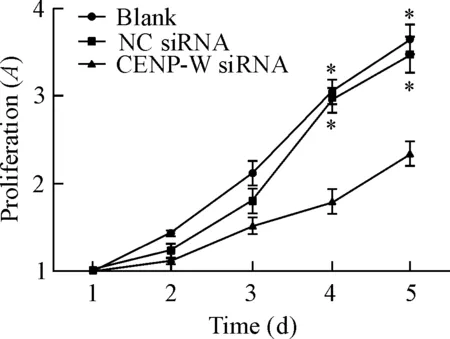
Figure 4.The viability of the U87 cells after transfection with CENP-W siRNA determined by MTT assay. Mean±SD.n=3.*P<0.05vsCENP-W siRNA.
圖4 MTT檢測轉染后不同時間U87細胞的活力
5 BrdU實驗檢測細胞增殖能力
與空白對照組及陰性對照組比較,轉染后24 h,轉染CENP-W siRNA組U87細胞的增殖能力明顯減弱(P<0.05),空白對照組與陰性對照組相比差異無統計學顯著性,見圖5。
6 Transwell實驗檢測細胞侵襲能力
與空白對照組及陰性對照組相比較,CENP-W siRNA組穿膜細胞數明顯減少,差異具有統計學顯著性(P<0.05),空白對照組與陰性對照組相比差異無統計學顯著性,見圖6。
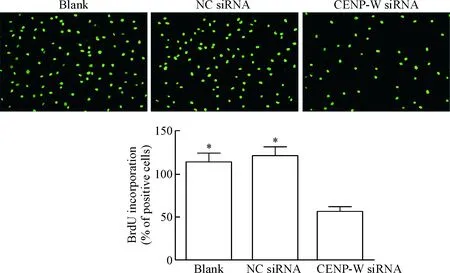
Figure 5.The proliferation ability of the U87 cells after transfection of CENP-W siRNA detected by BrdU incorporation (×200). Mean±SD.n=3.*P<0.05vsCENP-W siRNA.
圖5 BrdU實驗檢測轉染后U87細胞的增殖能力
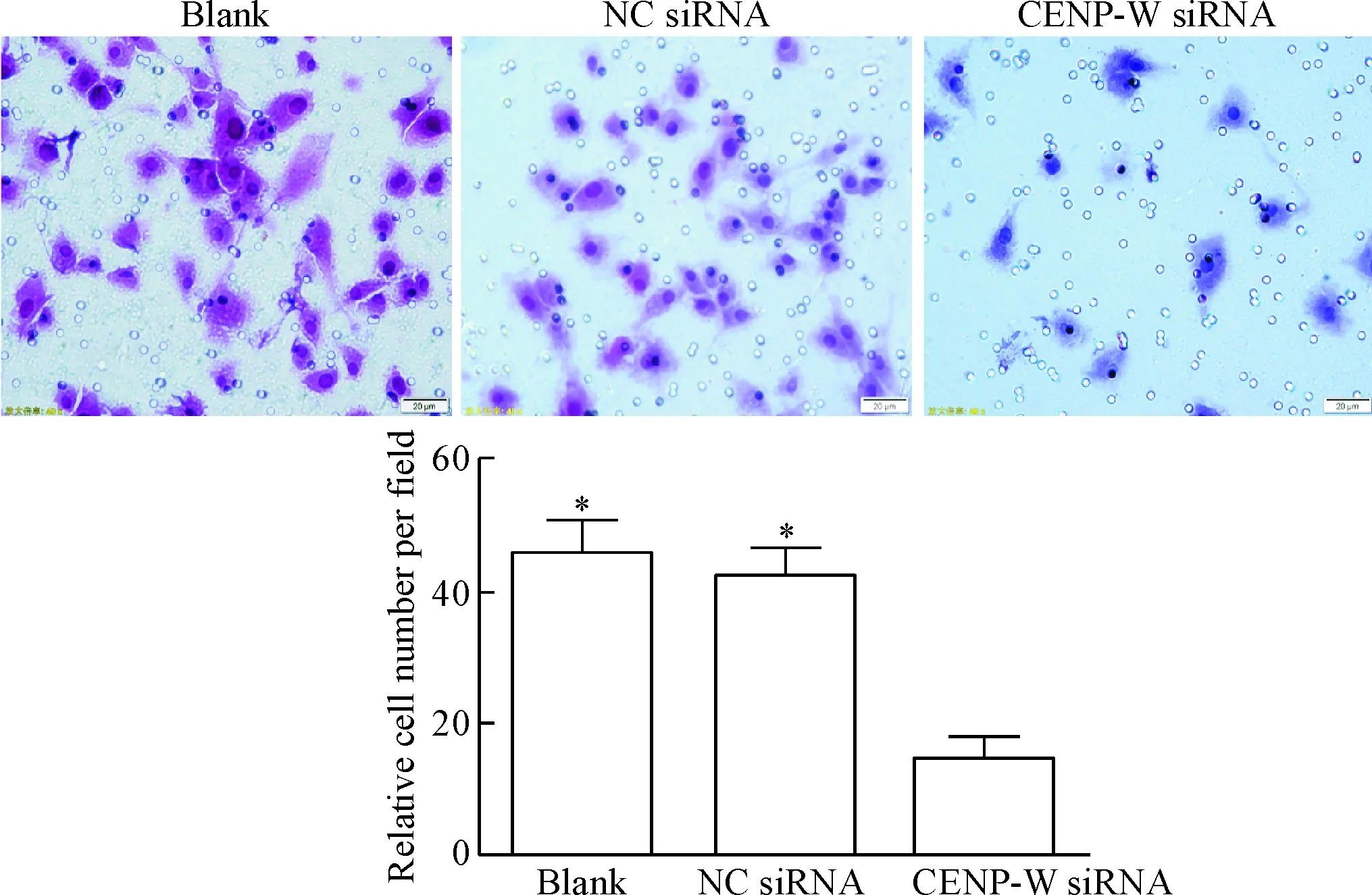
Figure 6.The effects of CENP-W siRNA transfection on the invasion ability of the U87 cells (×400). Mean±SD.n=3.*P<0.05vsCENP-W siRNA.
圖6 轉染CENP-W siRNA對U87細胞侵襲能力的影響
7 劃痕實驗檢測細胞遷移能力
劃痕后即可在倒置光學顯微鏡下觀察劃痕的寬度,結果如圖7所示。劃痕后24 h,精確記錄劃痕寬度。結果提示,U87細胞在劃痕后24 h的測距寬度為0.71±0.06。同一時點空白組和陰性對照組的測距寬度分別是0.38±0.04和0.41±0.06。結果說明實驗組的劃痕寬度愈合速度明顯減慢,與空白組和陰性對照組差異具有統計學意義(P<0.05),而空白組和陰性對照組的劃痕寬度相差不明顯,差異無統計學顯著性。
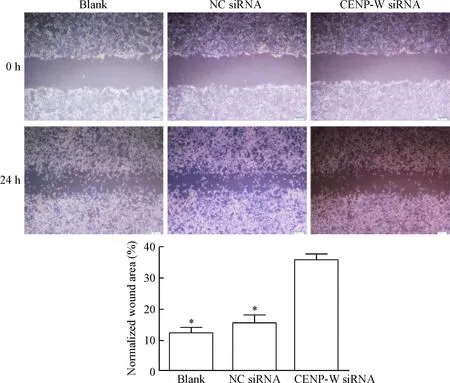
Figure 7.The migration capability of U87 cells after transfection of CENP-W siRNA analyzed by wound healing assay (×50). Mean±SD.n=3.*P<0.05vsCENP-W siRNA.
圖7 細胞劃痕實驗檢測CENP-W對細胞遷移能力的作用
8 平板集落形成實驗檢測細胞增殖能力
與空白對照組及陰性對照組比較,轉染CENP-W siRNA組U87細胞的集落形成能力明顯減弱(P<0.05),空白組與陰性組相比差異無統計學顯著性,見圖8。
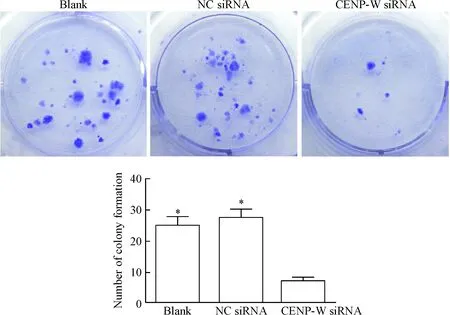
Figure 8.The cell proliferation ability of U87 cells after transfection of CENP-W siRNA analyzed by colony formation experiments. Mean±SD.n=3.*P<0.05vsCENP-W siRNA.
圖8 平板克隆實驗檢測CENP-W對細胞增殖能力的作用
9 流式細胞術分析細胞周期的變化
空白對照組細胞G0/G1、S和G2/M期分別占41.36%、32.14%和26.50%,陰性對照組細胞的G0/G1、S和G2/M期分別占45.94%、29.65%和24.41%,CENP-W siRNA組細胞的G0/G1、S和G2/M期分別占68.35%、18.46%和13.19%。與空白對照組和陰性對照組比較,CENP-W siRNA組的G0/G1期細胞比例增高,差異有統計學顯著性(P<0.05),空白對照組與陰性對照組相比差異無統計學顯著性,見圖9。
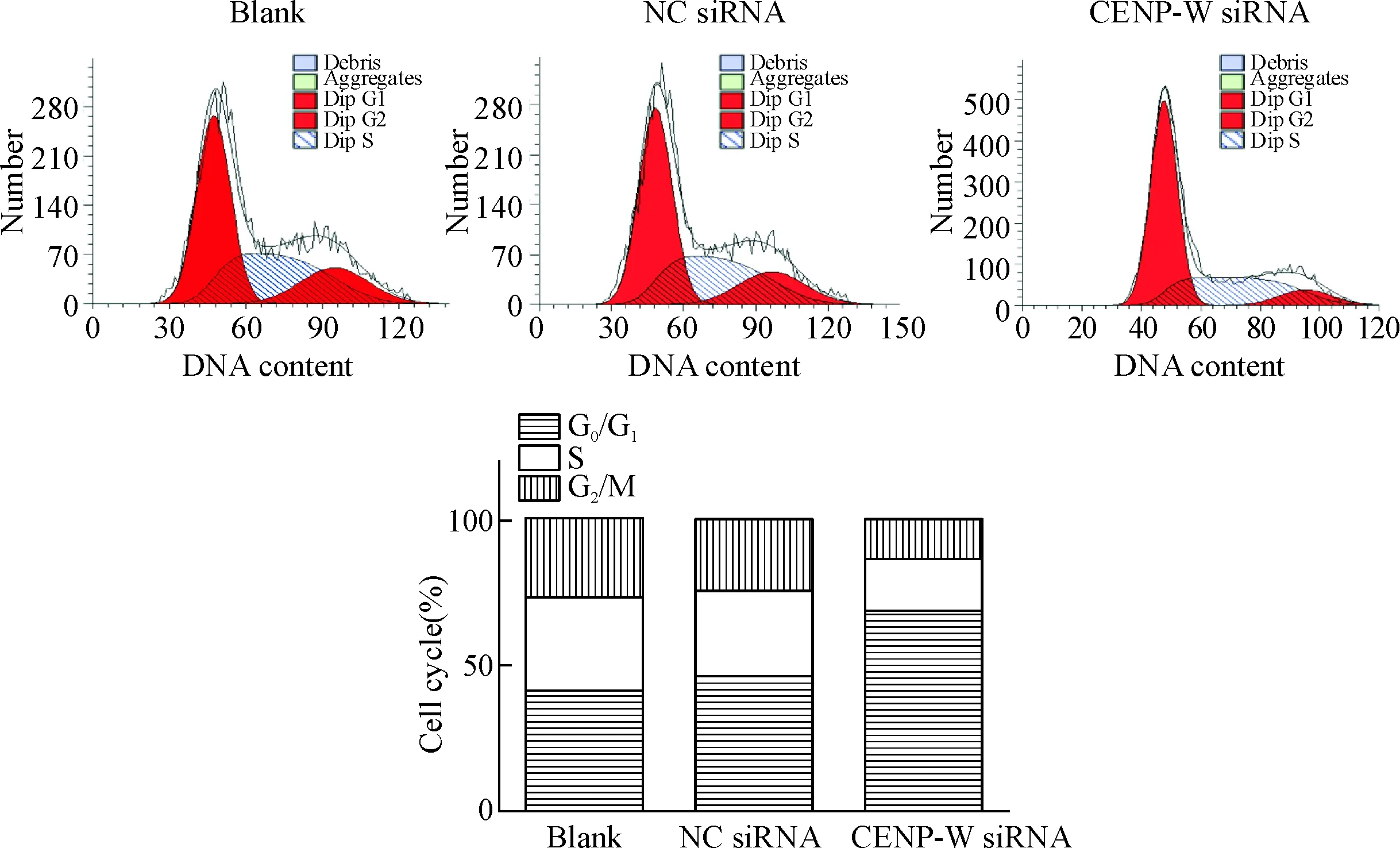
Figure 9.The cell cycle distribution of the U87 cells after transfection with CENP-W siRNA analyzed by flow cytometry. Mean±SD.n=3.
圖9 流式細胞術檢測轉染CENP-W siRNA后各組U87細胞周期的分布
10 流式細胞術分析細胞凋亡
利用流式細胞儀檢測轉染4 d后各組細胞的凋亡率,空白對照組的凋亡率為(6.52±1.69)%,陰性對照組的凋亡率為(7.09±1.98)%,CENP-W siRNA組的凋亡率為(12.43±2.79)%。CENP-W siRNA組的細胞凋亡率明顯升高,與對照組相比,差異有統計學顯著性(P<0.05),空白對照組與陰性對照組相比差異無統計學顯著性,見圖10。
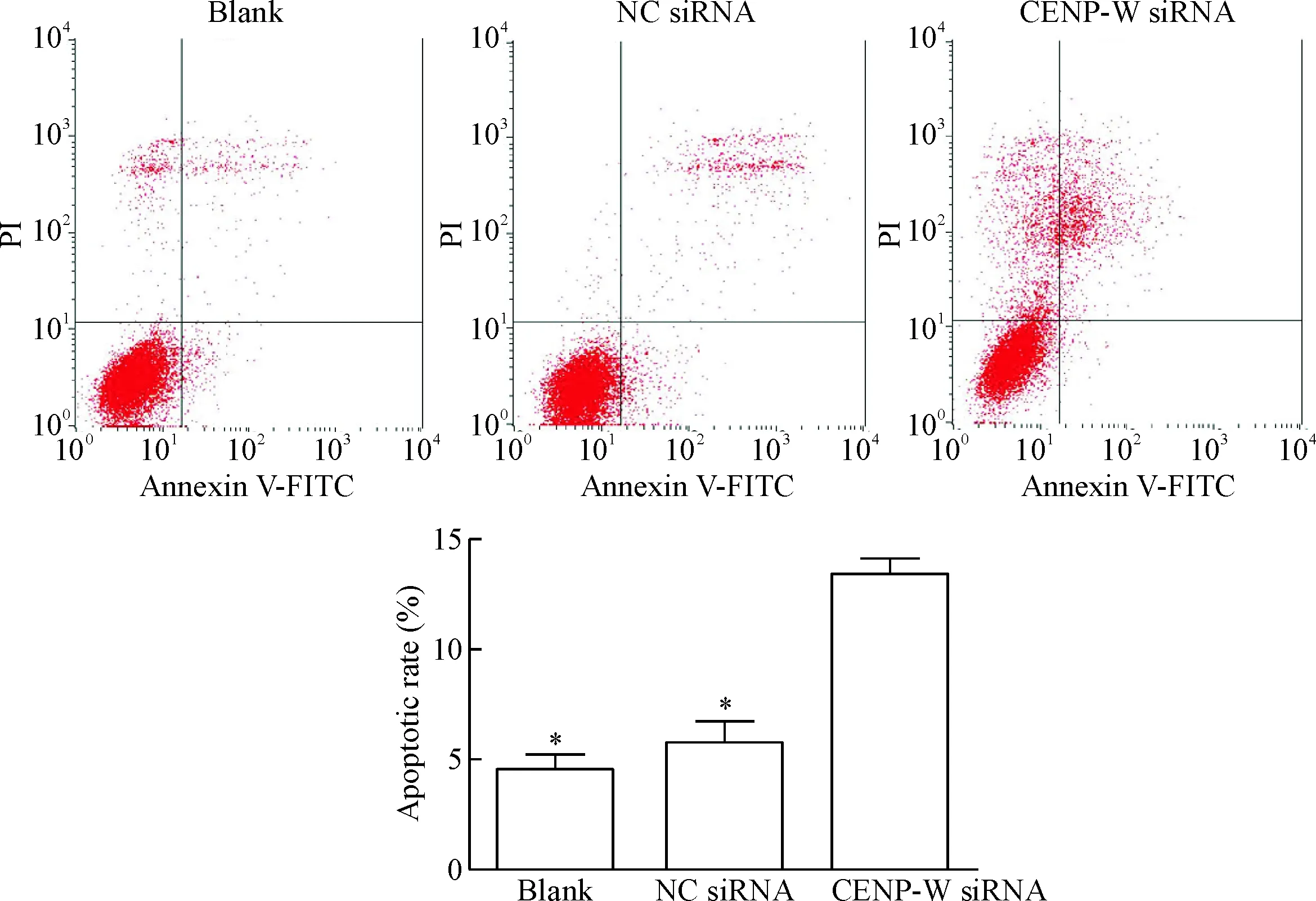
Figure 10.The apoptotic rate of the U87 cells after transfection of CENP-W siRNA analyzed by flow cytometry. Mean±SD.n=3.*P<0.05vsCENP-W siRNA.
圖10 流式細胞術檢測轉染CENP-W siRNA后各組U87細胞凋亡的比率
討 論
腦膠質瘤特別是腦膠質母細胞瘤的預后極差,是中樞神經系統常見的高度血管化的惡性腫瘤之一,患者中位生存期不超過12個月。傳統治療方法(包括手術、化療和放療)并沒有完全解決膠質瘤侵襲性生長所導致的高復發率和低治愈率難題。針對與膠質瘤發生、發展相關的基因異常的治療已成為研究熱點[4]。
CENP-W主要分布于細胞核中,許多研究表明CENP-W在細胞有絲分裂過程中扮演關鍵作用[5-8]。阻斷CENP-W可在哺乳動物細胞有絲分裂過程中觀察到多極紡錘體和染色體錯位等異常染色體結構的出現,并誘導異常的有絲分裂來影響細胞的活性[9]。另外還有研究表明[10]CENP-W在細胞間期與核仁緊密聯系同時調節核仁與著絲粒蛋白前體之間的聯系,Hori等[5]研究表明CENP-W與CENP-T直接與核仁中的DNA及H3組蛋白連接。同時,CENP-W對于惡性腫瘤的生物學特性亦有著重要的調控作用。研究表明,CENP-W廣泛高表達于卵巢、肝臟、肺、結腸、胃、胰腺等多種癌癥組織中,并因此將其命名為腫瘤上調蛋白CUG2[11-12]。而在鼠成纖維細胞NIH3T3的實驗研究中顯示,CENP-W的過表達使NIH3T3細胞表現出腫瘤細胞的特性,并移植到裸鼠皮下后形成腫瘤,表現出CENP-W的顯著致癌活性。作為著絲粒結構的組成部分,CENP-W的表達異常會干擾有絲分裂的正常進行,而影響染色體DNA的正確分離,進而導致細胞內染色體異常。而這種染色體異常既可以易化腫瘤的形成,也可以引起細胞的凋亡,取決于其所處細胞環境及下游信號通路的反應結果。
綜上所述,CENP-W對腫瘤的發生發展有重要的作用。最新研究報道,發現CENP-W在腦膠質瘤組織中表達上調,且與RAS的表達水平呈明顯正相關,且CENP-W在腦膠質瘤中可調節RAS表達水平,表明CENP-W可能調控RAS信號通路影響腦膠質瘤的發生發展[13]。我們前期研究發現,CENP-W與腦膠質瘤的預后密切相關[14]。故我們研究CENP-W對腦膠質瘤U87細胞的增殖、侵襲、遷移、凋亡等惡性生物學表型的作用,進一步明確CENP-W對腦膠質瘤細胞的關系及作用機制。
將CENP-W siRNA轉染入腦膠質瘤U87細胞中,經RT-qPCR和Western blot法證實細胞中的CENP-W的mRNA及蛋白表達水平明顯受到抑制,表明轉染成功。行Transwell實驗和劃痕實驗顯示實驗組腦膠質瘤U87細胞的侵襲、遷移能力較對照組明顯受抑制;行平板集落形成實驗發現CENP-W siRNA組U87腦膠質瘤細胞的集落形成能力明顯減弱;行MTT實驗、BrdU實驗顯示轉染CENP-W siRNA的U87細胞的增殖能力較對照組明顯降低;通過流式細胞儀對細胞周期和凋亡情況的分析,抑制CENP-W的表達水平, G0/G1期的U87細胞數明顯增加,細胞增殖受限,表明CENP-W表達下降可以影響骨肉瘤細胞周期,而同時細胞凋亡數目明顯增多,凋亡率增高。綜上研究結果表明,抑制CENP-W的表達水平能夠有效抑制腦膠質瘤U87細胞的增殖與侵襲能力。
作為一種潛在的致癌蛋白,CENP-W對膠質瘤發生發展可能具有重要的影響。本研究首次探索了CENP-W對人腦膠質瘤U87細胞生物學行為的影響,通過多種實驗方法最終證實下調CENP-W的表達可抑制人腦膠質瘤U87細胞的增殖、遷移和侵襲能力并促進細胞的凋亡,提示CENP-W有望成為人腦膠質瘤基因治療的候選靶點,其具體的作用機制及靶點有待進一步研究。
[1] 李若彤, 王 麗, 曹 亭, 等. Perifosine通過抑制PI3K/Akt途徑調節人膠質瘤U251細胞增殖、凋亡與自噬[J]. 中國病理生理雜志, 2016, 32(4):644-650.
[2] Alves TR, Lima FR, Kahn SA, et al. Glioblastoma cells: a heterogeneous and fatal tumor interacting with the parenchyma[J]. Life Sci, 2011, 89(15-16):532-539.
[3] Norden AD, Drappatz J, Wen PY. Antiangiogenic therapies for high-grade glioma[J]. Nat Rev Neurol, 2009, 5(11):610-620.
[4] 范陽華, 祝新根, 呂世剛, 等. 慢病毒介導的RWDD3沉默對人膠質瘤U251細胞增殖和侵襲的影響[J]. 中國病理生理雜志, 2015, 31(9):1550-1556.
[5] Hori T, Amano M, Suzuki A, et al. CCAN makes multiple contacts with centromeric DNA to provide distinct pathways to the outer kinetochore[J]. Cell, 2008, 135(6):1039-1052.
[6] Kim H, Lee M, Lee S, et al. Cancer-upregulated gene 2 (CUG2), a new component of centromere complex, is required for kinetochore function[J]. Mol Cells, 2009, 27(6):697-701.
[7] Przewloka MR, Glover DM. The kinetochore and the centromere: a working long distance relationship[J]. Annu Rev Genet, 2009, 43:439-465.
[8] Prendergast L, van Vuuren C, Kaczmarczyk A, et al. Premitotic assembly of human CENPs -T and -W switches centromeric chromatin to a mitotic state[J]. PLoS Biol, 2011, 9(6):e1001082.
[9] Kim HT, So JH, Jung SH, et al. Cug2 is essential for normal mitotic control and CNS development in zebrafish[J]. BMC Dev Biol, 2011, 11:49.
[10]Chun Y, Lee M, Park B, et al. CSN5/JAB1 interacts with the centromeric components CENP-T and CENP-W and regulates their proteasome-mediated degradation[J]. J Biol Chem, 2013, 288(38):27208-27219.
[11]Lee S, Gang J, Jeon SB, et al. Molecular cloning and functional analysis of a novel oncogene, cancer-upregula-ted gene 2 (CUG2)[J]. Biochem Biophys Res Commun, 2007, 360(3):633-639.
[12]Chun Y, Park B, Koh W, et al. New centromeric component CENP-W is an RNA-associated nuclear matrix protein that interacts with nucleophosmin/B23 protein[J]. J Biol Chem, 2011, 286(49):42758-42769.
[13]范陽華, 吳淼經, 呂世剛, 等. 人腦膠質瘤中CENP-W/B23調控Ras信號通路的相關性[J]. 中山大學學報:醫學科學版, 2015, 36(5):663-669.
[14]吳淼經, 汲乾坤, 范陽華, 等. 著絲粒蛋白W在腦膠質瘤中的表達及其對侵襲的作用[J]. 西安交通大學學報:醫學版, 2016, 37(3):388-392.
(責任編輯: 林白霜, 羅 森)
Effects of CENP-W down-regulation on human glioma U87 cells
JI Qian-kun1, LI Jian-bin2, FAN Yang-hua3, XU Bin3, CHAI Yi3, JI Chen-xing3, ZHU Xin-gen3
(1DepartmentofNeurosurgery,TheFirstAffiliatedHospitalofXinxiangMedicalCollege,Xinxiang453100,China;2DepartmentofNeurosurgery,TheSecondHospitalofNanchangCity,3DepartmentofNeurosurgery,TheSecondAffiliatedHospitalofNanchangUniversity,Nanchang330006,China.E-mail:zxg2008vip@163.com)
AIM: To study the effect of centromere protein W (CENP-W) down-regulation on human glioma U87 cells. METHODS: Small interfering RNA (siRNA) was used to inhibit the expression of CENP-W in the U87 cells. The interference effect of siRNA was evaluated by RT-qPCR and Western blot. The proliferation of the cells was analyzed by MTT assay, BrdU staining and colony formation experiment. Transwell chamber assay was used to detect the invasion ability of the cells. The cell migration ability was measured by a scratch test. The changes of the cell cycle distribution and apoptosis were analyzed by flow cytometry. RESULTS: The results of MTT assay, colony formation experiment and BrdU staining showed that the cell proliferation and colony formation abilities in experimental group were significantly lower than those in control group and negative control group. The results of Transwell and scratch experiments showed that the migration and invasion abilities in experimental group were weaker than those in blank control group and negative control group. The results of flow cytometry analysis showed that the cell cycle distribution in experimental group was arrested in G0/G1phase. The percentage of apoptotic cells in experimental group was higher than that in control group (P<0.05). CONCLUSION: Down-regulation of CENP-W expression inhibits the proliferation, migration and invasion of human glioma cells and promotes the apoptosis of the cells, suggesting that CENP-W may be a potential target of gene therapy for human glioma.
Centromere protein W; Small interfering RNA; Cell proliferation; Cell invasion
1000- 4718(2017)02- 0263- 08
2016- 08- 31
2016- 11- 14
江西省優勢科技創新團隊建設計劃(No. 20152BCB24009);江西省對外科技合作計劃(No. 20151BDH80009)
R739.41
A
10.3969/j.issn.1000- 4718.2017.02.012
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 0791-86311396; E-mail: zxg2008vip@163.com

