奧沙利鉑對結腸癌細胞DNA損傷修復類抗藥基因表達的影響
房 曉, 尹 華, 胡騰惠, 金世光, 王大新
(1. 揚州大學醫學院, 江蘇 揚州, 225001; 2. 揚州大學臨床醫學院, 江蘇 揚州, 225001)
論 著
奧沙利鉑對結腸癌細胞DNA損傷修復類抗藥基因表達的影響
房 曉1, 尹 華1, 胡騰惠2, 金世光2, 王大新2
(1. 揚州大學醫學院, 江蘇 揚州, 225001; 2. 揚州大學臨床醫學院, 江蘇 揚州, 225001)
目的 觀察奧利沙鉑對結腸癌細胞DNA損傷修復類基因表達的影響。方法 采用奧利沙鉑處理結腸癌細胞株HCT116 48 h。以Western blot免疫印跡法檢測奧利沙鉑誘導的DNA損傷。采用CCK-8方法探討奧利沙鉑對HCT116細胞生長的影響。采用實時熒光定量PCR(qRT-PCR)方法檢測奧利沙鉑處理后相關DNA損傷修復基因的表達。結果 奧利沙鉑處理后, HCT116細胞中DNA損傷標志基因γ-H2AX表達明顯上升。DNA損傷切除修復相關基因XPC表達在奧利沙鉑處理后出現顯著上升,其他DNA損傷修復基因mRNA表達無明顯上調。結論 XPC基因可能在臨床應用奧沙利鉑治療結腸癌時腫瘤細胞產生抗藥性的過程中起到了關鍵作用。
奧沙利鉑; 結腸癌細胞; DNA損傷修復; 抗藥性
奧沙利鉑是臨床上常用的DNA損傷類化療藥物, 對結腸癌有著較好療效[1-2]。DNA損傷類化療藥物通過誘導DNA損傷以促進腫瘤細胞凋亡,抑制腫瘤細胞生長,是腫瘤化療藥物的一大重要組成,然而其局限性在于用藥過程中腫瘤細胞抗藥性的產生[3]。腫瘤細胞中DNA修復相關蛋白的表達上調加快了細胞內DNA損傷的修復,從而導致了細胞對DNA損傷類化療藥物如奧沙利鉑等的抗藥性[4]。本研究觀察奧沙利鉑作用結腸癌細胞后對DNA損傷修復類相關基因表達的影響,現報告如下。
1 材料與方法
1.1 試劑、細胞系與儀器設備
奧沙利鉑(純度>98%)購自美國Sigma-Aldrich公司; 人結腸癌細胞系HCT116由北京蛋白質組研究中心惠贈; DMEM細胞培養基(Gibco, 美國); 小牛血清(四季青,中國); 青霉素/鏈霉素雙抗溶液(Gibco, 美國); CCK-8細胞增殖活性檢測試劑盒(Vazyme, 中國); γ-H2AX(Ser139)抗體(Millipore, 美國); GAPDH抗體(Vazyme, 中國); 辣根過氧化酶標記羊抗小鼠二抗(Biorad, 美國); ECL試劑盒(Thermo, 美國); Trizol RNA提取試劑(Invitrogen, 美國); 反轉錄試劑盒(Thermo, 美國); SYBR Green熒光定量PCR試劑盒(Vazyme, 中國); 細胞培養箱(Thermo, 美國); 引物合成(Invitrogen, 美國); Tecan M2000酶標儀(Tecan, 美國); Bio-Rad Chemi Doc XRS化學發光凝膠成像儀(Bio-Rad, 美國); ABI StepOne Plus實時熒光定量PCR儀 (ABI, 美國)。
1.2 實驗方法
1.2.1 結腸癌細胞培養條件與藥物處理: 結腸癌細胞HCT116培養在含15%小牛血清及1%青霉素/鏈霉素雙抗溶液的DMEM完全培養基中,培養條件為37 ℃、5% CO2。待細胞長至60%~70%匯合度,在培養基中加入5 mmol/L奧沙利鉑,處理48 h。1.2.2 CCK-8法檢測細胞活性: HCT116細胞以2×104個/孔密度接種于96孔板中,分為2組,分別加入0、5 mmol/L奧沙利鉑處理。藥物處理48 h后,每孔加入10 μL CCK-8溶液,繼續培養1.5 h后,于酶標儀450 nm波長讀數,檢測吸光度。1.2.3 Western Blot檢測細胞內DNA損傷: 收取細胞,用RIPA溶液(含蛋白酶抑制劑及磷酸酶抑制劑)裂解提取蛋白,以Bradford法進行蛋白定量,按每孔60 μg蛋白上樣進行SDS-PAGE凝膠電泳,濃縮膠濃度為5%, 分離膠濃度為12%。采用濕轉方法將蛋白轉至0.2 μmol/L硝酸纖維膜,使用含5%脫脂牛奶的TBST溶液室溫封閉1 h, 后在γ-H2AX抗體中(稀釋濃度1∶200) 4 ℃孵育過夜。二抗(1∶2 000稀釋)孵育時間為1 h, 使用伯樂XRS化學發光成像分析儀顯影成像。
1.2.4 RNA提取、反轉錄及熒光實時定量PCR檢測DNA損傷修復基因mRNA表達: 采用Trizol試劑,按說明書要求進行細胞總RNA提取,按試劑盒說明書步驟通過兩步法完成cDNA反轉錄,隨后使用SYBR Green試劑進行熒光定量PCR檢測DNA損傷相關基因的mRNA表達水平。相關引物序列來自Primer Bank數據庫[5]。熒光定量PCR擴增體系為20 μL, 擴增反應及結果分析通過Step One Plus實時熒光定量PCR系統(ABI公司,美國)進行。
1.3 統計學分析
本實驗采用SPSS 11.5軟件進行統計學分析,以Students′ t test進行實驗數據組間差異比較,檢驗水準α=0.05,P<0.05為差異有統計學意義。
2 結 果
2.1 奧沙利鉑誘導結腸癌細胞DNA損傷并抑制
其生長
為了證實奧沙利鉑對結腸癌細胞通過誘導DNA損傷而產生的生長抑制作用,在HCT116細胞的培養體系中加入了5 mmol/L奧沙利鉑孵育48 h, 通過Western Blot方法檢測細胞DNA損傷標志基因γ-H2AX的表達。結果顯示,奧沙利鉑處理后γ-H2AX水平出現顯著上調,提示奧沙利鉑對DNA損傷的誘導作用。為驗證奧沙利鉑對結腸癌細胞生長的抑制作用,以CCK-8方法檢測奧沙利鉑處理48 h后結腸癌細胞的活性。結果顯示,奧沙利鉑處理后結腸癌細胞生長活性顯著下降(39.8%,P<0.01), 提示奧沙利鉑抑制結腸癌細胞生長。見圖1。
2.2 奧沙利鉑促進DNA損傷修復基因XPC的
mRNA表達上調
為了檢測奧沙利鉑對DNA損傷修復基因表達的影響,以熒光定量PCR方法檢測奧沙利鉑處理48 h后結腸癌細胞中相關修復基因的表達。根據功能劃分, DNA損傷修復基因分為切除修復、錯配修復以及直接修復調控基因3大類[4]。 結果發現,奧沙利鉑處理后,結腸癌細胞中切除修復類基因XPC的mRNA表達出現顯著上升,與對照組相比,其mRNA表達相對豐度為2.707±0.095 (P<0.0005)。其他7個切除修復類基因中, RAD23B表達為(1.546±0.231), 呈略微上升; APEX1、UNG、XRCC1表達均未出現顯著變化, FEN1、LIG1及LIG3表達甚至呈現下降趨勢。
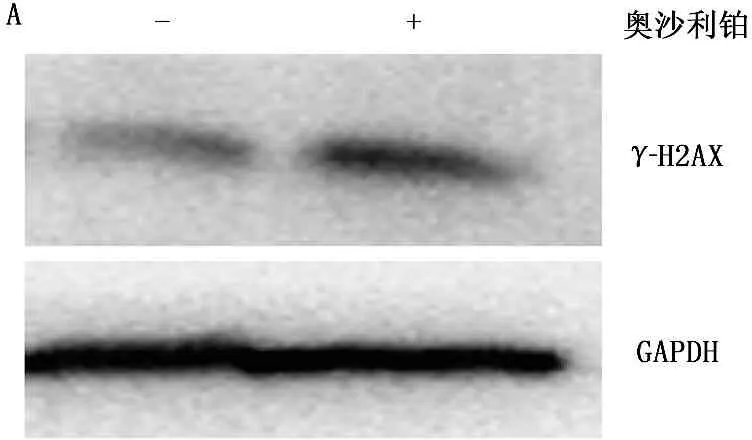
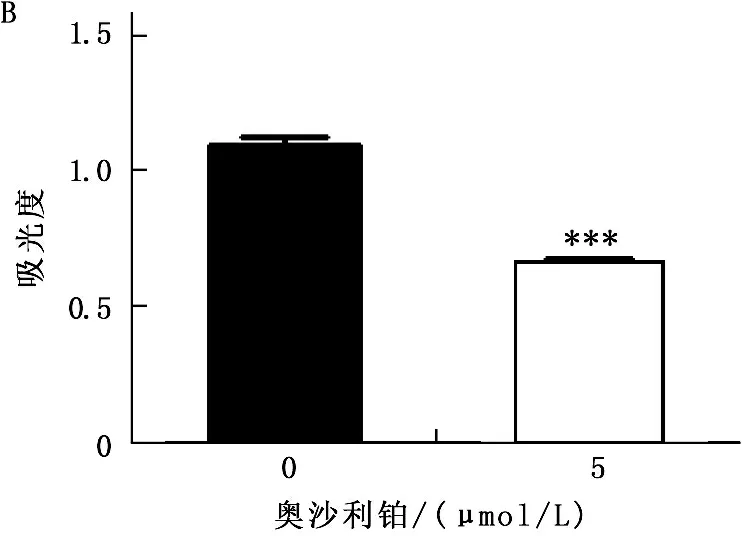
A. 奧沙利鉑(5 μmol/L)處理HCT116細胞48 h后, Western blot實驗提示DNA損傷標志蛋白γ-H2AX表達顯著上升 B. CCK-8實驗顯示HCT116細胞經5 μmol/L奧沙利鉑處理48 h后, 其生長活性顯著下降(***P<0.0001)
圖1 奧沙利鉑誘導結腸癌細胞HCT116產生DNA損傷并抑制其生長活性
奧沙利鉑處理結腸癌細胞后,錯配修復類基因中MLH1、MSH2及MSH6表達出現下降, PMS2表達沒有明顯變化; 直接修復類基因MGMT表達亦未發生明顯改變。以上結果提示XPC可能是結腸癌細胞經奧沙利鉑處理后產生抗藥性的關鍵基因。見圖2。
3 討 論
DNA是臨床抗腫瘤藥物的一個主要靶點,以誘導DNA損傷來促進腫瘤細胞凋亡為機制的鉑類化療藥物是目前最有效的臨床化療藥物之一。奧沙利鉑通過誘導DNA雙鏈交聯,阻斷DNA復制及轉錄過程,是繼順鉑后開發出來的第3代鉑類抗癌藥物[6]。因腫瘤細胞對其產生的抗藥性與順鉑等鉑類藥物相較更低,奧沙利鉑在結腸癌的臨床治療中得到了廣泛應用[6-8]。
DNA損傷類化療藥物的一大局限在于抗藥性的產生,而造成腫瘤細胞對這類藥物抗藥性的主要原因是DNA損傷反應通路異常,具體包括DNA損傷修復能力上調及DNA損傷耐受性增加2個方面[4, 9]。化療藥物對腫瘤細胞DNA造成的損傷主要通過切除修復、錯配修復以及直接修復3種方式進行。DNA損傷修復蛋白的表達上調,提高了腫瘤細胞對DNA損傷的修復能力,從而導致了其對DNA損傷類化療藥物抗藥性的產生[4, 10-11]。此外,跨損傷DNA合成機制可以利用損傷DNA鏈為模板進行DNA合成,提高了細胞對DNA損傷的耐受性,亦可使腫瘤細胞對DNA損傷類化療藥物敏感性降低[12-16]。

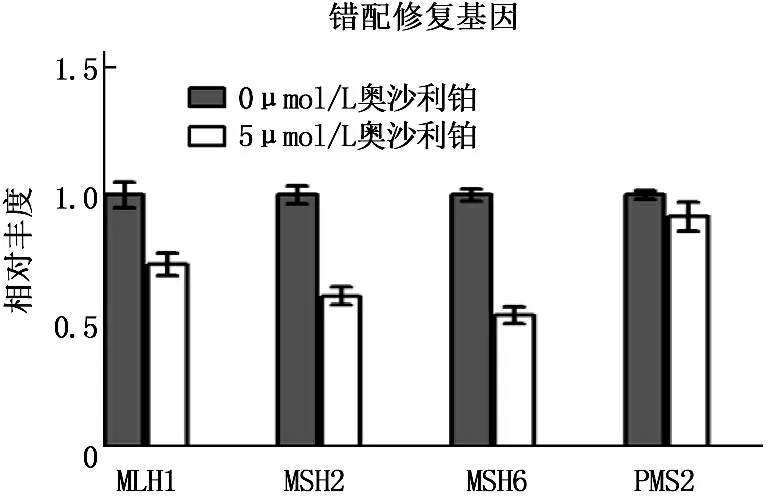
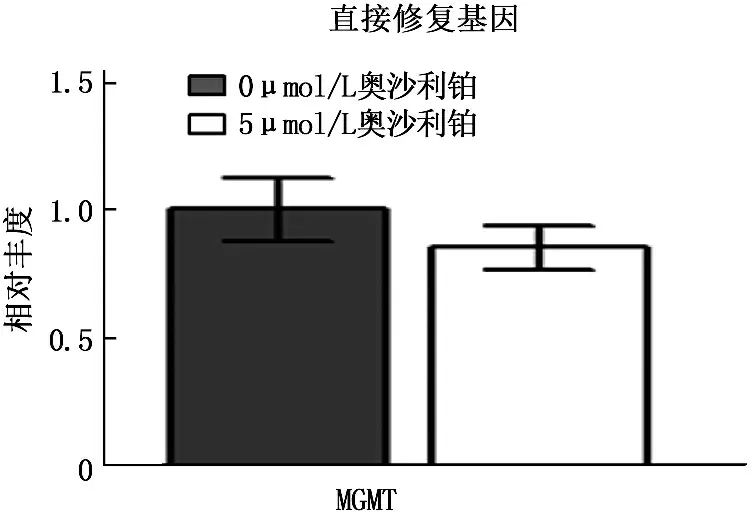
熒光實時定量PCR分析5 μmol/L奧沙利鉑處理HCT116細胞48 h后DNA損傷修復基因mRNA表達情況, **P<0.0005
圖2 奧沙利鉑誘導DNA損傷切除修復基因XPC表達上調
本研究首先通過對奧沙利鉑處理結腸癌細胞HCT116后DNA損傷標志性蛋白表達以及細胞生長活性改變的觀察,驗證了奧沙利鉑作為DNA損傷類化療藥物對抑制結腸癌細胞生長的有效性。盡管文獻[17-26]報道結腸癌細胞在奧沙利鉑處理過程中會逐漸產生抗藥性,然而抗藥性產生的具體機制目前尚未明確。本研究通過熒光定量PCR方法探討可能導致抗藥性的DNA損傷修復類基因的表達。作者發現奧沙利鉑處理后,結腸癌細胞中切除修復基因XPC表達出現顯著上升。結合以往研究,推測結腸癌細胞在奧沙利鉑處理后可能通過提高XPC的表達,增強DNA損傷修復能力,進而減少奧沙利鉑通過誘導DNA損傷而導致的細胞凋亡,此機制可能為結腸癌細胞對奧沙利鉑產生抗藥性的一個重要方面[21-23]。
綜上所述,初步研究結果表明, DNA損傷切除修復基因XPC可能是結腸癌細胞對奧沙利鉑產生抗藥性的關鍵基因。
[1] RAYMOND E, FAIVRE S, CHANEY S, et al. Cellular and molecular pharmacology of oxaliplatin[J]. Mol Cancer Ther, 2002, 1(3): 227-235.
[2] SONG N, POGUE-GEILE K L, GAVIN P G, et al. Clinical outcome from oxaliplatin treatment in stage Ⅱ/Ⅲ colon cancer according to intrinsic subtypes: Secondary analysis of nsabp c-07/nrg oncology randomized clinical trial[J]. JAMA Oncol, 2016, 2(9): 1162-1169.
[3] CHEUNG-ONG K, GIAEVER G, NISLOW C. DNA-damaging agents in cancer chemotherapy: Serendipity and chemical biology[J]. Chem Biol, 2013, 20(5): 648-659.
[4] SALEHAN M R, MORSE H R. DNA damage repair and tolerance: A role in chemotherapeutic drug resistance[J]. Br J Biomed Sci, 2013, 70(1): 31-40.
[5] SPANDIDOS A, WANG X, WANG H, et al. Primerbank: A resource of human and mouse pcr primer pairs for gene expression detection and quantification[J]. Nucleic Acids Res, 2010, 38(Database issue): D792-799.
[6] CULY C R, CLEMETT D, WISEMAN L R. Oxaliplatin.A review of its pharmacological properties and clinical efficacy in metastatic colorectal cancer and its potential in other malignancies[J]. Drugs, 2000, 60(4): 895-924.
[7] BLEIBERG H. Oxaliplatin (l-ohp): A new reality in colorectal cancer[J]. Br J Cancer, 1998, 77 (Suppl 4): 1-3.
[8] HIND D, TAPPENDEN P, TUMUR I, et al. The use of irinotecan, oxaliplatin and raltitrexed for the treatment of advanced colorectal cancer: Systematic review and economic evaluation[J]. Health Technol Assess, 2008, 12(15): 162-169.
[9] KACHALAKI S, EBRAHIMI M, MOHAMED KHOSROSHAHI L, et al. Cancer chemoresistance; biochemical and molecular aspects: A brief overview[J]. Eur J Pharm Sci, 2016, 89: 20-30.
[10] GENTILE F, TUSZYNSKI J A, BARAKAT K H. Modelling DNA repair pathways: Recent advances and future directions[J]. Curr Pharm Des, 2016, 22(23): 3527-3546.
[11] HERATH N I, DEVUN F, LIENAFA M C, et al. The DNA repair inhibitor dt01 as a novel therapeutic strategy for chemosensitization of colorectal liver metastasis[J]. Mol Cancer Ther, 2016, 15(1): 15-22.
[12] LEHMANN A R, NIIMI A, OGI T, et al. Translesion synthesis: Y-family polymerases and the polymerase switch[J]. DNA Repair (Amst), 2007, 6(7): 891-899.
[13] ALBERTELLA M R, LAU A, O′CONNOR M J. The overexpression of specialized DNA polymerases in cancer[J]. DNA Repair (Amst), 2005, 4(5): 583-593.
[14] XIANG Z, KANG Q J, XIANG X. Gene and protein expression in the oxaliplatin-resistant ht29/l-ohp human colon cancer cell line[J]. Genet Mol Res, 2015, 14(3): 11013-11022.
[15] LIU Z, QIU M, TANG Q L, et al. Establishment and biological characteristics of oxaliplatin-resistant human colon cancer cell lines[J]. Chin J Cancer, 2010, 29(7): 661-667.
[16] TO K K, POON D C, WEI Y, et al. Data showing the circumvention of oxaliplatin resistance by vatalanib in colon cancer[J]. Data Brief, 2016, 7: 437-444.
[17] 劉杲全. 反式維甲酸聯合奧沙利鉑對結腸癌LoVo細胞株增殖、血管新生能力的影響[J]. 海南醫學院學報, 2014, 20(12): 1610-1613.
[18] 江恒, 陳健, 陳克力, 等. 沉默孕烷X受體增強結腸癌LS174T細胞對奧沙利鉑敏感性的影響[J]. 第三軍醫大學學報, 2012, 34(1): 5-8.
[19] 蔡曉東. 奧沙利鉑聯合替吉奧治療復發轉移性大腸癌臨床觀察[J]. 實用臨床醫藥雜志, 2013, 17(23): 113-114.
[20] 徐明昊, 張悅, 孫明華, 等. 通過奧沙利鉑抑制PI3K/Akt通路以增強TRAIL誘導結腸癌RKO細胞凋亡敏感性的實驗研究[J]. 中國全科醫學, 2013, 16(18): 2113-2116.
[21] 呂會增, 陳圖鋒, 鄭宗珩, 等. 全反式維甲酸提高人結腸癌LoVo細胞對奧沙利鉑敏感性[J]. 中國藥理學通報, 2009, 25(6): 773-777.
[22] 王新穎, 王繼德, 姜泊. ROS在奧沙利鉑誘導PUMA表達致腸癌細胞凋亡過程中的作用[J]. 中國藥理學通報, 2006, 22(12): 1522-1525.
[23] 向征, 張才全, 湯為學. 人結腸癌耐藥細胞系HT29/L-OHP的建立及其生物學特性[J]. 第三軍醫大學學報, 2008, 30(9): 840-843.
Effect of oxaliplatin on expression of drug resistant gene in DNA damage repair in human colon cancer cells
FANG Xiao1, YIN Hua1, HU Tenghui2, JIN Shiguang2, WANG Daxin2
(1.MedicalCollegeofYangzhouUniversity,Yangzhou,Jiangsu, 225001; 2.ClinicalMedicalCollegeofYangzhouUniversity,Yangzhou,Jiangsu, 225001)
Objective To observe the effect of oxaliplatin on expression of drug resistant gene in DNA damage repair in human colon cancer cells.Methods The human colon cancer cell line HCT116 was processed with oxaliplatin for 48 hours.Western blot was used to examine DNA damage induced by oxaliplatin treatment. CCK-8 assay was used to explore the effect of oxaliplatin on growth of HCT116. The real-time PCR was used to detect the expression of DNA repair genes after oxaliplatin treatment. Results After the treatment of oxaliplatin, the expression of the DNA-damage-marker gene γ-H2AX increased significantly, and DNA damage excision repair related gene XPC increased significantly as well.The mRNA expression of other DNA damage repair genes had no significant increase. Conclusion The gene XPC might play a key role in generating drug resistance when treating colon cancer with oxaliplatin in clinic.
oxaliplatin; colon cancer cells; DNA damage repair; drug resistance
2016-10-26
江蘇省自然科學基金資助項目(BK20140497); 江蘇省高校自然科學研究面上項目(14KJB310024);江蘇省揚州市自然科學基金面上項目(YZ2014059)
王大新, E-mail: daxinw2002@sina.com
R 735.3
A
1672-2353(2017)01-001-04
10.7619/jcmp.201701001

