雜交蘭的組織培養與快繁技術
胡 蕾,申 婷
(金華職業技術學院,浙江 金華 321017)
雜交蘭的組織培養與快繁技術
胡 蕾,申 婷
(金華職業技術學院,浙江 金華 321017)
以雜交蘭的莖尖為外植體進行離體培養,探討雜交蘭的原球莖的誘導、增殖、分化、生根培養,以及練苗移栽等一系列技術措施。結果表明,原球莖誘導的適宜培養基為Hyponex No.1(花寶1號)+6-BA 2.0 mg·L-1+IBA 0.5 mg·L-1+AC 2.0 g·L-1+香蕉泥20 g·L-1+土豆泥10 g·L-1;原球莖增殖的適宜培養基為花寶1號+6-BA 3.0 mg·L-1+NAA0.1 mg·L-1+AC 2.0 g·L-1+香蕉泥20 g·L-1+土豆泥10 g·L-1;原球莖分化的適宜培養基為1/2MS+6-BA 1.5 mg·L-1+NAA0.5 mg·L-1+AC 2.0 g·L-1+香蕉泥20 g·L-1+土豆泥10 g·L-1;生根培養基以1/2MS+6-BA 0.5 mg·L-1+NAA1.5 mg·L-1+AC 2.0 g·L-1+香蕉泥20 g·L-1+土豆泥10 g·L-1為佳,移栽基質選用泥炭土∶珍珠巖3∶1成活率高。
雜交蘭; 組織培養; 原球莖
雜交蘭是國蘭與大花蕙蘭的雜交品種,既有國蘭的幽香與雅致,又有大花蕙蘭的花大、色艷,且體積較小,生育期只有2年,深受消費者喜愛,市場前景廣闊。但雜交蘭種子在自然條件下繁殖困難,而傳統的分株繁殖的繁殖系數低,難以滿足市場需要,故通過組織培養的方法來達到快繁的目的。本文對雜交蘭的組培與快繁進行研究,為雜交蘭的規模化生產提供理論依據。
1 材料與方法
1.1 材料
取雜交蘭品種黃金小神童的莖尖為試驗材料。
1.2 方法
1.2.1 外植體預處理
從親本植株上選取長勢好、葉片尚未展開的新生側芽,取中上部6~13 cm長的側芽,切下新芽,除去肉質根與葉,削去芽尖。流水沖洗30 min后,用1%中性洗滌劑浸泡5 min,再在流水下沖洗30 min后,用吸水紙吸干水分,置超凈工作臺上。無菌條件下對外植體進行嚴格的消毒處理。浸入75%酒精中30 s→無菌水沖洗2次→84消毒液浸泡15 min→無菌水沖洗2次→截取3~6 cm莖尖→84消毒液浸泡8 min→無菌水沖洗5~6次→無菌濾紙吸干水分→切取2~3 mm的莖尖,分別接種到誘導培養基、增殖培養基、分化培養基上,置于室溫(25±1)℃、光照強度1 500~2 000 lx的培養室進行培養。
1.2.2 基本培養基
雜交蘭組培主要以MS、1/2MS、Hyponex No.1(花寶1號)培養基為基礎培養基,附加活性炭0.3%,蔗糖3%,瓊脂0.8%,香蕉泥2%,土豆泥1%,pH值5.5~5.8。不同培養階段附加不同種類和濃度的植物激素,然后配置分裝,在121 ℃條件下滅菌30 min。
1.2.3 雜交蘭原球莖誘導培養基
采用4種雜交蘭誘導培養基:(1)MS+6-BA 1.0 mg·L-1+IBA 0.5 mg·L-1;(2)MS+6-BA 2.0 mg·L-1+IBA 0.5 mg·L-1;(3)花寶1號+6-BA 1.0 mg·L-1+IBA 0.5 mg·L-1;(4)花寶1號+6-BA 2.0 mg·L-1+IBA 0.5 mg·L-1。接種后每10 d換1次培養基,接種20 d左右發現有大量的原球莖產生。30 d后統計原球莖數目,以及原球莖的生長狀況。
1.2.4 雜交蘭原球莖增殖培養基
采用9種雜交蘭誘導培養基對雜交蘭原球莖增殖培養:(5)1/2MS+6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1;(6)1/2MS+6-BA 2.0 mg·L-1+NAA 0.1 mg·L-1;(7)1/2MS+6-BA 3.0 mg·L-1+NAA 0.1 mg·L-1;(8)MS+6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1;(9)MS+6-BA 2.0 mg·L-1+NAA 0.1 mg·L-1;(10)MS+6-BA 3.0 mg·L-1+NAA 0.1 mg·L-1;(11)花寶1號+6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1;(12)花寶1號+6-BA 2.0 mg·L-1+NAA 0.1 mg·L-1;(13)花寶1號+6-BA 3.0 mg·L-1+NAA 0.1 mg·L-1。將初代培養的原球莖接種到新的培養基中進行增殖培養,半個月繼代1次,連續繼代3次,統計增殖數。
1.2.5 雜交蘭原球莖分化培養基
采用9種雜交蘭誘導培養基對原球莖分化進行研究:(14)1/2MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1;(15)1/2MS+6-BA 0.5 mg·L-1+NAA 0.2 mg·L-1;(16)1/2MS+6-BA 0.5 mg·L-1+NAA 0.5 mg·L-1;(17)1/2MS+6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1;(18)1/2MS+6-BA 1.0 mg·L-1+NAA 0.2 mg·L-1;(19)1/2MS+6-BA 1.0 mg·L-1+NAA 0.5 mg·L-1;(20)1/2MS+6-BA 1.5 mg·L-1+NAA 0.1 mg·L-1;(21)1/2MS+6-BA 1.5 mg·L-1+NAA 0.2 mg·L-1;(22)1/2MS+6-BA 1.5 mg·L-1+NAA 0.5 mg·L-1。
1.2.6 叢生芽生根培養基
采用4種雜交蘭誘導培養基對叢生芽生根進行研究:(23)1/2MS+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1;(24)1/2MS+6-BA 0.5 mg·L-1+NAA 0.5 mg·L-1;(25)1/2MS+6-BA 0.5 mg·L-1+NAA 1.0 mg·L-1;(26)1/2MS+6-BA 0.5 mg·L-1+NAA 1.5 mg·L-1。將分化培養基中的小芽接種到4種生根培養基中,1個月后統計生根率與生長狀態。
1.3 煉苗移栽
當小苗長到5 cm左右時,打開瓶蓋,練苗3 d,取出小苗,洗凈根部的培養基后,將根部浸入0.2%多菌靈液3 min,然后取出晾干后定植于苔鮮、泥炭土∶珍珠巖3∶1的育苗盤中,放置陰涼通風處,于溫度25 ℃、濕度80%左右溫室中培養。苔鮮提前用0.2%多菌靈液消毒。
2 結果與分析
2.1 原球莖誘導
從表1可以看出,外植體在4號培養基分化的原球莖最多,誘導率可達120.0%,而且在生長過程中基本無失綠和死亡現象。1號培養基最差,誘導率只有43.3%。因此,4號培養基有利于莖尖的誘導。
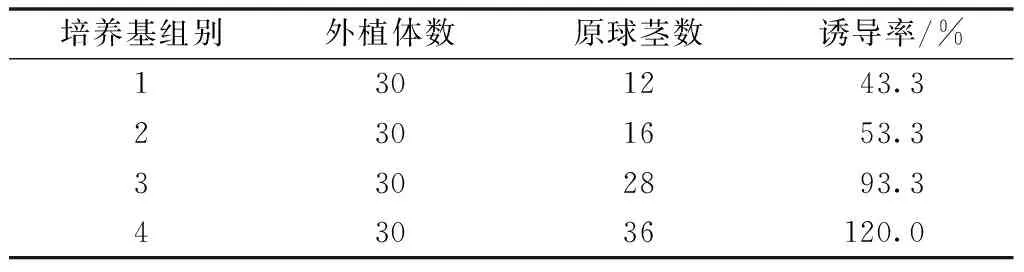
表1 不同培養基對雜交蘭原球莖誘導的影響
2.2 原球莖增殖
不同的培養基在相同的時間內,雜交蘭原球莖都有增殖,但增殖倍數不同。從表2中可以看出,13號是雜交蘭原球莖增殖的最佳培養基。
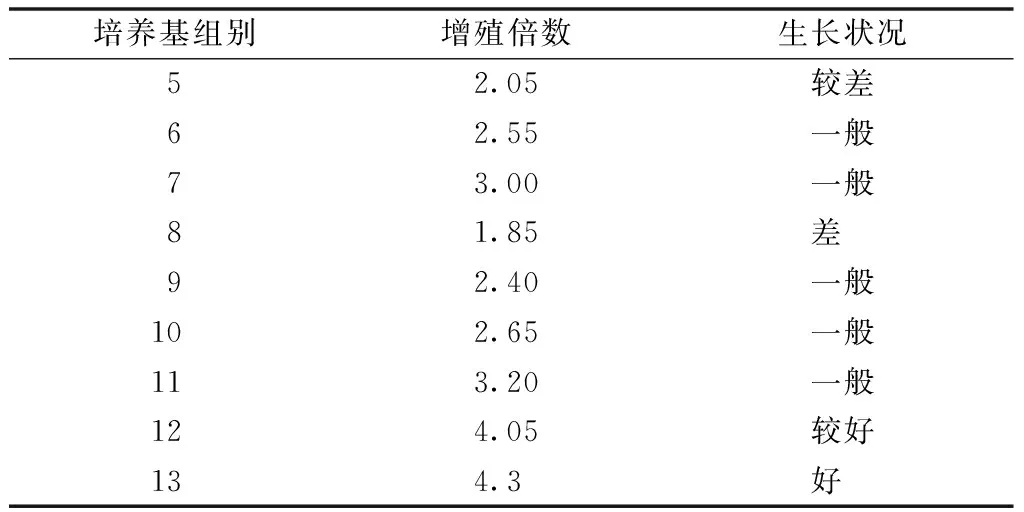
表2 不同培養基對雜交蘭原球莖分化的影響
2.3 原球莖分化
將雜交蘭原球莖接種到分化培養基中,可見原球莖增大變綠,15 d后各培養基均有叢生芽出現,以后小芽逐漸伸長,數量逐漸增多。培養30 d后,分別統計不定芽數量。從表3可以看出,原球莖在22號培養基中分化效果最佳。
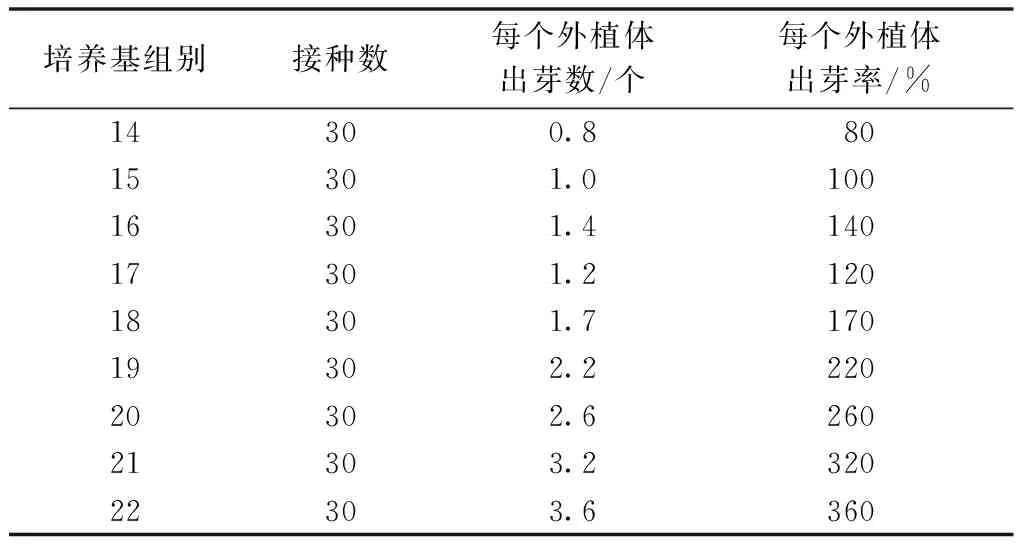
表3 不同培養基對雜交蘭原球莖增殖的影響
2.4 叢生芽生根
從表4可以看出,再生苗在4種培養基中生根均達到89%以上,但通過不同培養基比較,發現26號培養基最佳,生根快而且苗長勢好。
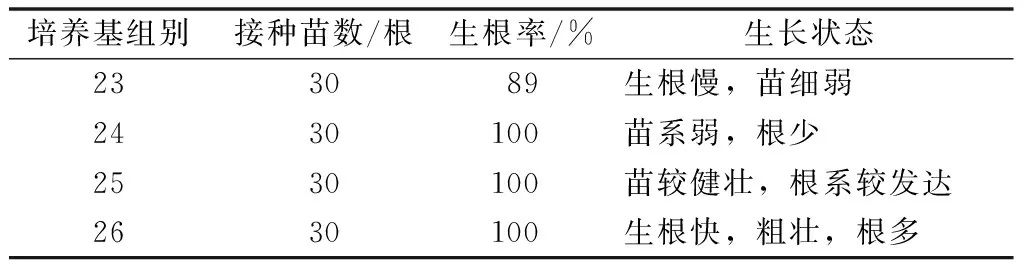
表4 不同培養基對叢生芽生根的影響
2.5 煉苗移栽
緩苗后(2周左右)用花寶系列肥結合澆水進行葉面施肥,在泥炭土∶珍珠巖3∶1的基質上1個月成活率可達90%以上,且長勢良好。
3 小結與討論
雜交蘭莖尖在培養基花寶1號+6-BA 2.0 mg·L-1+IBA 0.5 mg·L-1上可誘導出原球莖,誘導率可達120%;原球莖增殖培養基為花寶1號+6-BA 3.0 mg·L-1+NAA 0.1 mg·L-1時增殖倍數最高,可增殖4.3倍;原球莖分化培養基為1/2MS+6-BA 1.5 mg·L-1+NAA 0.5 mg·L-1時可分化形成大量的叢生芽;促進苗生長生根的最佳培養基是1/2MS+6-BA 0.5 mg·L-1+NAA 1.5 mg·L-1,生根率達到100%;小苗在泥炭土∶珍珠巖3∶1的基質上生長良好,成活率達90%以上。
通過對雜交蘭組織培養技術的研究,發現適量的加入少量活性炭和多次轉接可解決外植體的褐變問題。另外,原球莖切塊細小、接種稀疏不利于原球莖的生長,切塊大而密集的繁殖快,且長勢好。
[1] 胡蕾,申婷. 高山處理對雜交蘭花期調控作用的影響[J]. 安徽農學通報,2016,22(2):57-58.
[2] 張穎,郭曉東,王芳,等. 蝴蝶蘭組織培養快繁技術研究[J]. 北方園藝,2010(8):122-124.
[3] 田甜. 蝴蝶蘭組織培養快繁技術研究初報[J]. 南方農業,2015,9(31):23-24.
[4] 宋微,潘靜霞,吳靜. 2種蝴蝶蘭組織培養快繁技術[J]. 江蘇農業科學,2014,42(6):55-56.
(責任編輯:張瑞麟)
2016-09-14
胡 蕾,高級實驗師,從事農學工作,E-mail:550663034@qq.com。
10.16178/j.issn.0528-9017.20170223
S682.31
B
0528-9017(2017)02-0259-02
文獻著錄格式:胡蕾,申婷. 雜交蘭的組織培養與快繁技術[J].浙江農業科學,2017,58(2):259-260,264.

