和痹方灌胃對類風濕關節炎大鼠的治療作用及機制探討
張艷艷,邢潔,龐愛梅,姜萍
(1山東中醫藥大學,濟南250014;2山東中醫藥大學附屬醫院)
和痹方灌胃對類風濕關節炎大鼠的治療作用及機制探討
張艷艷1,2,邢潔1,龐愛梅2,姜萍1
(1山東中醫藥大學,濟南250014;2山東中醫藥大學附屬醫院)
目的 觀察和痹方(HBR)對類風濕關節炎(RA)的治療作用,并探討其機制。方法 將50只8周齡Wistar雄性大鼠隨機分為空白組、模型組、甲氨蝶呤(MTX)組、HBR組、HBR+MTX組各10只,空白組在大鼠尾根部及脊背部多點注射生理鹽水,其余各組大鼠尾根部及脊背部多點注射CⅡ型膠原乳化液制備RA大鼠模型。造模成功后MTX組、HBR組、HBR+MTX組分別以MTX 0.7 mg/kg(1次/周)、HBR 3 g/kg(1次/d)、MTX 0.7 mg/kg(1次/周)+HBR 3 g/kg(1次/d)灌胃,空白組和模型組以等體積生理鹽水灌胃。干預第60天心臟取血并留取膝關節,行膝關節HE染色評價軟骨破壞程度,Western blot法檢測滑膜組織轉錄因子-κB(NF-κB)p65,ELISA法檢測血清高遷移率組蛋白1(HMGB1)。結果 空白組軟骨形態及骨細胞排列正常,潮線完整。模型組軟骨面破壞,出現較多裂隙,軟骨變薄,細胞排列紊亂,潮線部分區域模糊;軟骨下骨質結構改變,炎性細胞浸潤。MTX組、HBR組、HBR+MTX組個別軟骨表面有少許表淺裂隙及局部表層缺失,軟骨細胞排列較整齊,潮線尚完整;軟骨下骨質中有少許炎性細胞浸潤。各組軟骨破壞評分、滑膜組織NF-κB p65蛋白表達及血清HMGB1水平比較,空白組 類風濕關節炎;和痹方;中藥;高遷移率組蛋白1;轉錄因子κB;甲氨蝶呤 有關的關節破壞因素中起關鍵的調控作用[1]。促炎因子高遷移率族蛋白1(HMGB1)在RA發病過程中發揮重要作用[2],并受NF-κB的調控。目前,RA的治療藥物主要包括非甾體抗炎藥、改善病情的抗風濕藥、糖皮質激素和生物制劑,常因藥物的不良反應或價格昂貴,患者難以堅持長期治療。因此,尋找不良反應小、經濟有效的藥物具有重要意義。本課題組前期研究發現,肝脾失調、內生風濕是RA,尤其是早期RA的主要內在發病機制[3],以“舒肝理脾,祛風除濕,消腫止痛”為治法的和痹方(HBR)能夠有效改善早期RA臨床癥狀、減輕關節損傷[4]。2012年6月~2015年6月,我們觀察了HBR對RA的治療作用,并探討其機制。 1.1 材料 8周齡Wistar雄性大鼠50只,體質量130~170 g,SPF級,購自山東大學醫學院實驗動物中心,動物質量合格許可證號:SCXK(魯)20140009。購進大鼠后供給充足的水和飼料,預飼養7 d。實驗試劑及藥品:CⅡ型膠原試劑、完全弗氏佐劑(FCA)購于美國SIGMA公司。HMGB1檢測試劑盒購于Bio Swamp公司,NF-κB兔多克隆抗體、山羊抗兔二抗購于Proteintech公司。和痹方濃縮劑(組成:當歸20 g、白芍30 g、白術15 g、蒼術15 g、川芎20 g、 防風9 g、青風藤20 g、腫節風30 g、生甘草6 g)由山東中醫藥大學附屬醫院制劑室提供,每毫升含生藥1 g,經高溫消毒后封瓶,4 ℃冰箱中保存備用。甲氨蝶呤(MTX)為上海醫藥集團有限公司信誼制藥總廠產品,用蒸餾水配成濃度為0.05 mg/mL的溶液,4 ℃冰箱保存備用。儀器:全波長酶標儀(Thermo Fisher 1510),洗板機(FCC Compliance 76883),酶標儀(BIO-RAD iMARK),電泳儀(BIO-RAD Power pac),顯影儀(SAGECREATION Minichemi 420-k4)等。 1.2 方法 1.2.1 動物分組與造模處理 將50只Wistar雄性大鼠隨機分成5組,分別為空白組、模型組、MTX組、HBR組、HBR+MTX組,每組10只。空白組在大鼠尾根部及脊背部多點注射生理鹽水,其余各組根據文獻[5]在大鼠尾根部及脊背部多點注射CⅡ型膠原乳化液制備RA大鼠模型。造模成功后MTX組、HBR組、HBR+MTX組分別以MTX 0.7 mg/kg(1次/周)、HBR 3 g/kg(1次/d)、MTX 0.7 mg/kg(1次/周)+HBR 3 g/kg(1次/d)灌胃,空白組和模型組以等體積生理鹽水灌胃。給藥第60天,在10%水合氯醛麻醉下行心臟取血[6]5 mL,分離血清備測;處死動物,截取膝關節,取膝關節滑膜,用生理鹽水清洗,-80 ℃冰箱保存。同時將剩余膝關節用中性甲醛浸泡固定后冷凍保存,留待進行病理切片。 1.2.2 關節軟骨破壞情況觀察 去除膝關節周圍組織,進行脫鈣、脫水;石蠟包埋后切片,HE染色,顯微鏡下觀察。根據軟骨破壞評分標準[7]進行評分 ,按嚴重程度分為0~5分。 1.2.3 滑膜組織NF-κB p65檢測 采用Western blot法。常規方法提取滑膜組織總蛋白,用BCA法檢測蛋白濃度,行SDS-PAGE電泳,轉膜;一抗孵育,4 ℃過夜;漂洗后,二抗室溫孵育1 h。漂洗后滴加ECL曝光液,在凝膠成像系統中進行灰度掃描,以相應蛋白條帶與內參光密度值比值來表示NF-κB p65的相對表達量。 1.2.4 血清HMGB1檢測 采用ELISA法檢測血清HMGB1,按照試劑盒說明書進行操作。 2.1 各組關節內軟骨破壞程度比較 空白組:軟骨表面平滑,結構清晰,軟骨細胞排列呈柱狀,無軟骨細胞簇出現,潮線完整。模型組:軟骨面破壞,出現較多裂隙,軟骨變薄,細胞排列紊亂,潮線部分區域模糊;軟骨下骨質結構改變,炎性細胞浸潤。MTX組、HBR組、HBR+MTX組:個別軟骨表面有少許表淺裂隙及局部表層缺失,軟骨細胞排列較整齊,潮線尚完整;軟骨下骨質中有少許炎性細胞浸潤。各組軟骨破壞評分比較見表1。 2.2 各組滑膜組織NF-κB p65蛋白表達及血清HMGB1水平比較 見表1。 表1 各組軟骨破壞評分、滑膜組織NF-κB p65蛋白表達及血清HMGB1水平比較 注:與空白組比較,aP<0.05,bP<0.01;與模型組比較,cP<0.05,dP<0.01;與MTX組比較,eP<0.05,fP<0.01;與HBR組比較,gP<0.05,hP<0.01。 RA的病因及發病機制至今尚未能完全闡明,一般認為炎癥細胞因子介導的體液免疫機制是RA炎癥反應的重要因素。研究[8]發現,NF-κB信號轉導通路是與RA進程密切相關的信號通路,通過抑制NF-κB通路可在一定程度上達到治療RA的目的。NF-κB為多種炎性因子如腫瘤壞死因子α(TNF-α)、白細胞介素1(IL-1)、HMGB1等信號通路的轉錄因子,調控炎性因子的活化;受到炎癥刺激后NF-κB發生活化,導致大量炎癥細胞和炎癥介質的合成與釋放。有研究[9]發現,細胞外HMGB1能與纖維蛋白溶酶原活化作用系統的多個組件結合,從而催化纖維蛋白溶酶原活化物和基質金屬蛋白酶(MMP)的活性,加速軟骨和骨的破壞;同時HMGB1是破骨細胞激活劑,對軟骨及軟骨下骨有直接的破壞作用[10]。另外,HMGB1可促進炎性因子TNF-α、IL-1、IL-6等的生成與釋放,提高血管內皮生長因子水平,刺激成纖維樣滑膜細胞增殖和破骨細胞活化,參與血管翳的形成;同時,IL-6也可以促進MMPs的生成,對關節造成破壞。而TNF-α、IL-1、IL-6等炎性因子又可促進HMGB1的分泌[11~13],這樣就形成了一個正反饋環路,從而使炎癥不斷得以放大,加快關節破壞。 RA屬中醫學痹證范疇,發病之初與肝脾功能失常密切相關。肝主筋,主疏泄,條暢氣機;脾主四肢,主運化,疏布精微。肝失疏泄,或脾失健運,氣機失暢,內生諸邪,或因虛外邪內侵,停于四肢末節,造成關節腫痛。日久影響氣血津液運行,留痰成瘀,由初期關節局部的滑膜組織炎癥逐漸發展到軟骨、骨質侵蝕和破壞,最終形成關節畸形,乃至全身性損害。故擬定HBR治療RA。方中當歸、白術為君藥,養血疏肝理脾;蒼術、白芍為臣藥,燥濕健脾,柔肝止痛。青風藤、腫節風祛風除濕,調通經絡;防風祛風勝濕止痛;川芎活血行氣,祛風止痛,共為佐藥。甘草既與白芍相配,酸甘化陰,養陰除痹,緩急止痛,又調和藥性,為使藥。全方補肝血疏肝用健脾除濕,祛風消腫定痛,標本同治,共奏舒肝理脾、祛風除濕、消腫止痛之功效[4]。 MTX是目前公認的治療RA的首選藥物。本課題組前期研究表明,MTX與HBR均可降低RA患者血清中IL-6、IL-17水平,升高血清IL-10水平,從而抑制RA的炎癥反應,并能夠調節與RA關節軟骨及骨質破壞密切相關的血清MMP-3、 NF-κB受體活化因子配基(RANKL)、骨保護素(OPG)水平,控制RA的骨破壞,而且HBR與MTX聯合用藥效果更顯著[14~16]。本研究結果顯示,HBR、MTX及兩者聯合應用,均可減少滑膜組織中NF-κB p65表達,降低血清HMGB1水平,減輕關節軟骨的破壞程度;并且,MTX與HBR聯用優于MTX、HBR單獨使用。因此,我們認為HBR能夠減輕關節軟骨破壞,與MTX聯用效果更好;該作用與其抑制滑膜組織NF-κB信號通路,降低血清HMGB1水平有關,可為HBR的臨床應用提供理論依據。 綜上所述,肝脾失調是早期RA的重要內在病機,HBR能夠抑制NF-κB信號通路,從而抑制其下游HMGB1等促炎性因子的生成,從而抑制RA的炎性反應,改善RA的關節軟骨破壞。 [1] van Loo G, Beyaert R. Negative regulation of NF-κB and its involvement in rheumatoid arthritis[J]. Arthritis Res Ther, 2011,13(3):221. [2] 張玉萍,姚茹冰,蔡輝.HMGB1對類風濕關節炎作用的研究進展[J].現代醫學,2015,43(9):1203-1204. [3] 秦林,滕佳林,葉蕾,等.類風濕關節炎從肝脾辯證的研究概況[J].上海中醫藥雜志,2006,40(3):23-25. [4] 姜萍,張琳英,戴玲玲,等.和痹方治療類風濕關節炎療效觀察[J].中國中西醫結合雜志,2016,36(1):24-28. [5] 周強,呂厚山,栗占國.膠原誘導的關節炎動物模型研究現狀及進展[J].中華風濕病學雜志,2003,7(4):227-231. [6] 葉少梅,歐衛平.大鼠心臟取血法[J].上海實驗動物科學,1999,19(3):177. [7] Romas E, Sims NA, Hards DK, et al. Osteoprotegerin reduces osteoclast numbers and prevents bone erosion in collagen-induced arthritis[J]. Am J Pathol,2002,161(4):1419-1427. [8] 周亞歐.膽堿能抗炎通路在類風濕關節炎中的作用及機制[D].長沙:中南大學,2008. [9] Taguchi A, Blood DC, del loro G, et al. Blockade of RAGE-amphoterin signaling suppresses tumour growth and metastases[J]. Nature, 2000,405(6784):354-360. [10] Zhou Z, Xiong WC. RAGE and its ligands in bone metabolism[J]. ront Biosci ( Schol Ed), 2011,3(1):768-776. [11] Chen G, Ward MF, Sama AE, et al. Extracellular HMGB1 as a proinflammatory cytokine[J]. J Interferon Cytokine Res, 2004,24(6):329-333. [12] Rendon-Mitchell B, Ochani M, Li JH, et al. IFN-γ induces high mobility group box 1 protein release partly through a TNF-dependent mechanism[J]. J Immunol, 2003,170(7): 3890-3897. [13] Scaffidi P, Misteli T, Bianchi ME, et al. Release of high mobility group box 1 by dendritic cells controls T cell activation via the receptor for advanced glycation end products[J]. J Immunol, 2005,174(12):7506-7515. [14] 王健.調和肝脾方治療早期類風濕關節炎的臨床與實驗研究[D].濟南:山東中醫藥大學,2015. [15] 孫曉云,蘇茵,任麗敏,等.甲氨蝶呤對類風濕關節炎患者的治療作用及對相關細胞因子的影響[J].北京大學學報,2006,38(4):356-359. [16] 李萍,王霖,王文杰.甲氨蝶呤對破骨細胞的作用及機制研究[J].藥學學報,2008,43(10):1023-1031. (收稿日期:2016-10-23) 山東省科技發展計劃項目(2014GSF119017);山東省中醫藥科技發展計劃項目(2015-101)。 姜萍(E-mail: lmdlmd6617@163.com) 10.3969/j.issn.1002-266X.2017.02.011 R255.6 A 1002-266X(2017)02-0037-03 2016-08-29) 類風濕關節炎(RA)是一種以侵蝕性關節炎為 主要臨床表現的自身免疫性疾病,致殘率較高。其病理表現為關節滑膜的慢性炎癥、血管翳的形成,并出現關節的軟骨和骨破壞,最終導致關節畸形和功能喪失。研究表明,轉錄因子-κB(NF-κB)在與RA1 材料與方法
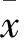
2 結果

3 討論

