磁共振彌散峰度成像在腮腺腫瘤診斷與鑒別診斷的臨床價值
*
磁共振彌散峰度成像在腮腺腫瘤診斷與鑒別診斷的臨床價值
于金芬①②王祥生②曹廣亮②王光彬①李傳亭①*

目的:探討磁共振彌散峰度成像在鑒別腮腺腫瘤良性和惡性的應用價值。方法:選取32例腮腺腫瘤患者,術前行常規磁共振成像(MRI)及彌散峰度成像(DKI)掃描,應用彌散峰度評估軟件測定平均峰度(MK)值、各向異性(FA)值和平均擴散率(MD)值,應用ROC曲線分析獲得MK值、FA值和MD值,鑒別腮腺腫瘤良性和惡性的敏感度、特異度及曲線下面積等診斷效能指標。結果:腮腺良性腫瘤的平均MK值明顯低于惡性腮腺腫瘤,差異有統計學意義(Z=2.934,P=0.003);腮腺良性腫瘤FA值低于惡性腫瘤,差異有統計學意義(Z=2.348,P=0.019);腮腺良性腫瘤MD值明顯高于惡性腫瘤腮腺,差異有統計學意義(Z=2.077,P=0.047)。腮腺良性和惡性腫瘤MK值、FA值和MD值的診斷臨界值分別是1.0528、0.2396和0.6472(×10-3mm2/s);MK值鑒別腮腺腫瘤良惡性的診斷效能優于MD值和FA值。結論:DKI相比傳統彌散(DWI)和彌散張量成像(DTI)在腮腺腫瘤良性和惡性鑒別方面有更好的特異度和敏感度。MK值可以顯示腮腺腫瘤病理特性并提供定量信息,有助于腫瘤的鑒別診斷。
腮腺腫瘤;彌散峰度成像;磁共振成像
[First-author’s address] Department of Ultrasound, Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China.
腮腺腫瘤約占頭頸部腫瘤的3%左右,全身各器官除了女性生殖系統腫瘤外,腮腺腫瘤組織成分最復雜多樣化[1-2]。腮腺腫瘤中良性占80%,而良性腮腺腫瘤中約85%為多行性腺瘤,其次是腺淋巴瘤,手術切除是腮腺腫瘤最有效的治療方法,術前組織學定性診斷有助于手術方式及計劃的制定[3]。多形性腺瘤進行單純的腫瘤摘除術會導致局部復發率高達20%~45%[4-7]。如果采用保留面神經的病側腮腺切除術,局部復發率可降低至1.5%~6%[3,8-9]。二次手術容易導致面神經麻痹和惡性腫瘤的轉移[10]。因此,術前組織學定性定量診斷至關重要。本研究嘗試應用彌散峰度成像(diffusional kurtosis imaging,DKI)鑒別腮腺腫瘤,目的在于檢驗此技術用于鑒別腮腺腫瘤的價值及術前定性診斷的能力。
1 資料與方法
1.1一般資料
選取2014年12月至2015年11月山東省立醫院口腔外科及影像研究所就診的32例腮腺腫瘤患者(均經術后病理證實),其中男性15例,女性17例;年齡18~76歲,平均年齡47.7歲;臨床病程3個月至15年。所有患者術前行常規磁共振成像(magnetic resonance imaging,MRI)及DKI掃描,應用彌散峰度評估軟件測定平均峰度(mean kurtosis,MK)值、各向異性(fractional anisotropy,FA)值和平均擴散率(mean diffusivity,MD)值,應用ROC曲線分析獲得MK值、FA值和MD值,鑒別腮腺腫瘤良惡性的敏感度、特異度及曲線下面積(area under the curve,AUC)等診斷效能指標。
1.2納入與排除標準
(1)納入標準:①術前未行活檢檢查及手術;②術前行MRI及DKI,檢查前未行任何有創性檢查,包括放射治療及藥物化療;③無移動偽影影響的高清晰圖像;④病灶直徑>1 cm。
(2)排除標準:①圖像質量欠佳;②患者有固定義齒(義齒不可以移除);③MRI檢查前進行過任何有創治療或檢查:④活檢及粒子植入等。
1.3儀器設備
采用Skyra 3.0T超導型磁共振掃描儀(德國西門子),專用頭頸部8通道線圈進行圖像采集。
1.4檢查方法
患者取仰臥位,頭部用海綿墊固定,雙側外耳道內置入耳塞以減少機器噪聲對患者造成的不適。掃描范圍基本對稱,掃描過程中頭頸部制動,盡量減少吞咽動作。先行常規MRI掃描,包括橫軸位掃描T1WI、T2WI脂肪抑制序列。冠狀位及矢狀位掃描T2WI壓脂序列,再行DKI掃描。
1.4.1 常規MRI掃描
所有患者均進行常規MRI平掃。常規掃描序列:橫軸位、冠狀位及矢狀位。橫軸位掃描T1WI、T2WI脂肪抑制序列;冠狀位及矢狀位掃描T2WI壓脂序列。掃描參數:T1WI脂肪抑制序列。TR 2 000 ms、TE 11 ms、TI 899 ms,層厚3 mm,間隔0.5 mm,視野(FOV)為230 mm×230 mm,掃描時間172 s;T2WI脂肪抑制序列。TR 4731 ms、TE 99 ms、層厚3 mm,間隔0.5 mm,FOV為230 mm×230 mm,掃描時間為175 s。
1.4.2 DKI掃描
DKI行橫軸位掃描,掃描層面的選取及層數的設置與常規MRI掃描相同。DKI掃描采用多次激發紫萱平面回波成像(SE-EPI),掃描參數:TR 3700 ms,TE 95 ms,FOV為210 mm×210 mm,層厚3 mm,層間隔0 mm,b值采用0,1 000和2 000 mm2/s,20正交擴散敏感梯度方向,掃描時間為819 s。
1.5圖像分析
由2名10年以上工作經驗的主治醫師以上的影像診斷醫師采用雙盲法進行圖像分析和評估,同時記錄所有病變的部位、形態、大小、信號強度、邊界及毗鄰關系以及頸部淋巴結情況。DKI掃描結束后,以數字影像和通信(digital imaging and communication of medicine,DICOM)標準格式導出。將DKI資料傳入彌散和峰度評估軟件Matlab(2012 a /7.14)。
對原始數據首先進行分組和格式轉換(DICOM格式轉換為NII格式),應用DKE對原始數據進行高強度濾波處理,梯度向量設置為20個方向,b=0,閾值設置為50,b值設置為0,1 000和2 000,獲得彌散峰度圖(MK圖)、表觀彌散圖(MD圖)和FA圖。運用mricron軟件顯示平均峰度圖(MK圖)、平均擴散圖(MD圖)和各項異性圖(FA圖),選定病變最大層面,在病變實質部分手動劃定感興趣區域(ROI),ROI大小約為20體素左右,ROI劃定盡量避開出血、壞死、囊變和鈣化區,隨機選取3個感興趣區,測量后取平均值。
1.6統計學方法
使用Medcalc15.6統計學軟件,運用秩和檢驗,比較良性和惡性腫瘤間MK值、MD值和FA值差異性,所有MK值、FA值和MD值的平均值均采用均數±標準差(x-±s)表示。采用參數檢驗數據是否符合正態分布、秩和檢驗方法比較兩組間各參數值有無差異,對差異具有統計學意義的參數以病理結果為金標準,做ROC曲線分析獲得DKI對腮腺腫瘤的診斷效能,并用Z檢驗比較ROC曲線下面積,比較MK值、FA值和MD值診斷及鑒別診斷腮腺腫瘤的能力。以靈敏度和特異度之和做最佳診斷臨界點,以P<0.05為差異有統計學意義。
2 結果
2.1病理、MRI和DKI檢測結果
在32例患者中共有34枚腮腺腫瘤,1例腺淋巴瘤患者兩側腮腺各有1枚腫瘤,另1例黏液表皮樣癌一側腮腺有兩枚腫瘤。34例腮腺腫瘤中良性病變23例,包括多形性腺瘤10例,腺淋巴瘤9例,基底細胞腺瘤2例,多結節性嗜酸細胞腺瘤1例,肌上皮瘤1例;惡性病變11例,其中黏液表皮樣癌4例,腺泡細胞癌3例,基底細胞癌2例,腺樣囊性癌1例,多形性腺瘤惡變1例。
良性腫瘤中多形性腺瘤均呈圓形或橢圓形,其中8例有包膜,3例有分葉,有包膜的病變邊界清楚,T1WI均呈略低于正常腮腺信號,信號較均勻,T2WI信號均高于正常腮腺組織,其中4例腫瘤內出現特殊高信號區,組織學證實為黏液區;MK圖信號明顯降低且較均質;MD圖上呈高信號,FA圖呈低信號。2例腫瘤出現特征性纖維化、鈣化區,T2WI均呈低信號,如圖1所示。
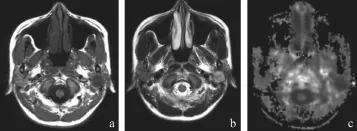
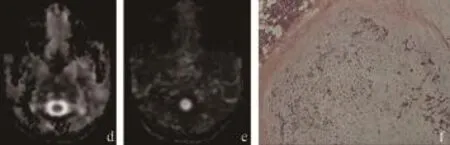
圖1 多形性腺瘤的MRI、DKI影像及病理圖
多形性腺瘤惡變均表現為腮腺巨大腫塊,體積均在3~4 cm或>4 cm,包膜不完整,信號不均勻;MK圖信號增高且明顯不均質;MD圖呈低信號,FA圖呈低信號及周圍正常腺體呈FA圖高信號;惡性成分組織類型高度變異,如圖2所示。


圖2 多形性腺瘤惡變的MRI、DKI影像和病理圖
2.2腮腺腫瘤的DKI表現
2.2.1 腮腺腫瘤良性與惡性MK值、FA值和MD值比較
腮腺腫瘤良性和惡性的平均M K值分別為(0.728±0.263)和(1.091±0.253),二者比較差異有統計學意義(Z=2.934,P<0.05);平均FA值分別為(0.1979±0.0465)和(0.2509±0.0427),二者比較差異有統計學意義(Z=2.348,P<0.05);平均MD值分別為(1.048±0.323)和(0.738±0.330)(10-3mm2/s),二者比較差異具有統計學意義(Z=2.077,P<0.05),見表1。
表1 32例患者腮腺良性和惡性腫瘤的MK值、FA值和MD值(±s)
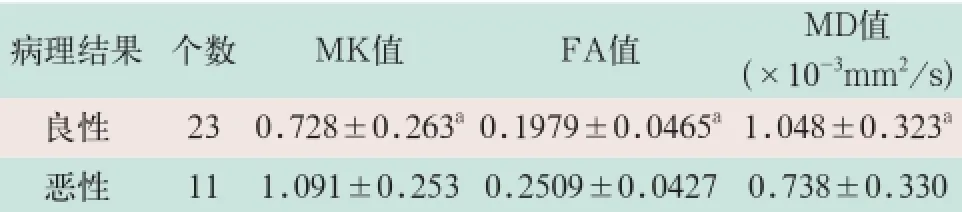
表1 32例患者腮腺良性和惡性腫瘤的MK值、FA值和MD值(±s)
病理結果個數MK值FA值MD值(×10-3mm2/s)良性 230.728±0.263a0.1979±0.0465a1.048±0.323a惡性 111.091±0.253 0.2509±0.04270.738±0.330
2.2.2 ROC曲線分析
MK值、FA值和MD值鑒別腮腺腫瘤良性和惡性的能力。以術后病理為金標準對MK值、FA值和MD值做鑒別腫瘤良惡性的ROC曲線分析,得出MK值為1.0528,為腮腺良性和惡性病變的診斷臨界值,當MK值>1.0528時,可診斷為惡性,對應的靈敏度、特異度及AUC分別為75.00%、91.30%和0.853;FA值為0.2396,為腮腺良性和惡性病變的診斷臨界值,當FA值>0.2396時,可診斷為惡性,對應的靈敏度、特異度及AUC分別為75.00%、82.61%和0.783;MD值為0.6472(10-3mm2/s),為腮腺良性和惡性病變的診斷臨界值,當MD值<0.6472(10-3mm2/s)時,可診斷為惡性,對應的靈敏度、特異度及AUC分別為50.00%、92.65%和0.739,見表2、如圖3所示。
腮腺腫瘤實質區ROI的MK值、FA值和MD值的ROC曲線,MK診斷截點為1.0528,AUC為0.853;FA值診斷截點為0.2396,AUC為0.783;MD值診斷截點為0.647210-3mm2/s,AUC為0.739。
3 討論
應用超聲、CT及MRI評估腮腺腫瘤,其傳統性檢查可以提供腫瘤的病理學特征,然而這些檢查在鑒別腮腺腫瘤時缺乏特異性和準確性[11-14]。
DKI是近年來國際眾學者關注的前沿焦點,其臨床研究發展迅速,是一種新興的磁共振擴散成像技術和DTI技術的延伸,可準確衡量組織內水分子的非高斯擴散運動,反映組織結構的復雜程度更為敏感。
近年來,磁共振DKI已廣泛應用于腦、肝臟、肺及前列腺等各器官病變,且表現出傳統彌散及張力成像無法比擬的優勢,能夠真實的反映非高斯分布的彌散運動情況并提供定量信息[15-22]。在本研究中發現腮腺良性和惡性腫瘤的MK值存在顯著的統計學差異,故DKI有助于腮腺腫瘤的診斷及鑒別診斷。
傳統的彌散成像(包括DWI和DTI)假設生物體內的水分子的布朗運動(擴散運動)符合高斯分布(正態分布)[23-24]。然而有研究表明,活體組織內的水分子擴散運動由于受到組織細胞類型、細胞膜及生化特性等的影響偏離正態分布[25-26]。這種偏離信息能夠被DKI檢測并用超值峰度對其量化[15]。DKI通過提高b值到2 000 s/mm2以上增加短分子距離的敏感性,DKI的采集至少需要3個b值和15個以上正交方向彌散梯度場的施加。因此,DKI比傳統彌散成像(DWI和DTI)更適合檢測和反映組織的微觀變化[27]。DKI掃描可以同時得到DTI參數FA值、MD值和DKI參數:MK值、軸向峰度(Ka)和徑向峰度(Kr)值。Ka值類似DTI中的FA值,Ka值越小越趨于各向同性擴散,越大表示組織結構越緊密規則,MK值是所有方向上峰度的平均值,反映的是ROI內組織結構的復雜程度,MK值與結構復雜程度成正比[28]。因此,MK值是DKI最具有代表意義的參數,是組織微結構復雜程度的指標。

表2 32例患者MK值、FA值和MD值鑒別腮腺腫瘤良性和惡性ROC曲線分析

圖3 腮腺良惡性腫瘤MK值、FA值和MD值ROC曲線圖
本研究結果顯示,腮腺良性腫瘤和惡性腫瘤實質區的MK值、FA值和MD值差異均有統計學意義。腮腺惡性腫瘤的MK值明顯高于良性,MK值與腫瘤的惡性程度成正比,這與Raab等[29]的研究結果一致。此外,Jensen等[15]及Raab等[29]研究團隊認為,MK值和腫瘤細胞密度和新生血管等呈正比。MK值采用高b值,多個b值和15個以上正交方向梯度場的平均值(本研究使用的是20個方向),反映的是ROI區域內組織結構的復雜程度,體現了因為受到腫瘤細胞密度、細胞膜屏障、細胞內外間隔以及新生血管和生化環境等因素影響的水分子非高斯擴散運動。腮腺良性和惡性腫瘤MK值、FA值和MD值的ROC曲線結果顯示,MK值的AUC(0.859)明顯大于FA值和MD值的AUC(0.783和0.789),鑒別腮腺腫瘤的良性和惡性更加敏感,特異度也更高,表明DKI相比傳統彌散成像(DWI和DTI)對于腮腺腫瘤良性和惡性的診斷及鑒別診斷能力更高。
本研究中尚存在一些不足之處:①樣本數量比較少,病理類型較分散,尤其是惡性組病例,可能會造成統計學的偏差,因此需要大樣本數據研究對此進行研究考證;②ROI的選取和參數值的測量等受測試者主觀因素影響較大,因此研究結果可能存在偏差,需要進一步的深入研究。
綜上所述,腮腺良性和惡性腫瘤MK存在顯著差異;相比傳統彌散成像(DWI和DTI)技術,DKI技術對于腮腺腫瘤良性和惡性的診斷及鑒別診斷效能更高。
參考文獻
[1]Pinkston JA,Cole P.Incidence rates of salivary gland tumors:results from a population-based study[J].Otolaryngol Head Neck Surg,1999,120(6):834-840.
[2]Seifert G.Histoligical Typing of Salivary Gland Tumors[M].2nd ed.Berlin,Germany:Springer-Verlag,1991:24-54.
[3]Donald T,Donovan MD,Houston TX.Capsular significance in parotid tumor surgery: reality andmyths of lateral lobectomy[J].Laryngosco pe,1984,94(3):324-329.
[4]Woods J,Chong G,Beahrs O.Experience with 1360 primary parotid tumors[J]Am J Surg,1975,130:460-462.
[5]Heller KS,Attie JN.Treatment of Warthin’s tumor by enucleation[J].Am J Surg,1988,156(4):294-296.
[6]Witt RL.The significance of the margin in parotid surgery for pleomorphic adenoma[J].Lar yngoscope,2002,112(12):2141-2154.
[7]Myssiorek D,Ruah C,Hybels R.Recurrent pleomorphic adenomas of the parotid gland[J]. Head Neck,1990,12(4):332-336.
[8]Brieger J,Duesterhoeft A,Brochhausen C,et al. Recurrence of pleomorphic adenoma of the parotid gland--predictive value of cadherin-11 and fascin[J].APMIS,2008,116(12):1050-1057.
[9]Wennmo C,Spandow O,Emga°rd P,et al. Pleomorphic adenomas of the parotid gland:superficial parotidecpriatectomy or limited excision?[J].Laryngol Otol,1988,102(7):603-605.
[10]Henriksson G,Westrin KM,Carls?? B,et al. Recurrent primary pleomorphic adenomas of salivary gland origin:intrasurgical rup ture,histopathologic features and pseudopodia[J]. Cancer,1998,82(4):617-620.
[11]Bialek EJ,Jakubowski W,Zajkowski P,et al.US of the major salivary glands:anatomy and spatial relationships,pathologic conditions,and pitfalls[J].RadioGraphics,2006,26(3):745-763.
[12]Habermann CR,Arndt C,Graessner J,et al. Diffusion-Weighted Echo-Planar MR Imaging of Primary Parotid Gland Tumors:Is a Prediction of Different Histologic Subtypes Possible?[J]. AJNR Am J Neuroradiol,2009,30(3):591-596.
[13]Bozzato A,Zenk J,Greess H,et al.Potential of ultrasound diagnosis for parotid tumours: analysis of qualitative and quantitative parameters[J]. Otolaryngol Head Neck Surg,2007,137(4):642-646.
[14]Bhatia KS,Rasalkar DD,Lee YP,et al.Evaluation of real-time qualitative sonoelastography of focal lesions in the parotid and submandibular glands:applications and limitations[J].Eur Radiol,2010,20(8):1958-1964.
[15]Jensen JH,Helpern JA,Ramani A,Lu H,Kaczynski K.Diffusional kurtosis imaging:The quantification of non-gaussian water diffusion by means of magnetic resonance imaging[J]. Magn Reson Med,2005,53(6):1432-1440.
[16]Masutani Y,Aoki S.Fast and Robust Estimation of Diffusional Kurtosis Imaging (DKI)Parameters by General Closed-form Expressions and their Extensions[J].Magn Reson Med Sci,2014,13(2):97-115.
[17]Assaf Y,Ben-Bashat D,Cohen T,et al.High b value q-space analyzed diffusion-weighted MRI:application to multiple sclerosis[J].Magn Reson Med,2002,47(1):115-126.
[18]Jensen JH,FalangolaMF,Hu C,et al.Preliminary observations of increased diffusional kurtosis in human brain following recent cerebral infarction[J].NMR Biomed,2011,24(5):452-457.
[19]Yuan J,Yeung DKW,Mok GSP,et al.Non-Gaussian analysis of diffusion weighted imaging in head and neck at 3T:A pilot study in patients with nasopharyngeal carcinoma[J].PLoS One,2014,9(1):1-8.
[20]Jansen JF,Stambuk HE,Koutcher J,et al.Nongaussian analysisof diffusion-weighted MR imaging in head and neck squamous cell carcinoma:A feasibility study[J].Am J Neurora diol,2010,31(4):741-748.
[21]Heusch P,K?hler J,Wittsack H-J,et al.Hybrid [18F]-FDG PET/MRI including non-Gaussian diffusion-weighted imaging(DWI):Preliminary results in non-small cell lung cancer(NSCLC)[J]. Eur J Radiol,2013,82(11):2055-2060.
[22]Sigmund EE,Johnson G,Babb JS,et al.Prostate Cancer :Feasibility and Preliminary Experience of a Diffusional Kurtosis Model for Detection and Assessment of Aggressiveness of Peripheral Zone Cancer[J].Radiology,2012,264(1):126-135.
[23]Le Bihan D,Turner R,Douek P,et al.Diffusion MR imaging:clinical applications[J].Am J Roentgenol,1992,159(3):591-599.
[24]Yablonskiy DA,Bretthorst GL,Acker-man JJ.Statistical model for diffusion attenuated MR signal[J].Magn Reson Med,2003,50(4):664-669.
[25]Lu H,Jensen JH,Ramani A,et al.Three-dimensional characterization of non-gaussian water diffusion in humans using diffusion kurtosis imaging[J].NMR in Biomedicine,2006,19:236.
[26]Fieremans E,De Deem Y,Lemahieu I.Validation methods for diffusion weighted magnetic resonance imaging in brain white matter[J]. Biomedical Imaging,2008,5:915.
[27]Hui ES,Cheung MM,Qi L,et al.Towards better MR characterization of neural tissues using directional diffusion kurtosis analysis[J]. Neuroimage,2008,42(1):122-134.
[28]曾丁巳.擴散峰度成像(DKI)在中樞神經系統的應用[J].臨床放射學雜志,2011,30(9):1400-1402.
[29]Raab P,Hattingen E,Franz K,et al.Cerebral gliomas:diffusional kurtosis imaging analysis of microstructural differences[J].Radiology,2010,254(3):876-881.
The clinical value of diagnosis and differential diagnosis of magnetic resonance diffusion kurtosis imaging for parotid tumors
/
YU Jin-fen, WANG Xiang-sheng, CAO Guang-liang, et al//China Medical Equipment,2017,14(1):62-66.
Objective: This study aimed to explore the application values of diffusion kurtosis imaging (DKI) in differential diagnosis of benign and malignant parotid tumors. Methods: 32 patients with parotid tumor were examined preoperative with conventional magnetic resonance imaging (MRI) and DKI, respectively. The data of DKI were analyzed with diffusion kurtosis estimator to calculate mean kurtosis (MK), mean diffusivity (MD) and fractional anisotropy (FA). And the MK, MD and FA can be got by ROC curve. The diagnostic accuracy of MK, MD and FA values was evaluated with series of diagnosis effectiveness indicators, such as sensitivity, specificity, and area under receiver operating characteristic (ROC) curve. Results: There was a significant difference between benign and malignant parotid tumors in the values of MK, FA and MD (P=0.003, 0.019 and 0.047, respectively). The mean MK value of benign parotid tumors was significantly lower than malignant parotid tumors; The mean FA value of benign parotid tumors was significantly lower than malignant parotid tumors; and the mean MD value of benign tumors was significantly higher than malignant tumors. The diagnosis of cut-off point between benign and malignant parotid tumors for MK, FA and MD was 1.0528, 0.2396 and 0.6472(×10-3mm2/s), respectively. The sensitivity, specificity and AUC for MK, FA and MD in differentiating benign and malignant parotid tumor were 0.853, 75.00%, 91.30%; 0.783, 75%, 82.61%; 0.739, 50%, 95.65%; respectively. Conclusion: DKI showed higher specificity and sensitivity than did conventional diffusion-weighted and diffusion-tensor imaging for assessment and differential diagnosis of benign and malignant parotid tumors. MK enables differentiation and characterisation of parotid tumors, and provides quantitative information for the parotid tumors.
Parotid tumor; Diffusion kurtosis imaging; Magnetic resonance imaging
10.3969/J.ISSN.1672-8270.2017.01.020
1672-8270(2017)01-0062-05
R739.8
A
2016-09-25
①山東大學附屬山東省醫學影像學研究所 山東 濟南 250022
②章丘市中醫醫院醫學影像中心 山東 章丘 250200
*通訊作者:lichuanting@yeah.net
于金芬,女,(1979- ),博士研究生,主治醫師。山東大學附屬山東省醫學影像學研究所、章丘市中醫醫院醫學影像學中心,從事磁共振影像診斷工作。

