骨代謝生化指標與絕經后骨質疏松性腰椎骨折相關性分析*
霍少川,董路玨,唐宏宇,劉 勇,郭 海,陳建發,鄧章榮,陳德龍 ,王海彬△
(1.廣州中醫藥大學第三臨床醫學院,廣州 510405;2.廣州中醫藥大學第一臨床醫學院,廣州 510405;3.廣州中醫藥大學第一附屬醫院骨科中心,廣州 510405)
骨代謝生化指標與絕經后骨質疏松性腰椎骨折相關性分析*
霍少川1,董路玨2,唐宏宇3,劉 勇2,郭 海2,陳建發3,鄧章榮2,陳德龍2,王海彬3△
(1.廣州中醫藥大學第三臨床醫學院,廣州 510405;2.廣州中醫藥大學第一臨床醫學院,廣州 510405;3.廣州中醫藥大學第一附屬醫院骨科中心,廣州 510405)
目的 探討骨代謝生化指標與絕經后骨質疏松性腰椎骨折相關性,進而預測絕經后骨質疏松性合并腰椎骨折風險。方法 回顧性分析100例絕經后骨質疏松癥患者的臨床資料,包括絕經后骨質疏松癥腰椎無骨折患者50例和絕經后骨質疏松癥合并腰椎骨折患者50例,記錄并觀察髖部、腰椎骨密度、骨代謝生化標志物Ⅰ型前膠原氨基端前肽(P1NP)、Ⅰ型膠原羧基端肽β特殊序列(β-CTX)、骨鈣素N端中分子(N-MID)、25-羥基維生素D[25-(OH)VitD]和血清Ca2+。結果P1NP、β-CTX和25-(OH)VitD的差異具有統計學意義(P<0.05),絕經后骨質疏松性腰椎骨折與血清P1NP呈正相關(P<0.05),25-(OH)VitD呈負相關(P<0.05),β-CTX無相關性(P>0.05)。結論 骨代謝標志物P1NP、25-(OH)VitD能夠很好地預測絕經后骨質疏松腰椎骨折風險,骨密度預測骨質疏松癥骨折風險具有一定局限性。
骨質疏松,絕經后;絕經后期;骨密度;骨和骨組織;骨代謝生化指標;腰椎骨折
骨質疏松癥(osteoporosis,OP)是一種以骨量減少和骨微結構破壞為特征,以致骨強度下降,脆性增加,易于骨折的代謝性骨病綜合征。絕經后骨質疏松又稱Ⅰ型OP,一般好發于絕經后10年左右,臨床上以年齡為50~70歲的婦女多見。北美流行病學研究顯示,超過50歲的白種女性,各部位骨質疏松性骨折發生的風險為:髖部骨折17.5%,椎體骨折15.6%,前臂遠端骨折16.9%;男性相對應的風險分別為6.0%、5.0% 和3.0%[1]。因此,預防骨質疏松性骨折顯得尤為重要。骨代謝生化指標能動態監測全身骨代謝狀況,獨立于骨量和其他骨質疏松的風險因素,通過高水平表達反映全身骨轉換的增加與未來骨丟失的關系,能監測OP骨折的風險[2-3]。本試驗回顧性分析廣州中醫藥大學第一附屬醫院骨傷科住院的100例絕經后OP患者的臨床資料,探討骨代謝生化標志物與絕經后骨質疏松性腰椎骨折的相關性,現報道如下。
1 資料與方法
1.1 一般資料 回顧性分析2012年6月至2014年10月該院骨傷科收治的100例絕經后婦女的臨床資料,并將其分為絕經后OP腰椎骨折患者(觀察組)和絕經后OP腰椎無骨折患者(對照組),每組50例。觀察組因OP合并腰椎壓縮性骨折入院,平均年齡(64.48±4.88)歲;對照組因OP入院,平均年齡(63.12±4.08)歲。觀察組與對照組年齡、身高、體質量、BMI之間差異無統計學意義(P>0.05),具有可比性,見表1。所選對象均自然絕經,入院后給予臥床休息,對癥處理。所有患者無心、腦血管系統等嚴重原發性疾病,無糖尿病、甲狀旁腺功能亢進、類風濕性關節炎等代謝性疾病,無腰椎手術或卵巢摘除手術史。骨折患者均為新鮮骨折(<2周),排除車禍、高處跌落等嚴重創傷導致的腰椎壓縮性骨折患者。
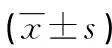
表1 兩組一般情況比較
1.2 方法
1.2.1 診斷標準 采用QDR4500 c/w雙能X射線骨密度檢測儀(HOLOGIC公司,美國)對患者髖部、腰椎進行測量,參照WHO在1998發布的OP診斷標準,絕經后婦女T值小于或等于-2.5 SD為絕經后OP。所有患者均自然絕經,骨密度降低程度符合OP診斷標準,入院腰椎X射線提示腰椎壓縮性骨折為絕經后骨質疏松性腰椎骨折。
1.2.2 雙能X射線骨密度檢測 采用雙能X射線骨密度檢測儀測定髖部、腰椎骨密度,取平均值。
1.2.3 骨代謝生化指標檢測 所有研究對象清晨空腹抽取靜脈血,應用鄰甲酚酞絡合酮法測定骨代謝生化標志物Ⅰ型前膠原氨基端前肽(procollagen type Ⅰ N-terminal propeptide,P1NP)、Ⅰ型膠原羧基端肽β特殊序列(β isomer of the C-terminal telopeptide of type Ⅰ collagen,β-CTX)、骨鈣素N端中分子(N-MID osteocalein,N-MID)、25-羥基維生素D(25-hydroxy vitamin D,25-(OH)VitD),試劑盒由中國中生北控生物科技有限公司提供(批號:140451),檢測儀器為美國羅氏公司生產的Cobas e601酶標儀。應用速率法檢測血清Ca2+,試劑盒由中國中生北控生物科技有限公司提供(批號:140611),檢測儀器為美國羅氏公司生產的Cobas 8000酶標儀。

2 結 果
2.1 骨密度比較 觀察組與對照組腰椎、髖部骨密度之間差異無統計學意義(P>0.05),見表2。
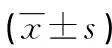
表2 兩組骨密度比較
2.2 骨代謝生化指標比較 觀察組與對照組血清P1NP、β-CTX、25-(OH)VitD之間的差異有統計學意義(P<0.05),血清N-MID和Ca2+水平的差異無統計學意義(P>0.05),見表3。
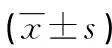
表3 兩組骨代謝生化指標比較
2.3 骨代謝生化指標與絕經后骨質疏松性腰椎骨折相關性分析 代入二分類Logistic回歸進行相關分析,絕經后骨質疏松性腰椎骨折與血清P1NP呈正相關(P<0.05),25-(OH)VitD呈負相關(P<0.05),β-CTX無相關性(P>0.05),見表4。
3 討 論
骨質疏松性骨折指原發性OP導致骨密度和骨質量下降,骨強度減低,受到輕微暴力即可發生的骨折,是OP最嚴重的后果[4]。骨質疏松的診斷以骨密度為基礎,因年齡和臨床中其他一些影響因素的原因,骨密度預測骨折絕對風險可能有所不同[5]。調整潛在混雜因素(如移動狀況)后,骨折的優勢比不改變,調整骨密度后,骨折優勢比稍微降低[6]。優勢比并不能很好地運用于臨床決策,因為骨折風險隨著年齡改變可能降低或保持穩定性。骨代謝生化指標能作為骨形成率或骨吸收率的替代標志物,相對于骨密度和臨床骨折風險因素具有額外的價值,其血清濃度反應骨重塑活性[7]。骨代謝生化標志物作為評估骨折風險的參數具有重要意義[8-10]。李新萍等[11]研究發現,椎體骨折后1周內P1NP上升與血磷、25-(OH)VitD、患者年齡呈直線相關關系。本研究發現絕經后骨質疏松性腰椎骨折患者與無骨折患者腰椎、髖部骨密度之間的差異無統計學意義(P>0.05),但是腰椎骨密度高于髖部,可能是腰椎退行性病變后骨質增生所致。同時,本研究認為采用骨代謝標志物預測骨折風險的準確性和骨折的時間具有關系,因此研究對象均選擇新鮮腰椎壓縮性骨折患者。
在形成纖維時,P1NP與Ⅰ型膠原分子等比例釋放入血,血清P1NP水平反應血清Ⅰ型膠原的含量,血清P1NP水平升高提示Ⅰ型膠原的合成速率加快,骨轉換活躍[12-13]。β-CTX是Ⅰ型膠原降解的特異性產物,當破骨細胞活性增強時,Ⅰ型膠原降解也增高,相應的β-CTX水平也隨之升高[14-15]。樓慧玲等[16]研究發現,在骨密度水平相近的老年OP患者中,Total-P1NP、β-CTX的增高及25-羥基維生素D3[25-(OH)VitD3]的降低有可能獨立預示髖部脆性骨折的風險增高。Mohamed等[17]研究發現,骨折風險僅與尿CTX的增加有關,與血清P1NP、β-CTX無相關性。可見,骨代謝生化指標預測骨質疏松骨折尚存在爭議。本研究結果顯示,絕經后骨質疏松腰椎骨折患者與非骨折患者血清P1NP、β-CTX具有明顯差異,其中血清P1NP與絕經后骨質疏松腰椎骨折具有相關性,β-CTX無相關性。
N-MID是一種由成骨細胞合成的結構蛋白,經過翻譯后加工生成羧化骨鈣素而參與骨骼發育[18]。鈣是整個生命期骨塑建和重建過程中骨質形成期所必需的元素,支持骨組織的發育和形成,人體99%的鈣以羥磷灰石結晶的形式存在骨骼中而發揮鈣庫作用[19-20]。維生素D的主要作用是促進腸鈣吸收,提高血鈣濃度,促進骨骼礦化[20]。本研究結果顯示絕經后骨質疏松腰椎骨折患者與非骨折患者血清25-(OH)VitD水平具有明顯差異,血清N-MID、Ca2+水平無差異,絕經后骨質疏松腰椎骨折與血清25-(OH)VitD具有相關性。雖然絕經后骨質疏松腰椎骨折患者在骨轉換方面有所不同,但是骨鈣含量無明顯改變,抗骨質疏松治療仍然有足夠的鈣為骨折的愈合提供基質。血清25-(OH)VitD水平受很多因素影響,如日照減少、皮膚老化、戶外活動缺乏、胃腸道消化吸收功能減弱等[20],本研究結果顯示其與絕經后骨質疏松性腰椎骨折具有相關性。
絕經后OP是高轉換率的骨代謝性疾病,骨密度預測OP骨折風險具有一定局限性,骨代謝生化指標能較好地預測骨質疏松骨折的發生。因此,在臨床中,對骨代謝生化指標高表達的OP患者應加強監管,合理宣教,減少骨折的發生。
[1]俞海燕,唐偉,王堯.骨質疏松性骨折風險預測方法的研究進展[J].中國骨質疏松雜志,2015,21(3):372-375.
[2]HannonRA,EastellR.Biochemicalmarkersofboneturnoverandfractureprediction[J].JBrMenopauseSoc,2003,9(1):10-15.
[3]VasikaranSD,ChubbSA.Theuseofbiochemicalmarkersofboneturnoverintheclinicalmanagementofprimaryandsecondaryosteoporosis[J].Endocrine,2016,52(2):222-225.
[4]中華醫學會骨科學分會.骨質疏松骨折診療指南[J].中國骨腫瘤骨病,2009,8(5):287-291.
[5]WeaverAA,BeaversKM,HightowerRC,etal.Lumbarbonemineraldensityphantomlesscomputedtomographymeasurementsandcorrelationwithageandfractureincidence[J].TrafficInjPrev,2015,16Suppl2:S153-160.
[6]GarneroP.Biomarkersforosteoporosismanagement:utilityindiagnosis,fractureriskpredictionandtherapymonitoring[J].MolDiagnTher,2008,12(3):157-170.
[7]LevineMA.Biochemicalmarkersofbonemetabolism:applicationtounderstandingboneremodelinginchildrenandadolescents[J].JPediatrEndocrinolMetab,2003,16Suppl3:S661-672.
[8]IkiM,AkibaT,MatsumotoT,etal.ReferencedatabaseofbiochemicalmarkersofboneturnoverfortheJapanesefemalepopulation.JapanesePopulation-basedOsteoporosis(JPOS)Study[J].OsteoporosInt,2004,15(12):981-991.
[9]ShigaT,TsujiY,FujiokaM,etal.RiskfactorsforhipfractureinJapaneseelderlywomenwithosteoporosis:applicabilityofbiochemicalmarkersinboneturnover[J].GeriatrGerontolInt,2009,9(1):69-74.
[10]SzulcP,DelmasPD.Biochemicalmarkersofboneturnover:potentialuseintheinvestigationandmanagementofpostmenopausalosteoporosis[J].OsteoporosIntern,2008,19(12):1683-1704.
[11]李新萍,劉曉艷,范斌,等.原發性骨質疏松患者椎體壓縮性骨折后骨轉換生化標志物的早期變化[J].中華骨質疏松和骨礦鹽疾病雜志,2015,8(4):305-311.
[12]張瑤,張維麗,馬威,等.補腎健脾湯對去卵巢骨質疏松模型大鼠骨代謝指標的影響[J].中華中醫藥雜志,2016,31(3):864-867.
[13]KregeJH,LaneNE,HarrisJM,etal.P1NPasabiologicalresponsemarkerduringteriparatidetreatmentforosteoporosis[J].OsteoporosInt,2014,6(5):128-132.
[14]闕文君,馮正平.骨轉換生化標志物的研究進展[J].中國骨質疏松雜志,2014,20(5):575-579.
[15]HerrmannM,SeibelMJ,SeibelM.Theamino-andcarboxyterminalcross-linkedtelopeptidesofcollagentypeⅠ,NTX-ⅠandCTX-Ⅰ:acomparativereview[J].ClinChimActa,2008,393(2):57-75.
[16]樓慧玲,彭程,陳巧聰.三種骨代謝標志物的測定在老年骨質疏松癥患者髖部脆性骨折中的臨床價值[J].南方醫科大學學報,2012,32(9):1346-1349.
[17]MohamedY,HaifaH,DatelO,etal.Theroleofbiochemicalmarkersofboneturnoverinthediagnosisofosteoporosisandpredictingfracturerisk[J].TunisMed,2014,92(5):304-310.
[18]王兮,鄭明慈.骨鈣素與骨質疏松[J].華夏醫學,2007,20(6):1430-1431.
[19]翁澤斌,顏翠萍,吳育,等.鹽制對杜仲治療去卵巢大鼠骨質疏松癥影響的研究[J].中國骨質疏松雜志,2014,20(12):1457-1463.
[20]黃琪仁.鈣,維生素D與原發性骨質疏松癥[J].中國實用婦科與產科雜志,2014,30(5):336-340.
Study of correlation between biochemical markers of bone metabolism and postmenopausal osteoporotic vertebral fractures*
HuoShaochuan1,DongLujue2,TangHongyu3,LiuYong2,GuoHai2,ChenJianfa3,DengZhangrong2,ChenDelong2,WangHaibin3△
(1.TheThirdClinicalMedicalCollegeofGuangzhouUniversityofTraditionalChineseMedicine,Guangzhou,Guangdong510405,China;2.TheFirstClinicalMedicalCollegeofGuangzhouUniversityofTraditionalChineseMedicine,Guangzhou,Guangdong510405,China;3.OrthopedicsCenter,theFirstAffiliatedHospitalofGuangzhouUniversityofTraditionalChineseMedicine,Guangzhou,Guangdong510405,China)
Objective To study correlation between biochemical markers of bone metabolism and postmenopausal osteoporotic vertebral fractures.Methods The clinical data of 100 cases with postmenopausal osteoporotic were study retrospectively.Fifty patients were postmenopausal osteoporotic,the rests were postmenopausal osteoporotic vertebral fractures.Lumbar spine,hip BMD,serum P1NP,β-CTX,N-MID,25-(OH)VitD and Ca2+were recorded.Results There was a significant difference among serum P1NP,β-CTX and 25-(OH)VitD(P<0.05).There was positive correlation between postmenopausal osteoporotic vertebral fracture with serum P1NP (P<0.05),and negative correlation with serum 25-(OH)VitD (P<0.05),but had no correlation with serum β-CTX (P>0.05).Conclusion Serum P1NP and 25-(OH)VitD could predict risk of postmenopausal osteoporotic vertebral fractures.Biochemical markers of bone metabolism combined with BMD could reduce postmenopausal osteoporosis fractures.
osteoporosis,postmenopausal;postmenopause;bone density;bone and bones;postmenopausal osteoporotic;vertebral fractures
??·臨床研究
10.3969/j.issn.1671-8348.2017.01.009
國家自然科學基金資助項目(81373655);廣東省省級科技計劃項目(2013B021800226)。
霍少川(1985-),在讀博士,主要從事原發性骨質疏松疾病基礎與臨床方面研究。△
E-mail:hipman@163.com。
R
A
1671-8348(2017)01-0048-03
2016-07-18
2016-08-17)

