多西環素對EAE大鼠Th1/Th2細胞平衡及相關細胞因子的影響
肖鳳娟,楊 元,許學杰,李作孝△
(1.四川綿陽四○四醫院神經內科 621000;2.西南醫科大學附屬醫院神經內科,四川瀘州 646000)
多西環素對EAE大鼠Th1/Th2細胞平衡及相關細胞因子的影響
肖鳳娟1,楊 元2,許學杰1,李作孝2△
(1.四川綿陽四○四醫院神經內科 621000;2.西南醫科大學附屬醫院神經內科,四川瀘州 646000)
目的 探討多西環素對實驗性變態反應性腦脊髓炎(EAE)大鼠模型Th1/Th2細胞平衡的影響。方法 將40只雌性Wistar大鼠分為EAE對照組及低、中、高劑量多西環素組,每組10只。觀察大鼠發病情況及發病高峰期外周血單個核細胞(PBMC)分泌白細胞介素(IL)-4、干擾素-γ(IFN-γ)水平,測定高峰期腦組織IL-1β、IL-10、腫瘤壞死因子α(TNF-α)水平及腦脊液和血清清蛋白水平,計算腦脊液與血清清蛋白比值(QA值)。結果 各劑量多西環素組大鼠臨床癥狀較EAE對照組均減輕。各劑量多西環素組大鼠發病高峰期外周血單個核細胞(PBMC)分泌IFN-γ水平和IFN-γ/IL-4比值均較EAE對照組降低,分泌IL-4水平均較EAE對照組升高(P<0.01);高劑量多西環素組IL-4水平較中劑量多西環素組增高差異無統計學意義(P>0.05),其余各劑量多西環素組間差異有統計學意義(P<0.01)。各劑量多西環素組大鼠發病高峰期腦組織IL-1β、TNF-α水平及QA值較EAE對照組降低,IL-10水平較EAE對照組升高(P<0.05)。隨多西環素劑量增加,各劑量多西環素組IL-1β、TNF-α水平及QA值越低,IL-10水平越高,且各組間差異有統計學意義(P<0.05)。結論 多西環素可明顯減輕EAE大鼠臨床癥狀,其機制可能與多西環素降低大鼠Th1細胞因子水平,升高Th2細胞因子水平,糾正Th1/Th2細胞平衡,從而保護血腦屏障有關。
實驗性變態反應性腦脊髓炎;多西環素;Th1細胞;Th2細胞;QA值;大鼠,Wistar
多發性硬化(multiple sclerosis,MS)是一種常見的中樞神經系統(CNS)多灶性、炎性、脫髓鞘性疾病,其發病兼有神經變性和免疫異常兩方面[1],但目前其具體的病因和發病機制仍不完全清楚,迄今也無肯定的有效治愈方法。而通過致敏抗原誘導敏感實驗動物發生的由T細胞介導的遲發型超敏反應型自身免疫疾病-實驗性變態反應性腦脊髓炎(experimental autoimmune encephalomyelitis,EAE),是目前國際上公認的研究MS的理想動物模型[2]。傳統觀點認為細胞免疫Thl/Th2平衡失調與MS和EAE發病密切相關,Thl細胞為炎癥促進細胞,分泌的白細胞介素(IL)-1 、IL-2、IL-6、腫瘤壞死因子-α (TNF-α)、干擾素-γ(IFN-γ)等細胞因子,能誘導巨噬細胞活化,激活T細胞反應,增強抗原-提呈作用;Th2細胞是炎癥抑制細胞,分泌的IL-4、IL-10等具有抗炎作用,可下調Th1型免疫應答反應并抑制其細胞因子產生[3]。Thl細胞免疫應答增強和Th2細胞免疫應答減弱是MS發病重要機制[4]。同時在此免疫功能失衡的狀態下,血腦屏障(blood brain barrier,BBB)的免疫屏障功能受到破壞,異常激活的T型免疫細胞及其細胞因子、血液中的蛋白等大分子成分則會通過受損的BBB進入CNS,進而成為腦脊液成分。因此,有學者認為,腦脊液蛋白含量可以較理想地反映BBB的狀態,血清清蛋白水平比值(QA值)與BBB通透性受損程度呈正相關[5]。
多西環素(doxycycline)作為半合成四環素類抗生素,不僅具有抗菌活性,在一定程度上也能抑制基質金屬蛋白酶(matrix metalloproteinases,MMPs)、中性粒細胞彈力蛋白酶、一氧化氮合成酶,同時還具有生物利用度高、高脂溶性、易透過BBB、安全性高等優點。本實驗旨在探究多西環素對EAE大鼠體內Th1/Th2細胞平衡的影響。
1 材料與方法
1.1 材料
1.1.1 實驗動物 雌性Wistar大鼠40只(四川大學華西實驗動物中心),6~8周齡,體質量(200±20)g;豚鼠6只(四川大學華西實驗動物中心),體質量(400±20)g。實驗前Wistar大鼠在西南醫科大學附屬醫院中心實驗室常規飼養1周。
1.1.2 實驗藥品及試劑 多西環素針劑購自海口康力元制藥有限公司;卡介苗(BCG)購自BD公司;不完全福氏佐劑(IFA)購自Sigma公司;IL-4、IL-10、IFN-γ酶聯免疫吸附試驗(ELISA)試劑盒購自晶美生物工程有限公司。
1.2 方法
1.2.1 EAE模型的制作 將Wistar大鼠分為4組:EAE對照組及低、中、高劑量多西環素組,每組10只。將BCG加入IFA制成含5 mg/mL BCG濃度的完全福氏佐劑。在大鼠四足掌膠質墊皮下注射完全福氏佐劑,每只0.5 mL。
1.2.2 模型干預 從造模前3天開始每天分別給予低、中、高劑量多西環素組多西環素5、10、20 mg·kg-1·d-1腹腔注射;EAE對照組予以相同劑量生理鹽水,連續10 d。
1.2.3 動物模型評價 每天定時對實驗大鼠進行神經功能障礙評分。評分標準:0分,未發病;1分,后肢輕度無力(尾巴無力);2分,中度后肢無力或輕度共濟失調;3分,中至重度后肢無力;4分,嚴重后肢無力;5分,中度以下四肢無力的截癱;6分,四肢全癱或嚴重共濟失調或者死亡[6-7]。
1.2.4 實驗終止 將大鼠在連續3 d癥狀評分無加重、四肢癱瘓或者大鼠死亡的發病高峰期處死,取大鼠腦脊液(CSF)、外周血和脾臟。
1.2.5 大鼠血清IL-4、IFN-γ水平測定 實驗終止時,每只Wistar大鼠經眶靜脈叢取血8~9 mL,用肝素抗凝后以2 000 r/min離心30 min,留取1/2血清保存于-20 ℃冰箱,按IL-4、IFN-γ ELISA試劑盒說明書檢測。
1.2.6 腦組織IL-1β、IL-10、TNF-α水平的測定 實驗終止時,取300~400 mg腦組織立即放入1 mL生理鹽水研磨成勻漿,在4 ℃以3 000 r/min離心15 min,留取上清液保存于-20 ℃,15 d內按IL-10 ELISA試劑盒說明書檢測IL-10水平,通過放射免疫法測定腦組織IL-1β、TNF-α水平。
1.2.7 CSF和QA值檢測 實驗終止時,將剩余1/2血清與腦脊液送至醫院檢驗科檢測清蛋白水平,并計算腦脊液與血清清蛋白比值即QA值。

2 結 果
2.1EAE對照組及各劑量多西環素組發病情況EAE對照組大鼠多在免疫后10d左右開始逐漸出現病情,如活動量減少、反應時間延長,繼而出現單側或雙側前后肢體無力、共濟失調、癱瘓甚至死亡。各劑量多西環素組實驗大鼠癥狀均較EAE組減輕,表現為潛伏期延長,進展期縮短,神經功能障礙評分減低。各劑量多西環素組并無大鼠死亡。
2.2 各組大鼠發病高峰期PBMC分泌INF-γ、IL-4水平及IFN-γ/IL-4比值 各劑量多西環素組大鼠發病高峰期PBMC分泌IFN-γ水平和IFN-γ/IL-4比值均較EAE對照組降低,分泌IL-4水平均較EAE對照組升高(P<0.01);高劑量多西環素組IL-4水平較中劑量多西環素組差異無統計學意義(P>0.05),其余各劑量多西環素組間差異有統計學意義(P<0.01),見表1。
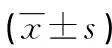
表1 各組發病高峰期PBMC分泌INF-γ、IL-4水平及IFN-γ/IL-4比值
a:P<0.01,與EAE對照組比較;b:P<0.01,與低劑量多西環素組比較;c:P<0.01,與中劑量多西環素組比較。
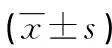
表2 各組大鼠發病高峰期腦組織IL-1β、IL-10、TNF-α水平
a:P<0.01,b:P<0.05,與EAE對照組比較;c:P<0.01,與低劑量多西環素組比較;d:P<0.01,與中劑量多西環素組比較。
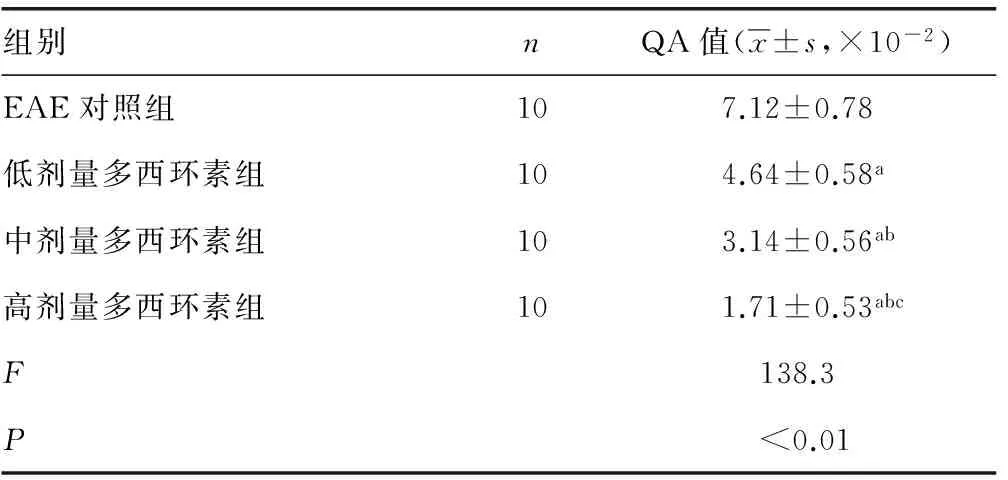
表3 各組大鼠發病高峰期QA值變化
a:P<0.01,與EAE對照組比較;b:P<0.01,與低劑量多西環素組比較;c:P<0.01,與中劑量多西環素組比較。
2.3 各組大鼠發病高峰期腦組織IL-1β、IL-10、TNF-α水平比較 各劑量多西環素組大鼠發病高峰期腦組織IL-1β、TNF-α水平較EAE對照組降低,IL-10水平較EAE對照組升高(P<0.05)。隨多西環素劑量增加,各劑量多西環素組IL-1β、TNF-α水平越低,IL-10水平越高,各多西環素組組間差異有統計學意義(P<0.05),見表2。
2.4 各組大鼠發病高峰期QA值比較 各劑量多西環素組大鼠發病高峰期QA值較EAE對照組明顯降低(P<0.01),隨多西環素劑量增加,各劑量多西環素組大鼠腦組織QA值水平越低,各多西環素組間差異有統計學意義(P<0.05),見表3。
3 討 論
已有的研究發現,MS是在易感基因和環境因素共同作用下誘發的異常自身免疫應答在CNS的表現,包括血腦屏障破壞,髓鞘蛋白破壞,T細胞過度激活,少突膠質細胞修復減弱等[8-9]。大量研究證實,EAE是細胞免疫和體液免疫共同參與的復雜免疫病理過程,是由因IFN-γ介導的Th1型免疫反應過強,導致Thl/Th2免疫平衡失調[10]。Th1型免疫反應增強的同時伴隨Th1型細胞因子激活,后者能明顯上調BBB內皮黏附分子的表達,誘導激活的T細胞粘連、入侵BBB,且活化的免疫成分能通過激活MMPs,降解構成BBB的層黏蛋白、血管內皮基底膜等,進一步破壞BBB[11-12]。有研究顯示,QA值作為評估BBB功能受損的指標,在EAE病程早期已開始升高,且隨著病程的進展、臨床癥狀的逐漸加重,QA值升高越明顯,提示QA值與BBB受損程度有關[13]。
Th1細胞因子(IL-1、TNF-α、IFN-γ)是一類炎性細胞因子,其中的IL-1目前認為是參與最初免疫反應的,在其增強機體免疫防御功能的同時也啟動了炎癥反應和組織損傷,并在神經免疫軸中起關鍵作用,循環中的IL-1活性大多來源于IL-1β。IL-1β能通過誘導MMP-9表達間接破壞BBB、介導髓鞘降解、誘導少突膠質細胞凋亡[14]。Cantagrel等[15]研究發現,通過降低IL-1基因表達或敲除IL-1基因可減輕EAE病情的嚴重性,提示體內IL-1水平與疾病的嚴重程度相關。TNF-α可促進星形膠質細胞分化、誘導少突膠質細胞凋亡、抑制髓鞘形成;TNF-α也可誘導內皮細胞分泌黏附分子,增加BBB通透性;同時TNF-α可協同INF-γ誘導抗原提呈細胞的MHC-Ⅱ抗原表達,并能誘導IL-1活化、促進IFN-γ產生[16-17]。Sun等[18]實驗發現,將TNF-α注入實驗大鼠大腦半球可加重EAE大鼠病情。IFN-γ在Th0細胞分化時,可促進其向Th1細胞分化,弱化Th2細胞分化,打破Th0細胞的分化平衡。在EAE活動期,IFN-γ可通過強化抗原-提呈作用、激活T細胞、增強淋巴毒素釋放破壞髓鞘[19]。在MS發病中,IFN-γ可誘導巨噬細胞產生IL-1,并與IL-1協同作用于星形細胞分泌TNF-α[20]。
Th2細胞因子(IL-4、IL-10)是炎癥抑制因子,IL-4可誘導Th0細胞向Th2細胞分化增強,并促進B細胞增殖、分化、分泌抗體,誘導免疫耐受;同時也能抑制Th1細胞分化并下調其功能[21]。Bai等[22]研究發現,通過鼻黏膜途徑給予髓磷脂堿性蛋白(MBP)誘導EAE大鼠免疫耐受,促進Th2細胞分泌IL-4,能緩解EAE大鼠癥狀、預防復發。IL-10能抑制抗原提呈作用和抗原特異性T細胞的作用,協同刺激因子,增強Th2細胞的免疫調節功能,抑制Th1細胞分泌IL-6、TNF-α[23]。Sonobe等[24]發現,在EAE大鼠發病時脾臟CD4+、CD8+T細胞IL-10mRNA表達下降,在疾病恢復期IL-10mRNA表達開始上調,認為調節性T細胞發揮免疫調節功能是來源于IL-10。
Minagar等[25]研究顯示,多西環素可抑制IFN-γ、IL-1等炎性因子的表達,其機制可能是通過阻斷細胞因子轉錄后過程實現的。Su等[26]在研究小鼠全身過敏反應時發現,多西環素可通過抑制P13K/Akt/eNOS/VE-鈣黏蛋白通路下調TNF-α、IFN-γ等炎性因子的分泌水平、促進抑炎因子IL-4產生。而IFN-γ等炎性因子在EAE發病中分泌增強,不僅能抑制Th2細胞分化,下調Th2型抑炎因子水平,還可通過激活MMPs加重BBB的損傷和CNS的炎性變態反應。因而,多西環素通過抑制IFN-γ等炎性因子的活化,上調IL-4等抑炎因子水平,可間接抑制MMPs的激活,從而減輕BBB的破壞。本實驗顯示:在EAE的發病中,多西環素可抑制Th1型細胞因子分泌,促進Th2型細胞因子分泌,糾正Th1/Th2細胞平衡紊亂,保護BBB,從而對EAE的發病起防治作用。
Th1/Th2細胞免疫失衡在EAE發病中起重要作用,而多西環素可通過抑制Th1型細胞因子產生,促進Th2型細胞因子分泌,糾正Th1/Th2免疫平衡紊亂,從而減輕BBB的受損,其可能是EAE與MS治療的一種有效途徑。本實驗研究為多西環素在以后神經病學臨床應用提供一定的理論依據。
[1]GoldSM,VoskuhlRR.Estrogenandtestosteronetherapiesinmultiplesclerosis[J].ProgBrainRes,2009,175(9):239-251.
[2]MancardiG,HartBA,CapelloE,etal.RestrictedimmuneresponsesleadtoCNSdemyelinationandaxonaldamage[J].JNeuroimmunol,2000,107(2):178-183.
[3]JagessarSA,HeijmansN,BlezerEL,etal.UnravellingtheT-cell-mediatedautoimmuneattackonCNSmyelininanewPrimateEAEmodelinducedwithMOG34-56peptideinincompleteadjuvant[J].EurJImmunol,2012,42(1):217-227.
[4]CantornaMT,WoodwardWD,HayesCE,etal.1,25-dihydroxyvitaminD3isapositiveregulatorforthetwoanti-encephalitogeniccytokinesTGF-beta1andIL-4[J].JImmunol,1998,160(11):5314-5319.
[5]VirgintinoD,RobertsonD,BenagianoV,etal.Immunogoldcytochemis-tryoftheblood-brainbarrierglucosetransporterGLUT1andendogenousalbumininthedevelopinghumanbrain[J].BrainResDevBrainRes,2000,123(1):95.
[6]BaetenK,AdriaensensP,HendriksJ,etal.Trackingofmyelin-reactiveTcellsinexperimentalautoimmuneencephalomyelitis(EAE)animalsusingsmallparticlesofIronoxideandMRI[J].NMRBiomed,2010,23(6):601-609.
[7]CorrêaJO,AarestrupBJ,AarestrupFM.EffectofThalidomideandpentoxifyllineonexperimentalautoimmuneencephalomyelitis(EAE)[J].ExpNeurol,2010,226(1):15-23.
[8]SternEB.Amind“surroundedbyamoat”:afirst-personaccountofcognitiveimpairmentinmultiplesclerosis[J].CognBehavNeurol,2011,24(4):217-226.
[9]PietrolongoE,GiordanoA,KleinefeldM,etal.Decision-makinginmultiplesclerosisconsultationsinItaly:thirdobserverandpatientassessments[J].PLoSOne,2013,8(4):e60721.
[10]LinkerRA,LühderF,KallenKJ,etal.IL-6transsignallingmodulatestheearlyeffectorphaseofEAEandtargetstheblood-brainbarrier[J].JNeuroimmunol,2008,205(1/2):64-72.
[11]ShiryaevSA,SavinovAY,CieplakP,etal.Matrixmetalloproteinaseproteolysisofthemyelinbasicproteinisoformsisasourceofimmunogenicpeptidesinautoimmunemultiplesclerosis[J].PLoSOne,2009,3(4):e4952.
[12]FainardiE,CastellazziM,BelliniT,etal.Cerebrospinalfluidandserumlevelsandintrathecalproductionofactivematrixmetalloproteinase-9 (MMP-9)asmarkersofdiseaseactivityinpatientswithmultiplesclerosis[J].MultScler,2007,13(5):687-690.
[13]PratA,BiemackiK,LavoiJF,etal.Migrationofmultiplesclerosislymphocytesthroughbrainendothelium[J].ArchNeurol,2002(59):391-397.
[14]TomiokaR,MatsuiM.Biomarkersformultiplesclerosis[J].InternMed,2014,53(5):361-365.
[15]CantagrelA,NavauxF,NourhashemiF,etal.Interleukin-1β,interleukin-1receptorantagonist,interleukin-24,andinterleukin-10genepolymorphisms[J].ArthritisRheum,1999,42(6):1093-1100.
[16]孫雅菲,高娟,檀國軍,等.阿托伐他汀對實驗性變態反應性腦脊髓炎大鼠TNF-α和iNOS表達的影響[J].中國神經精神疾病雜志,2007,33(9):533-536.
[17]李婛,曾麗,鄒東華.外源性雄激素對EAE大鼠血中CD4+CD25+T細胞的影響[J].中國神經精神疾病雜志,2008,34(2):115-117.
[18]SunD,NewmanTA,PerryVH,etal.Cytokine-inducedenhancementofautoimmuneinflammationinthebrainandspinalcord:implicationsformultiplesclerosis[J].NeuropatholApplNeurobiol,2004,30(4):374-384.
[19]IvanovH,MckenzieBS,ZhouL,etal.TheorphannuclearreceptorRORgammatdirectsthedifferentiationprogramofproinflammatoryIL-17+Thelpercells[J].Cell,2006(126):1121-1133.
[20]ChungIY,NorrisJG,BenvenisteEN.Differentialtumornecrosisfactoralphaexpressionbyastrocytesfromexperimentalallergicencephalomyelitis-susceptibleand-resistantratstrains[J].JExpMed,1991,173(4):801-811.
[21]KeatingP,O′sullivanD,TierneyJB,etal.ProtectionfromEAEbyIL-4Ralpha(-/-)macrophagesdependsuponTregulatorycellinvolvement[J].ImmunolCellBiol,2009,87(7):534-545.
[22]BaiXF,ShiFD,XiaoBG,etal.NasaladministrationofmyelinbasicproteinpreventsrelapsingexperimentalautoimmuneencephalomyelitisinDAratsbyactivatingregulatorycellsexpressingIL-4andTGF-betamRNA[J].JNeuroimmunol,1997,80(1/2):65-75.
[23]MesZ,StemJN,ReddyJ,etal.Modifiedaminoacidcopolymerssuppressmyelinbasicprotein85-99-inducedencephalomyelitisinhumanizedmicethroughdifferenteffectsonTcells[J].PNAS,2004,101(32):11749-11754.
[24]SonobeY,JinS,WangJ,etal.ChronologicalchangesofCD4+andCD8+Tcellsubsetsintheexperimentalautoimmuneencephalomyelitis,amousemodelofmultiplesclerosis[J].TohokuJExpMed,2007,213(4):329-339.
[25]MinagarA,AlexanderJS,SchwendimannRN,etal.Combinationtherapywithinterferonbeta-1aanddoxycyclineinmultiplesclerosis:anopen-labeltrial[J].ArchNeurol,2008,65(2):199-204.
[26]SuW,WanQ,HanL,etal.Doxycyclineexertsmultipleanti-allergyeffectstoattenuatemurineallergicconjunctivitisandsystemicanaphylaxis[J].BiochemPharmacol,2014,91(3):359-368.
Effect of doxycycline on Th1/Th2 cell balance and related cytokines in experimental allergic encephalomyelitis rats
XiaoFengjuan1,YangYuan2,XuXuejie1,LiZuoxiao2△
(1.DepartmentofNeurology,Mianyang404Hospital,Mianyang,Sichuan621000,China;2.DepartmentofNeurology,AffiliatedHospital,SouthwestMedicalUniversity,Luzhou,Sichuan646000,China)
Objective To investigate the effect of doxycycline on the Th1/Th2 cell balance in experimental allergic encephalomyelitis(EAE) rats.Methods Forty female Wistar rats were randomly divided into the EAE control group,low,medium and high does DOX treatment groups,10 cases in each group.The onset situation in rats was observed.The IL-4 and IFN-γ levels secreted by peripheral blood mononuclear cells (PBMC) at the peak stage were detected.The levels of IL-1β,IL-10,TNF-α in brain tissue,and the albumin content in cerebrospinal fluid and serum were detected.The QA value was calculated.Results In each DOX group,the clinical symptoms of rats were alleviated compared with the EAE control group.In each DOX group,the PBMC secreting IFN-γ level and IFN-γ/IL-4 ratio in the onset peak stage were lower than those in the EAE control group,while the IL-4 level was higher than that in the EAE control group(P<0.01).Compared with the medium-dose DOX group,the increase of IL-4 level in the high-dose DO group was unapparent(P>0.05),but the difference between other DOX groups had statistical significance(P<0.01).The IL-1β and TNF-α levels of brain tissue and QA value during onset peak stage in various doses DOX groups were decreased compared with the EAE control group,while the IL-10 level was increased compared with the EAE control group(P<0.05).With the DOX dose increasing,the levels of IL-1β,TNF-α and QA value in various doses DOX groups became lower,the IL-10 level became higher,there was statistically significant difference among various doses DOX groups (P <0.05 ).Conclusion DOX can obviously alleviate the clinical symptoms of EAE rats,its mechanism may be related with that DOX could decrease the level of Th1 cytokine and increase the level of Th2 cytokine,correct the Th1/Th2 cell balance,thus protect the blood brain barrier(BBB).
experimental allergic encephalomyelitis;doxycycline;Th1 cell;Th2 cell;QA;rats,Wistar
肖鳳娟(1989-),碩士,主要從事神經免疫方面研究。△
E-mail:363373429qq.com。
??·基礎研究
10.3969/j.issn.1671-8348.2017.01.008
R
A
1671-8348(2017)01-0044-04
2016-07-18
2016-08-18)

