不同地理種源丹參組培快繁及再生苗性狀差異比較
蘭英++柳敏++嚴鑄云++謝惠慶++沈曉鳳++張禮++林嬋春


doi:10.15889/j.issn.1002-1302.2016.10.024
摘要:建立不同地理種源丹參(四川、山東、河南)組織培養條件,比較其組培苗及大田栽種后植株間的生物學性狀差異。以不同地理種源盆栽丹參莖尖嫩葉為外植體,經70%的乙醇處理10 s后,再用2%的NaClO溶液滅菌20 min效果較好,污染率僅為5%。葉片愈傷組織的誘導及繼代增殖最適培養基為MS+2.0 mg/L 6-BA+1.0 mg/L NAA,出愈率達到96.7%;芽分化的最佳激素條件為1.0 mg/L 6-BA+0.1 mg/L NAA;幼苗生根的適宜培養基為1/2MS+0.2 mg/L NAA+0.5 mg/L IBA,生根率為94%。結果顯示不同地理種源丹參組培苗及大田栽培后植株間根部特征、株高、葉形及開花與否均有較大差異。這為進一步探索3個種源丹參根系分泌物的差異及其與品質形成的關系提供了依據。
關鍵詞:丹參;組培快繁;植株再生;生物學性狀
中圖分類號: S567.5+30.43文獻標志碼: A文章編號:1002-1302(2016)10-0103-05
收稿日期:2015-08-13
基金項目:國家自然科學基金(編號:81173493)。
作者簡介:蘭英,女,重慶人,碩士研究生,主要從事中藥資源與開發利用研究。E-mail:961269730@qq.com。
通信作者:嚴鑄云,教授,博士生導師,主要從事道地藥材品質形成與調控研究。E-mail:cdtcmyan@126.com。丹參為唇形科鼠尾草屬植物丹參(Salvia miltiorrhiza Bge.)的干燥根及根莖,具有活血化瘀、消腫止痛、養血安神的功能,是常用的重要中藥[1];廣泛分布于四川、河南、山東、安徽、陜西等省區,具有較強的土壤適應性[2]。前期研究結果表明,不同產地丹參栽培中普遍存在連作障礙及病毒積累等問題,而其有效成分含量差異明顯,這與其遺傳特性有關[3-4]。本試驗以3個不同地理種源的丹參植株為材料,利用組織培養具備繁殖速度快、脫除病毒且保證植株遺傳穩定性等優勢,建立山東臨朐、河南方城、四川中江3個種源丹參的組培快繁體系,實現對3種不同丹參組培苗的快速繁殖,并將試管苗移栽于四川中江進行大田培育,比較其生物學性狀的差異,為后期探索不同丹參遺傳特性與其藥材品質形成的關系提供依據。
1材料與方法
1.1試驗材料
丹參種源于2012年12月分別采自四川省中江縣石泉鄉、山東省臨朐縣呂匣鎮、河南省方城縣拐河鎮3個不同產區,根段繁殖,翌年開花后,經鑒定均為唇形科植物丹參(Salvia miltiorrhiza Bge.)。
1.2儀器與試劑
儀器:SW-CJ-1F 超凈工作臺(江蘇蘇凈集團有限公司),JA5003電子天平(上海良平儀器儀表有限公司),MLS-3020自動高壓滅菌鍋(日本三洋公司),PHS-3C+ 酸度計(成都世紀方舟科技有限公司),MLR-350HT組培箱(日本三洋公司)。
試劑:MS培養基(杭州臨安木木生物技術有限公司,批號20120701),6-BA(濟南昊天科技發展有限公司,批號20110603),NAA(濟南昊天科技發展有限公司,批號20110607),2,4-D(濟南昊天科技發展有限公司,批號20101107),維生素B1(成都市科龍化工試劑廠 批號20111023),蔗糖(成都市科龍化工試劑廠,批號20090610),瓊脂粉(成都市科龍化工試劑廠,批號20111001),蒸餾水。
1.3試驗方法
1.3.1無菌外植體的獲得取樣前將丹參植株移至室內培養1周后,采取植株莖尖1~2片新葉,用無菌紗布包裹置于自來水下沖洗1 h。將沖好的嫩葉用無菌水洗滌5次后置于超凈工作臺中,先后用70%的乙醇和2%的NaClO溶液進行不同時間的滅菌處理,期間不斷攪拌使葉片與消毒液充分接觸[5-6]。最后用無菌水沖洗4次后切塊接種于培養基上。1周后統計其滅菌后的生長狀況及污染率,篩選出最佳的滅菌時間組合。污染率=污染數/接種數×100%[7]。
1.3.2丹參愈傷組織的誘導及增殖培養將滅菌好的嫩葉剪成約0.5 cm×0.5 cm的小塊,并用解剖刀輕輕將其表面劃傷,背接(背面向上)于附加不同濃度生長素(NAA、2,4-D)和細胞分裂素(6-BA)配比的MS培養基上(含蔗糖3%、瓊脂0.7%,pH 5.8~6.0,121 ℃、1.1 kg/cm2條件下滅菌 15 min)。每種處理培養10瓶,每瓶接種3塊,培養5 d后將無菌的組織塊接入新的培養基上培養。于(25±2) ℃下黑暗培養,每隔5 d對其生長狀況進行觀察,20 d后統計誘導出愈傷組織的外植體數并計算誘導率,同時記錄愈傷組織的顏色、質地和生長情況。愈傷組織誘導率按出愈率計算,公式如下[7]:
出愈率=[無污染愈傷組織數/(總接種數-污染數)]×100%。
將上述已分化愈傷組織分割成大小約0.5 cm×0.5 cm的小塊后,轉移到與誘導愈傷相同激素比例的增殖培養基中,于(25±2) ℃黑暗條件下繼代培養。
1.3.3叢生芽的誘導將愈傷組織分割成大小約0.5 cm×0.5 cm 的小塊后,轉移到附加不同濃度生長素(NAA)和細胞分裂素(6-BA)的MS增殖培養基中(培養基組成同“1.2.2”節)。溫度(25±2) ℃、光照度2 000~3 000 lx、光照時間 11 h/d 條件下培養,20 d后記錄叢生芽生長狀態。
1.3.4根的發生取增殖培養中生長的丹參無根苗莖尖端2~3 cm,同時將未分化成苗的芽叢分割成單芽,接種到附加不同濃度的NAA 和IBA的1/2MS生根培養基中(含蔗糖 1.5%、瓊脂0.8%,pH 5.8~6.0,121 ℃、1.1 kg/cm2條件下滅菌15 min)。以不添加任何激素的1/2MS為對照培養基。培養條件同上述處理。統計各種激素條件下2種材料的最早生根時間,并在培養25 d后統計其生根率并記錄生長狀況。生根率計算公式如下:
生根率=[形成根的苗數/(接種數-污染數)]×100%。
將采自同一植株的河南方城和四川中江丹參外植體按最佳滅菌條件滅菌后,接種于山東臨朐丹參組培中各階段優化的最佳培養基上,于同樣條件下進行培養,以期獲得3個不同地理種源的丹參無菌組培苗,比較其性狀的差異。至根長至5~8 cm時取出組培苗,洗凈根部培養基后,移栽于含滅菌基質(腐殖土 ∶珍珠巖比例為3 ∶1)的育苗杯中室內光照煉苗。成活后移栽到四川省中江縣石泉鄉進行大田栽培,不同種源丹參以相同方式管理。于栽種1個月后統計其幼苗存活率,并分別補苗以保證各種源丹參幼苗35株以上。定期觀察不同地理種源丹參大田栽培的植株生物學性狀差異。
2結果與分析
2.1丹參外植體的最佳滅菌條件
取同一丹參植株切根繁殖的丹參苗莖尖嫩葉為組培外植體,按“1.3.1”節的步驟進行不同滅菌時間的處理后接種于不含激素的MS培養基上(同“1.3.2”節)。其滅菌情況及丹參葉片生長狀態見表1。
盆栽丹參莖尖嫩葉因暴露于空氣中易被微生物污染,在置入培養基之前必須經過表面滅菌,但不同滅菌劑、滅菌濃度及滅菌時間的滅菌效果不一樣,且表面滅菌劑對植物組織會有一定的傷害作用。文獻報道多以氯化汞作為滅菌劑[8-9],考慮到氯化汞雖具有較好的滅菌效果,但毒性較大,易損傷外植體,且滅菌后難以除去,因此本試驗中以70%的乙醇溶液和2% NaClO組合滅菌。從表1可以看出,先用70%的乙醇處理10 s后再用2%的NaClO溶液滅菌20 min效果最好,污染率僅為5%。其他滅菌時間均不理想。
2.2外源激素對愈傷組織形成的誘導
將滅菌好的組織塊分別接種到6-BA、NAA、2,4-D不同濃度組合的培養基上,25 d后統計愈傷組織誘導率,結果見表2。
從表2可見,不同外源激素和相同外源激素的不同比例處理時,外植體的生長情況有較大差異,當用6-BA單因素處理時,隨著濃度的增加,外植體增長較快且芽的分化率較高,同時有的葉片在接觸培養基的部位可不經過明顯的愈傷組織階段而直接分化出芽,表明細胞分裂素可明顯促進芽的分化及生長。將6-BA與NAA配合使用,在適宜濃度下培養7 d左右,可見葉片皺縮增大,中部隆起,葉緣及切口處開始膨大,葉片顏色變淺,外植體進入脫分化階段(圖1-A)。至15 d時,整個葉片呈黃白色,切口處形成無固定形態的細胞團,并有少量不定芽形成(圖1-B)。30 d時葉片基本完全脫分化形成愈傷組織,具少數叢生芽(圖1-C)。最佳的激素組合是2.0 mg/L 6-BA+1.0 mg/L NAA,出愈率達到967%。生長素濃度過低時葉片脫分化較緩慢, 可見生長素在葉片脫分化過程中起著至關重要的作用。這可能與生長素可啟動細胞中DNA的轉錄與翻譯,活化細胞代謝,啟動細胞分裂有關。6-BA與2,4-D搭配使用,外植體未明顯長大且形成少量愈傷組織,培養過程中逐漸褐化、死亡。這可能是因為2,4-D誘導愈傷組織中的多酚氧化酶活性升高,或是對外植體的毒害作用導致其褐化[10]。
2.3外源激素對芽分化的誘導
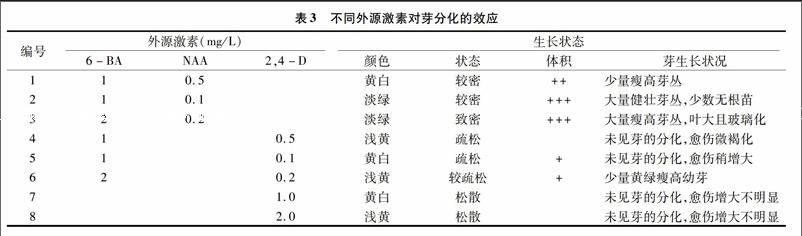
愈傷組織分割成約0.5×0.5 cm2的小塊后,轉移到 6-BA、NAA和2,4-D不同組合的培養基上繼續培養,20 d后觀察組織塊的生長狀態,結果見表3。
從表3可見,6-BA與NAA組合應用時,可促進愈傷組織的生長,且當6-BA與NAA濃度比值較大時可明顯地誘導愈傷組織分化產生叢生芽,甚至長成無根幼苗,這與Skoog提出的細胞分裂素和生長素比例較高時利于芽生長,而比值較低時有利于根的分化相一致。但1 mg/L 6-BA+0.1 mg/L NAA與2 mg/L 6-BA+0.2 mg/L NAA組合試驗中發現,高濃度誘導的叢生芽分化較快,玻璃化嚴重而變脆,芽叢葉片大而密集,生根培養難以成活。且激素用量較大會增大植株的變異概率,不利于保持試管苗的遺傳穩定性[11]。而低濃度組合誘導叢生芽生長正常,且有少數無根苗(圖1-D)。相同比例的6-BA和2,4-D搭配后加入到增殖培養基中,未見芽的分化,愈傷組織增大不明顯,但愈傷組織呈疏松的黃白色。可見,2,4-D并不能誘導愈傷組織分化出芽叢,甚至抑制了6-BA的誘導效果,但明顯地改善了其生長狀態,這有利于在懸浮培養時得到均一分散的細胞懸浮液。因此在叢生芽的誘導時,以1.0 mg/L 6-BA與0.1 mg/L NAA配合使用效果更佳,這與李明軍等報道的裕丹參愈傷組織誘導最佳激素比相同[12]。而當需要將培養的愈傷組織進行細胞懸浮培養時,可考慮將生長良好的愈傷組織塊接種于含1.0 mg/L 6-BA和0.1 mg/L 2,4-D的培養基上預培養一段時間,待愈傷組織呈疏松易分散狀態時再進行懸浮培養,可獲得較好的效果。
2.4外源激素對根發生的影響
將2~3 cm的無根苗莖尖及幼芽分別接種于NAA與IBA不同組合的培養基上誘導生根,總共設計5組激素組合,觀察不同激素條件下最早的生根時間、生根率及根和幼苗的生長情況,結果見表4。
將芽和無根苗接種到同樣的培養基上誘導生根時,大多幼芽均基部褐化死亡,而無根幼苗的莖尖多數能產生根,說明丹參無根苗比幼芽更容易生根。這可能是由于幼芽分化程度相對較低,其內源激素水平及對外界環境的適應力較差,使其不能正常分化產生根,而丹參苗具有完整的頂芽、葉片,有較強的適應能力,能合成自身所需的生長素,從而促進莖的基部生根。因此,在生根培養時以無根苗的莖尖扦插可提高成活率。當以NAA和IBA配合使用誘導生根時,比值較高時則會誘導產生不正常幼根,表面微褐化,極易脫落,最早生根時間較長,且移栽成活率低;比值較低時則可誘導產生較多幼根,其中最佳組合為0.2 mg/L NAA+0.5 mg/L IBA,最早生根,且生根率達 94%(圖1-E)。而當單獨使用 0.5 mg/L IBA時,雖誘導生根較快,但苗瘦高,移栽時易受損傷而難以成活。試驗中未添加激素的空白組也能誘導無根苗生根,但較為緩慢, 生根率較低,這可能是其內源激素促進其自發生根,與蔡朝暉等的試驗現象相同[13]。
2.5不同種源丹參組培苗的性狀比較
3個不同種源的丹參外植體均能適應優選的最佳組培條件,實現丹參無菌組培苗的快速繁殖,但不同種源丹參組培苗性狀及移栽成活率有所不同(表5)。于四川省中江縣石泉鄉大田栽培后,不同種源丹參植株生物學性狀差異較大(表6、圖2、圖3)。
雖然3個不同種源丹參的遺傳特性有所不同,但試驗中篩選的最佳組培條件成功應用于3種丹參的組培快繁,說明所獲得的最佳激素比例具較廣適用性,可用于丹參無菌組培苗的大量繁育。但經四川中江大田栽培存活率均較低,可能與丹參組培苗過于幼小及一直處于室內環境煉苗有關,建議后期大田移栽前進行室外煉苗以增強組培苗的適應能力。河南方城丹參組培苗存活率最高(64.7%),其次是四川中江組培苗(42.2%),山東臨朐組培苗最低(37.5%)。這與不同種源丹參組培苗的性狀也有關,四川中江丹參組培苗雖較瘦高,但根多,且其外植體本身來源于當地栽培的丹參植株,因此移栽后仍具較強的適應性,苗成活率較高;河南方城丹參組培苗根多且較粗,莖較粗壯,適應性強,成活率高;而山東臨朐丹參組培苗根少,成活率最低。開花期,發現山東與河南丹參第一年均不開花,這與當地丹參栽培情況相同,而于藥植園進行多年栽培發現,山東、河南丹參第二年均開花,可能與其“生理記憶”相關。收獲期,山東臨朐丹參根結線蟲病極嚴重,呈紅色,而河南臨朐和四川中江丹參均無根結線蟲病發生,但根呈淺紅色,部分呈紅白相間。其根顏色的變化和發病情況是否與藥材有效成分含量及植株本身的抗病性有關,還有待進一步研究。
3討論
植物組織培養中影響因素很多,有物種的遺傳特性及生理狀態,植株的基因型及所處的發育階段等內在因素,也包括激素、碳源、氮源、誘導因子等化學因素及光照、濕度、溫度等物理因素,還有共生菌等生物因素,均會影響植物組織培養的難易程度[14-17]。無菌外植體的獲得是建立無菌體系的關鍵,外源激素是誘導外植體分化的重要因素[11]。因此,本試驗著重對其滅菌條件及組培各階段的最佳激素組合進行優化,并以不同地理種源的同一丹參植株為材料,以避免不同植株間的遺傳變異,同時獲得適應3個不同種源丹參組培快繁的最佳培養條件,實現丹參組培苗的快速繁殖。
不同丹參的差異性比較多見于不同種質間[18],或者與人工誘導多倍體植株間的對比[19],而不同地理種源丹參組培苗大田栽培過程中的生物學性狀差異未見報道。研究發現,不同產地的野生丹參,其生物學性狀并不完全一致,如遼寧丹參復葉為3出,少數5出,花冠深藍紫色,冠幅平均34.6 cm;陜西商洛丹參復葉變化較大,為3~7出,花冠藍紫色,冠幅478 cm[18]。同一野生丹參與其組培再生苗相比,其株高、冠幅、葉片等均有較大差異,有些變異甚至超出生態型的變異范圍[20]。可見,產地不同、生長環境不同均會造成物種部分生物學性狀變異。本研究同樣發現不同地理種源丹參組培苗間及大田栽培植株間均有一定差異,這些差異是否穩定傳遞,并與其丹參藥材的產量及有效成分的積累有關,還需進一步觀察研究。
參考文獻:
[1]國家藥典委員會. 中華人民共和國藥典:一部[M]. 北京:中國中醫藥出版社,2015.
[2]彭成. 中華道地藥材[M]. 北京:中國中醫藥出版社,2011:892-893.
[3]楊新杰,萬德光,林貴兵,等. 丹參脂溶性成分的地域分布特點分析[J]. 中草藥,2010,41(5):809-813.
[4]楊新杰,萬德光,劉敏,等. 丹參水溶性成分的地域分布特點分析[J]. 天然藥物研究與利用,2011,23(4):684-688.
[5]杜雪玲,張振霞,余如剛,等. 植物組織培養中的污染成因及其預防[J]. 草業科學,2005,22(1):24-27.
[6]周建國,劉珊珊,毛志遠,等. 丹參組織培養技術的初步研究[J]. 食品與藥品,2015,17(2):93-95.
[7]蔡月琴,陸鑾眉,黃志丹,等. 火焰樹的組織培養與快速繁殖[J]. 植物生理學報,2015,51(5):709-714.
[8]劉學安. 丹參組織培養技術研究及組培苗生產試驗[D]. 四川農業大學,2004:1-28.
[9]柳福智,董娟娥,梁宗鎖. 不同生長調節物質對丹參愈傷組織的誘導效應[J]. 中國農學通報,2005,21(11):202-204.
[10]胡彥,趙艷. 植物組織培養技術的應用以及在培養過程中存在的問題[J]. 陜西師范大學學報:自然科學版,2004,32(增刊1):130-134.
[11]潘瑞熾. 植物生理學[M]. 高等教育出版社,1995.
[12]李明軍,劉杰,周娜,等. 裕丹參愈傷組織誘導、繼代及植株再生的研究[J]. 中草藥,2008,39(7):1078-1081.
[13]蔡朝暉,高山林,徐德然. 丹參組織培養快速繁殖技術的研究[J]. 中國藥科大學學報,1991,22(2):65-68.
[14]王興翠,曹逼力. 光質對生姜試管苗生長及微型姜誘導的影響[J]. 江蘇農業科學,2015,43(7):142-146
[15]張麗珍,楊冬業,袁盼盼. 紅果蘿莢木植物組織培養及快速繁殖[J]. 江蘇農業科學,2015,43(6):44-46.
[16]黎海利,譚飛理,劉鍇棟,等. 聚花過路黃的組織培養和快速繁殖[J]. 江蘇農業科學,2015,43(6):51-53.
[17]蘇江,韋劍鋒,岑忠用,等. 水晶布蘭卡百合花器官的組織培養[J]. 江蘇農業科學,2015,43(6):56-58.
[18]舒志明,梁宗鎖,孫群,等. 不同丹參種質生物學性狀比較與評價[J]. 西安文理學院學報:自然科學版,2007,10(2):24-29.
[19]高山林,朱丹妮,蔡朝暉,等. 丹參多倍體性狀和藥材質量的關系[J]. 植物資源與環境,1996,5(2):1-4.
[20]趙東利,王術烽,關玉偉,等. 丹參組織培養再生苗性狀變異[J]. 北京農學院學報,2012,27(3):7-9. 李敏,馬祥建,李玉娟,等. 耐鹽柳樹抗蟲基因Cry3A重組表達載體的構建[J]. 江蘇農業科學,2016,44(10):108-109.

