生物脅迫相關NAC1轉錄因子的生物信息學分析
朱峰++陳孝仁++錢坤++紀兆林++孔維文++楊益眾


摘要:植物NAC1轉錄因子在調控植物的抗生物脅迫反應中起著重要的作用。為探究生物逆境相關NAC1轉錄因子的功能,通過生物信息學的方法對8個生物逆境脅迫相關NAC1蛋白氨基酸序列一致性、氨基酸組成、理化性質、親/疏水性、保守結構域、磷酸化位點、亞細胞定位、二級結構及三級結構等進行了預測和分析。結果表明,8個生物逆境脅迫相關NAC1蛋白N-端保守性較強,包括5個保守的亞結構域,共同組成NAC1結構域。C-端含有多個保守的氨基酸,具有轉錄激活功能。同時蛋白中含有多個絲氨酸(S)、蘇氨酸(T)和酪氨酸(Y)磷酸化位點。8個NAC1蛋白都為親水性蛋白,大多定位于細胞核,個別定位于細胞質或葉綠體。二級結構則以α-螺旋和β-折疊為主。8個NAC1蛋白三維結構上的相似性暗示了功能上存在相似。本研究結果為進一步挖掘生物逆境相關NAC1轉錄因子的功能和改良植物抗生物逆境特性提供理論依據。
關鍵詞:生物脅迫;NAC1轉錄因子;生物信息學;抗生物逆境特性
中圖分類號: Q78文獻標志碼: A
文章編號:1002-1302(2016)10-0043-06
收稿日期:2016-04-14
基金項目:國家自然科學基金(編號:31500209);江蘇省高校自然科學研究面上項目(編號:15KJB210007);江蘇省揚州市自然科學基金-青年科技人才項目(編號:YZ2015106)。
作者簡介:朱峰(1985—),男,江西九江人,博士,講師,主要從事植物病理與分子生物學研究。E-mail:zhufeng@yzu.edu.cn。
[ZK)]
NAC(NAM/ATAF/CUC)轉錄因子家族是目前發現的最大的一類植物特有的轉錄因子,在其他真核生物中尚未發現該家族成員[1-2]。NAC家族的命名源于矮牽牛(Petunia hybrida)NAM(no apical meristem)和擬南芥(Arabidopsis thaliana)[WTBX][STBX]ATAF1、ATAF2[WTBZ][STBZ]以及[WTBX][STBX]CUC2[WTBZ][STBZ](cup-shaped cotyledon)基因[3-4]。研究表明,NAC轉錄因子具有多種功能,在植物的生長發育、器官建成、激素信號應答及逆境脅迫中均發揮重要的作用,已成為當前植物基因功能及表達網絡調控研究中的熱點[2,5-6],如枝頂端分生組織發育[7]、植物的衰老[8-10]、細胞分裂[11]、植物激素調控與信號轉導[12-13]和參與生物脅迫中植物的防御反應[14-16]等。
NAC轉錄因子是一個龐大的家族,大量的NAC基因被識別,其中在擬南芥中已發現117個NAC基因,水稻中發現151個NAC基因,葡萄中發現79個NAC基因,煙草中發現152個NAC基因[17]。越來越多的研究表明了NAC1基因在調控植物的抗生物脅迫反應起著重要的作用。辣椒[WTBX][STBX]CaNAC1[WTBZ][STBZ]在細菌性斑點病菌侵染后快速誘導,而且非寄主病菌侵染和抗病信號分子SA和ET處理后也能誘導[WTBX][STBX]CaNAC1[WTBZ][STBZ]強烈的表達[18]。先前的研究表明假單胞桿菌可以誘導番茄[WTBX][STBX]SlNAC1[WTBZ][STBZ]基因的表達[19],進一步研究表明番茄[WTBX][STBX]SlNAC1[WTBZ][STBZ]在調控植物抗性抵抗假單胞桿菌侵染起著重要的作用,并且番茄[WTBX][STBX]SlNAC1[WTBZ][STBZ]和本生煙[WTBX][STBX]NbNAC1[WTBZ][STBZ]有高度的同源性,抑制[WTBX][STBX]NbNAC1[WTBZ][STBZ],削弱植物的抗性,增加本生煙對假單胞桿菌的敏感性[20]。葡萄[WTBX][STBX]VvNAC1[WTBZ][STBZ]基因調控葡萄的防御反應應答壞死型和活體營養型病原菌的入侵,在擬南芥中過量表達[WTBX][STBX]VvNAC1[WTBZ][STBZ]基因可以增強植物對壞死型和活體營養型病原菌的入侵,并且防御相關的植物激素(如SA、MeJA、ABA和乙烯)可以誘導葡萄[WTBX][STBX]VvNAC1[WTBZ][STBZ]基因的表達[21]。在大麥中過量表達[WTBX][STBX]HvSNAC1[WTBZ][STBZ]基因能夠增強大麥對鐮刀菌的抗性,減輕葉斑病癥狀[22]。一些研究表明,NAC轉錄因子在應答病毒入侵時也起著一定的作用。番茄曲葉病毒(tomato leaf curl virus,TLCV)能夠誘導番茄[WTBX][STBX]SlNAC1[WTBZ][STBZ]基因的表達,并且該病毒編碼的Ren(geminiviral replication enhancer)蛋白能與[WTBX][STBX]SlNAC1[WTBZ][STBZ]蛋白相互作用,過量表達SlNAC1后可以加速TLCV的DNA積累[23]。
因此本研究將通過生物信息學的方法對生物逆境脅迫相關的普通煙[WTBX][STBX]NtNAC1[WTBZ][STBZ]、番茄[WTBX][STBX]SlNAC1[WTBZ][STBZ]、擬南芥[WTBX][STBX]AtATAF1[WTBZ][STBZ]、辣椒[WTBX][STBX]CaNAC1[WTBZ][STBZ]、大麥[WTBX][STBX]HvSNAC1[WTBZ][STBZ]、小麥[WTBX][STBX]TaNAC1[WTBZ][STBZ]、水稻[WTBX][STBX]OsNAC1[WTBZ][STBZ]和葡萄[WTBX][STBX]VvNAC1[WTBZ][STBZ]轉錄因子的理化性質、等電點、親/疏水性、序列一致性、磷酸化位點、保守結構域、亞細胞定位、二級結構和蛋白三維結構等進行預測和比較分析,旨在為進一步挖掘生物逆境相關NAC1轉錄因子的功能和改良植物抗生物逆境特性提供理論支持。
1材料與方法
1.1材料
從NCBI(http://www.ncbi.nlm.nih.gov/)的GenBank上下載普通煙[WTBX][STBX]NtNAC1[WTBZ][STBZ]、番茄[WTBX][STBX]SlNAC1[WTBZ][STBZ]、擬南芥[WTBX][STBX]AtATAF1[WTBZ][STBZ]、辣椒[WTBX][STBX]CaNAC1[WTBZ][STBZ]、大麥[WTBX][STBX]HvSNAC1[WTBZ][STBZ]、小麥[WTBX][STBX]TaNAC1[WTBZ][STBZ]、水稻[WTBX][STBX]OsNAC1[WTBZ][STBZ]和葡萄[WTBX][STBX]VvNAC1[WTBZ][STBZ]轉錄因子的氨基酸序列。
1.2NAC1蛋白氨基酸序列比對及系統發生樹構建
利用DNAMAN軟件進行氨基酸序列一致性分析。利用在線程序Clustal Omega(http://www.ebi.ac.uk/Tools/msa/clustalo/)進行氨基酸多重序列比對。利用MEGA 5.0軟件[24]構建系統發生樹,采取遺傳距離建樹法的相鄰連接法(neighbor-joining,NJ)建樹,對構建的樹進行自檢(bootstrap),重復設定為1 000。
1.3NAC1蛋白一級結構及理化特性分析
利用在線程序ProtParam(http://web.expasy.org/protparam/)對蛋白理化性質進行分析[25]。利用在線程序ProtScale(http://web.expasy.org/protscale/)進行氨基酸疏水性分析,利用NetPhos 2.0 Server (http://www.cbs.dtu.dk/services/NetPhos/)進行蛋白磷酸化位點修飾分析[26]。
1.4NAC1蛋白二級結構預測及亞細胞定位分析
[JP2]利用在線程序SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)預測α-螺旋(alpha helix)、β-折疊(extended strand)、β-轉角(beta turn)、無規卷曲(random coil)等蛋白二級結構。利用在線程序WoLF PSORT(http://www.genscript.com/wolf-psort.html)進行蛋白亞細胞定位[27]。
1.5NAC1蛋白三級結構預測
利用SWISS-MODEL workspace (http://swissmodel.expasy.org/workspace/) 對蛋白的三維結構進行同源模擬[28]。其中[WTBX][STBX]SlNAC1、CaNAC1、AtATAF1 TaNAC1、NtNAC1、OsNAC1和HvSNAC1[WTBZ][STBZ]的模板PDB號都是3ulxA,VvNAC1的模板PDB號是1ut7B。然后通過UCSF Chimera軟件將蛋白三維結構讀取出來[29]。
2結果與分析
2.1NAC1蛋白氨基酸序列比對及系統發生樹構建
通過DNAMAN軟件對這8個生物逆境脅迫相關NAC1蛋白氨基酸序列的一致性進行分析,發現它們的氨基酸序列一致性為46.52%。進一步通過在線程序Clustal Omega對它們進行多重序列比對,尋找NAC1中的保守區域。如圖1所示,8個生物逆境脅迫相關NAC1轉錄因子在氨基酸序列N-端保守性較強,其結構域由高度保守的約150個氨基酸殘基組成。C-端氨基酸則具有高度的多樣性,但C-端仍有幾個較為保守的氨基酸,如酪氨酸(Y)、亮氨酸(L)、纈氨酸(V)、絲氨酸(S)。利用MEGA 5.0軟件對這8個生物逆境脅迫相關NAC1蛋白構建系統進化樹。如圖2所示,SlNAC1和CaNAC1親緣關系最近,和AtATAF1親緣關系稍近,與 NtNAC1 的親緣關系最遠。[FL)]
[FK(W33][TPZF1.tif][FK)]
[FK(W8][TPZF2.tif][FK)]
2.2NAC1蛋白理化性質及親疏水性分析
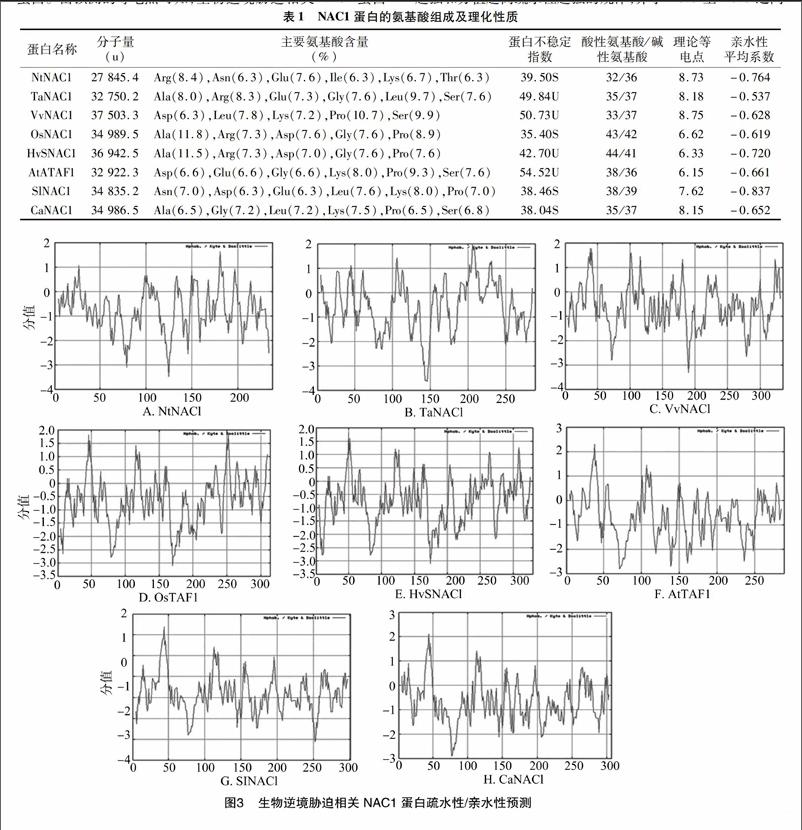
利用在線程序ProtParam預測NAC1蛋白的理化性質(表1),結果表明,NtNAC1、OsNAC1、SlNAC1和CaNAC1為穩定蛋白,而TaNAC1、VvNAC1、HvSNAC1和AtATAF1為不穩定蛋白。由預測的等電點可知,生物逆境脅迫相關NAC1蛋白中堿性等電點居多,如NtNAC1、SlNAC1、CaNAC1、TaNAC1和VvNAC1,也有酸性等電點,如OsNAC1、HvSNAC1、AtATAF1。從蛋白組成可以看出,NtNAC1中精氨酸(Arg)含量最高,TaNAC1中亮氨酸(Leu)含量最高,OsNAC1和HvSNAC1中丙氨酸(Ala)含量最高,VvNAC1和AtATAF1中脯氨酸(Pro)含量最高,SlNAC1和CaNAC1中賴氨酸(Lys)含量最高。
另外由表1可以看出,8個生物逆境脅迫相關NAC1蛋白的親水性平均系數都為負值,說明它們都是親水性蛋白,其中SlNAC1的親水性平均系數最小,說明SlNAC1蛋白的親水性最強。為了進一步證實NAC1蛋白都屬于親水性蛋白,利用在線程序ProtScale對8個生物逆境脅迫相關NAC1蛋白進行疏水性/親水性預測(圖3)。根據氨基酸分值越低親水性越強和分值越高疏水性越強的規律,介于+0.5至-0.5之間
的主要為兩性氨基酸,從整體來看,這8個生物逆境脅迫相關NAC1蛋白氨基酸的分值為負值,也就說明了它們都為親水性蛋白。從圖3還可以看出,SlNAC1蛋白氨基酸整體上的分值是最低的,說明了SlNAC1蛋白的親水性最好。這也證實了在線程序ProtParam預測8個生物逆境脅迫相關NAC1蛋白都為親水性蛋白的結果。其中在SlNAC1多肽鏈中第252位的谷氨酸(Glu)具有最低分值為-3.122,親水性最強,第44位的異亮氨酸(Ile)具有最高分值2.389,疏水性最強。
2.3NAC1蛋白磷酸化分析
蛋白質合成后,化學修飾是一種對其活性進行調節的重要形式。因此對氨基酸序列翻譯后修飾的預測和分析可以為認識蛋白質的亞細胞定位以及推測蛋白功能提供重要的幫助。蛋白質磷酸化(protein phosphorylation)是生物界最普遍也是最重要的一種蛋白質翻譯后修飾。蛋白質磷酸化和去磷酸化是原核和真核生物細胞表達調控的關鍵環節,對許多生物的細胞功能起開關調控作用。如蛋白激酶C的磷酸化對于基因表達、細胞分化、機體代謝和增殖起著重要的作用。其中蛋白磷酸化主要有氨基酸序列中蘇氨酸(T)、酪氨酸(Y) 和絲氨酸(S)的磷酸化。因此利用NetPhos 2.0 Server在線程序對這8個NAC1蛋白氨基酸磷酸化位點進行了預測。生物逆境脅迫相關NAC1蛋白的磷酸化位點數量如表2所示。結果顯示,這8個生物逆境脅迫相關NAC1蛋白中絲氨酸磷酸化位點最多。
2.4NAC1蛋白二級結構預測及亞細胞定位分析
蛋白質的二級結構主要有α-螺旋、 β-折疊、β-轉角和無規卷曲等。如表3所示,通過在線程序SOPMA的預測,結果表明,生物逆境脅迫相關NAC1蛋白中無規卷曲的比例較高(38.66%~54.33%),它具有連接其他二級結構元件的作用;此外的主要二級結構元件有α-螺旋(18.69%~32.80%)和β-折疊(14.63%~24.57%)。生物逆境脅迫相關NAC1蛋白二級結構預測見圖4,它們在二級結構上也具有較高的相似性。尤其是SlNAC1和CaNAC1中的二級結構(如α-螺旋和β-折疊)出現的氨基酸殘基的位置比較相近,同樣[WTBX][STBX]OsNAC1和HvSNAC1[WTBZ][STBZ]中的二級結構出現的氨基酸殘基的位置也很相近。
利用在線程序WOLF PSORT分別對8個NAC1成員蛋白質的亞細胞定位進行分析,結果以得分形式表現。結果(表4)表明,TaNAC1定位于細胞質的可能性較大,CaNAC1定位于葉綠體的可能性較大,其余蛋白定位于細胞核,這也從側面表明了這些轉錄因子的存在及其發揮功能的場所主要是細胞核。
2.5NAC1蛋白三維結構分析
蛋白質三級結構的預測和分析對理解蛋白質結構和功能
3討論與結論
植物轉錄因子的研究不僅是當前生物科學研究領域的熱點,而且是功能基因組學研究的重要內容之一。大量研究表明,NAC轉錄因子在植物生長發育中具有重要的調控作用[2],而且也參與植物對干旱、高鹽、低溫等非生物和病原菌侵染等生物脅迫的抗逆反應、激素信號途徑的轉導、機體的凋亡等方面[2,5-6]。越來越多的研究表明,[WTBX][STBX]NAC1[WTBZ][STBZ]基因在調控植物的抗生物脅迫(如細菌、真菌、病毒的侵染)方面起著重要的作用。因此本研究重點針對[WTBX][STBX]NAC1[WTBZ][STBZ]基因進行了生物信息學分析。
氨基酸序列比對結果表明NAC1轉錄因子在N-端保守性非常強,其結構域可以分為5個亞結構域。研究表明,NAC轉錄因子C-端富含酸性氨基酸、谷氨酰胺和脯氨酸等氨基酸時,一般是轉錄激活區域[30-32]。本研究比對結果顯示,生物逆境脅迫相關NAC1轉錄因子的C-端氨基酸組成比較符合這個特征,推測參與轉錄激活。近年來,關于核定位信號 (nuclear localization signal,NLS)的研究已經越來越深入,大致可分為以下3類[33]:(1)單一型(monopartite)NLS。這種NLS最初發現存在于猿猴病毒40的大T抗原中,包含7個氨基酸(PKKKRKV)的短肽[34]。單一型NLS一般是由4~8個氨基酸組成的短肽,富含帶正電荷的Lys-和Arg-,通常還含有Pro。(2)雙分型(bipartite)NLS。這種NLS是由2簇堿性氨基酸組成,中間是由10~12個非保守性氨基酸分隔而形成的序列。研究表明雙向的信號可能是標準的NLS[35]。Nogueira等發現SsNAC23包含1個雙向的核定位信號[36-37]。(3)其他類型NLS。除上述2類典型的NLS外,還有一些沒有特定序列特征的NLS,它們主要存在于可在細胞核和細胞質間穿梭的蛋白質中。本研究中8個生物逆境脅迫NAC1轉錄因子大多定位于細胞核,由亞細胞定位的結果可以推斷,具有相近生物學功能的NAC1蛋白可能定位于相同的亞細胞結構。
對這些生物逆境脅迫NAC1蛋白的二級結構進行分析進一步得知這些蛋白均屬于親水蛋白,但他們在親水程度方面存在差異。SlNAC1蛋白的親水性最強,表明SlNAC1蛋白更易水解。蛋白三維結構與其生物學功能息息相關[38]。通過SWISS-MODEL workspace 對NAC1蛋白三維結構進行同源模擬,結果發現,SlNAC1、CaNAC1和AtATAF1結構相似,包含A鏈和B鏈,各自形成1個對稱的同源二聚體。目前,已有研究通過晶體衍射的方法將擬南芥ANAC蛋白和水稻脅迫響應NAC1蛋白的結構解析出來。結果證實它們的晶體結構為1個對稱的同源二聚體,并且每個單體包含6個反向平行的β-折疊和3個α-螺旋[39-40]。總體來看,8種成員的二級結構中的α-螺旋、β-折疊和無規卷曲具有較高的保守性。這也從某種程度上反映了它們在三級結構上的相似性以及生物學功能的相似性。
綜上所述,NAC1轉錄因子保守結構域的序列將直接影響到NAC1蛋白的親水性、疏水性、亞細胞定位、二級結構以及三級結構的形成等,進而影響NAC1蛋白的生理功能。因此本研究應用生物信息學的方法對已知蛋白序列NAC1進行序列比對、分析、推斷和預測其結構和功能,為進一步挖掘生物逆境相關NAC1轉錄因子的功能和改良植物抗生物逆境特性提供理論依據。
參考文獻:
[1]Riechmann J L,Heard J,Martin G,et al. Arabidopsis transcription factors:genome-wide comparative analysis among eukaryotes[J]. Science,2000,290(5499):2105-2110.
[2]Olsen A N,Ernst H A,Leggio L L,et al. NAC transcription factors:structurally distinct,functionally diverse[J]. Trends in Plant Science,2005,10(2):79-87.
[3]Souer E,Vanhouwelingen A,Kloos D,et al. The no apical meristem gene of petunia is required for pattern formation in embryos and flowers and is expressed at meristem and primordia boundaries[J]. Cell,1996,85(2):159-170.
[4]Aida M,Ishida T,Fukaki H,et al. Genes involved in organ separation in Arabidopsis:an analysis of the cup-shaped cotyledon mutant[J]. The Plant Cell,1997,9(6):841-857.
[5]Zheng X,Chen B,Lu G,et al. Overexpression of a NAC transcription factor enhances rice drought and salt tolerance[J]. Biochemical and Biophysical Research Communications,2009,379(4):985-989.
[6]Nuruzzaman M,Sharoni A M,Satoh K,et al. Comprehensive gene expression analysis of the NAC gene family under normal growth conditions,hormone treatment,and drought stress conditions in rice using near-isogenic lines (NILs) generated from crossing Aday Selection (drought tolerant) and IR64[J]. Molecular Genetics and Genomics,2012,287(5):389-410.
[7]Nikovics K,Blein T,Peaucelle A,et al. The balance between the MIR164A and CUC2 genes controls leaf margin serration in Arabidopsis[J]. The Plant Cell,2006,18(11):2929-2945.
[8]Guo Y,Gan S. AtNAP,a NAC family transcription factor,has an important role in leaf senescence[J]. The Plant Journal,2006,46(4):601-612.
[9]Uauy C,Distelfeld A,Fahima T,et al. A NAC gene regulating senescence improves grain protein,zinc,and iron content in wheat[J]. Science,2006,314(583):1298-1301.[ZK)]
[10]Balazadeh S,Siddiqui H,Allu A D,et al. A gene regulatory network controlled by the NAC transcription factor ANAC092/AtNAC2/ORE1 during salt-promoted senescence[J]. The Plant Journal:for Cell and Molecular Biology,2010,62(2):250-264.
[11]Kim S Y,Kim S G,Kim Y S,et al. Exploring membrane-associated NAC transcription factors in Arabidopsis:implications for membrane biology in genome regulation[J]. Nucleic Acids Research,2007,35(1):203-213.
[12]He X J,Mu R L,Cao W H,et al. AtNAC2,a transcription factor downstream of ethylene and auxin signaling pathways,is involved in salt stress response and lateral root development[J]. The Plant Journal,2005,44(6):903-916.
[13]Kim S G,Lee A K,Yoon H K,et al. A membrane-bound NAC transcription factor NTL8 regulates gibberellic acid-mediated salt signaling in Arabidopsis seed germination[J]. The Plant Journal,2008,55(1):77-88.
[14]Delessert C,Kazan K,Wilson I W,et al. The transcription factor ATAF2 represses the expression of pathogenesis-related genes in Arabidopsis[J]. The Plant Journal,2005,43(5):745-757.
[15]Lin R M,Zhao W S,Meng X B,et al. Rice gene OsNAC19 encodes a novel NAC-domain transcription factor and responds to infection [JP2]by Magnaporthe grisea[J]. Plant Science,2007,172(1):120-130.
[16]Donze T,Qu F,Twigg P,et al. Turnip crinkle virus coat protein inhibits the basal immune response to virus invasion in Arabidopsis by binding to the NAC transcription factor TIP[J]. Virology,2014,449(20):207-214.
[17]Nuruzzaman M,Sharoni A M,Kikuchi S. Roles of NAC transcription factors in the regulation of biotic and abiotic stress responses in plants[J]. Frontiers in Microbiology,2013,4(4):248.
[18]Oh S K,Lee S,Yu S H,et al. Expression of a novel NAC domain-containing transcription factor (CaNAC1) is preferentially associated with incompatible interactions between chili pepper and pathogens[J]. Planta,2005,222(5):876-887.
[19]Mysore K S,Crasta O R,Tuori R P,et al. Comprehensive transcript profiling of Pto-and Prf-mediated host defense responses to infection by Pseudomonas syringae pv. tomato[J]. The Plant Journal,2002,32(3):299-315.
[20]Huang W,Miao M,Kud J,et al. SlNAC1,a stress-related transcription factor,is fine-tuned on both the transcriptional and the post-translational level[J]. The New Phytologist,2013,197(4):1214-1224.
[21]Le Hénanff G,Profizi C,Courteaux B,et al. Grapevine NAC1 transcription factor as a convergent node in developmental processes,abiotic stresses,and necrotrophic/biotrophic pathogen tolerance[J]. Journal of Experimental Botany,2013,64(16):4877-4893.
[22]Mcgrann G R,Steed A,Burt C A,et al. Contribution of the drought tolerance-related Stress-responsive NAC1 transcription factor to resistance of barley to Ramularia leaf spot[J]. Molecular Plant Pathology,2015,16(2):201-209.
[23]Selth L A,Dogra S C,Rasheed M S,et al. A NAC domain protein interacts with tomato leaf curl virus replication accessory protein and [JP3]enhances viral replication[J]. The Plant Cell,2005,17(1):311-325.
[24]Tamura K,Peterson D,Peterson N,et al. MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J]. Molecular Biology and Evolution,2011,28(10):2731-2739.
[25]Gasteiger E,Hoogland C,Gattiker A,et al. Protein identification and analysis tools on the ExPASy server [M]. The proteomics protocols handbook. New York:Humana Press,2005:571-607.
[26]Blom N,Gammeltoft S,Brunak S. Sequence and structure-based prediction of eukaryotic protein phosphorylation sites[J]. Journal of Molecular Biology,1999,294(5):1351-1362.
[27]Horton P,Park K J,Obayashi T,et al. WoLF PSORT:protein localization predictor[J]. Nucleic Acids Research,2007,35(Web Server issue):W585-W587.
[28]Arnold K,Bordoli L,Kopp J,et al. The SWISS-MODEL workspace:a web-based environment for protein structure homology modelling[J]. Bioinformatics,2006,22(2):195-201.
[29]Zhu F,Xu M,Wang S,et al. Prokaryotic expression of pathogenesis related protein 1 gene from Nicotiana benthamiana:antifungal activity and preparation of its polyclonal antibody[J]. Biotechnology Letters,2012,34(5):919-924.
[30]Sadowski I,Ma J,Triezenberg S,et al. GAL4-VP16 is an unusually [JP3]potent transcriptional activator[J]. Nature,1988,335(6190):563-564.
[31]Courey A J,Holtzman D A,Jackson S P,et al. Synergistic activation by the glutamine-rich domains of human transcription factor Sp1[J]. Cell,1989,59(5):827-836.
[32]Mermod N,Oneill E A,Kelly T J,et al. The proline-rich transcriptional activator of CTF/NF-I is distinct from the replication and DNA binding domain[J]. Cell,1989,58(4):741-753.[ZK)][HT][HJ][HT][FL)]
[KH*4D]
[HT8.]
[33]陶華平. 核定位信號研究進展[J]. 生物學通報,2014,49(8):5-10.
[34]Kalderon D,Richardson W D,Markham A F,et al. Sequence requirements for nuclear location of simian virus 40 large-T antigen[J]. Nature,1984,311(5981):33-38.
[35][JP3]Dingwall C,Laskey R A. Nuclear targeting sequences—a consensus?[J]. Trends in Biochemical Sciences,1991,16(12):478-481.
[36]Nogueira F S,Schlogl P S,Camargo S R,et al. SsNAC23,a member of the NAC domain protein family,is associated with cold,herbivory and water stress in sugarcane[J]. Plant Science,2005,169(1):93-106.
[37]李偉,韓蕾,錢永強,等. 非生物逆境脅迫相關NAC轉錄因子的生物信息學分析[J]. 西北植物學報,2012,32(3):454-464.
[38]康美玲,周振華,田忠景,等. 抗逆性轉錄因子NAC的生物信息學分析[J]. 湖北農業科學,2014,53(17):4199-4204.
[39]Ernst H A,Olsen A N,Larsen S,et al. Structure of the conserved domain of ANAC,a member of the NAC family of transcription factors[J]. EMBO Reports,2004,5(3):297-303.
[40]Chen Q,Wang Q,Xiong L,et al. A structural view of the conserved domain of rice stress-responsive NAC1[J]. Protein & Cell,2011,2(1):55-63.

