多西他賽為主的聯合化療方案治療轉移性乳腺癌
劉靜 陳開杰
[摘 要] 目的:分析多西他賽為主的聯合化療方案治療轉移性乳腺癌的臨床療效與安全性。方法:選取我院2013年7月—2015年7月收治的82例無手術指征的ⅢC/Ⅳ期轉移性乳腺癌患者,按照隨機數字表法分為觀察組、對照組,各41例。觀察組接受多西他賽+環(huán)磷酰胺+氟尿嘧啶化療,對照組接受吡柔比星+環(huán)磷酰胺+氟尿嘧啶化療,21d為1周期。于治療2周期后檢測兩組患者腫瘤標志物變化,評價其臨床療效與不良反應。結果:兩組患者治療后CA153、CEA均降低,觀察組降低更為明顯,差異有統計學意義(P<0.05)。觀察組客觀有效率、臨床受益率分別為53.66%、85.37%,均高于對照組的21.95%、48.78%,差異有統計學意義(P<0.05)。兩組患者不良反應發(fā)生率比較,差異無統計學意義(P>0.05)。結論:應用多西他賽為主的聯合化療方案治療轉移性乳腺癌有著良好的療效,且不良反應可耐受。
[關鍵詞] 多西他賽;化療;轉移性乳腺癌;療效;不良反應
中圖分類號:R97 文獻標識碼:A 文章編號:2095-5200(2016)06-117-03
DOI:10.11876/mimt201606043
化療在乳腺癌的治療中占據著重要地位[1],對于失去手術機會的轉移性乳腺癌患者而言,化療是控制病灶進展唯一手段[2]。因此,化療方案的選擇十分重要,歐美國家已批準多西他賽用于局部晚期或伴有遠處轉移的晚期乳腺癌的臨床治療[3]。為了解多西他賽為主的聯合化療方案治療轉移性乳腺癌的臨床療效與安全性,本研究選取82例患者進行了前瞻性對照分析。
1 資料與方法
1.1 一般資料
選取我院2013年7月—2015年7月收治的82例轉移性乳腺癌患者,按照隨機數字表法分為觀察組、對照組,各41例。觀察組年齡(41.37±4.46)歲;ⅢC期16例、Ⅳ期25例;浸潤性導管癌26例,小葉癌7例,其他8例;ER陽性19例,陰性22例。對照組年齡(41.25±4.51)歲;ⅢC期18例、Ⅳ期23例;浸潤性導管癌24例,小葉癌8例,其他9例;ER陽性20例,陰性21例。兩組患者一般臨床資料比較,差異無統計學意義(P>0.05),本臨床研究具有可比性。
1.2 選取標準及排除標準
選取標準:1)經穿刺活檢確診的ⅢC/Ⅳ期轉移性乳腺癌,且失去手術指證[4];2)病灶直徑可測量,Kamofsky評分≥60分,預期生存期≥3個月;3)入組前1個月內無其他抗癌藥物治療史或放療史;4)血常規(guī)、心電圖指標基本正常,肝腎功能指標≤1.5倍正常上限;5)明確此次研究內容,知情同意且自愿參與。排除標準:1)臨床資料不完整或臨床、影像學觀察指標無法評價;2)既往有其他惡性腫瘤史;3)治療時間<2個周期;4)合并骨髓受累或嚴重臟器功能損傷。
1.3 研究方法
1.3.1 治療方案 觀察組:80 mg/m2多西他賽加入500 mL生理鹽水靜脈滴注,4 h滴注完畢;600 mg/m2環(huán)磷酰胺加入20 mL生理鹽水中靜脈推注;400 mg/m2氟尿嘧啶靜脈滴注。化療時間d1、d8,21 d為1周期,持續(xù)2~6個周期。對照組:50 mg/m2吡柔比星加入500 mL生理鹽水靜脈滴注,4 h滴注完畢,其他化療藥物及化療時間同觀察組[5]。在化療基礎上,實施綜合支持療法。
1.3.2 觀察指標 于治療2個療程后實施腫瘤標志物檢測與療效評價。抽取兩組患者治療前、治療后清晨空腹肘靜脈血檢測糖類抗原153(CA153)、CA125、癌胚抗原(CEA),檢測結果正常參考值[6]:CA153:0~35 kU/L;CA125:0~35 kU/L;CEA:0~5 ng/mL。
療效評價根據兩組患者治療后病灶最大直徑、腫瘤標志物變化[7]:完全緩解(CR):全部靶病灶消失,腫瘤標志物水平處于正常范圍內且持續(xù)≥4周;部分緩解(PR):靶病灶最大直徑較治療前減小≥30%,腫瘤標志物水平較治療前降低≥65%且持續(xù)≥4周;疾病進展(PD):靶病灶最大直徑較治療前減小≤20%或增大<20%,腫瘤標志物水平較治療前增大≥40%;疾病穩(wěn)定(SD):介于PR、PD之間。臨床受益率=(CR+PR+SD)/總例數×100%;客觀有效率=(CR+PR)/總例數×100%
安全性評價參照世界衛(wèi)生組織(WHO)制定的急性、亞急性毒性標準[8]。
1.4 統計學分析
數據采用SPSS20.0進行分析,計數資料以(n/%)表示,并采用χ2檢驗,計量資料以(x±s)表示,滿足正態(tài)分布且方差齊性則采用獨立樣本t檢驗,若方差不齊,則采用校正t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 腫瘤標志物
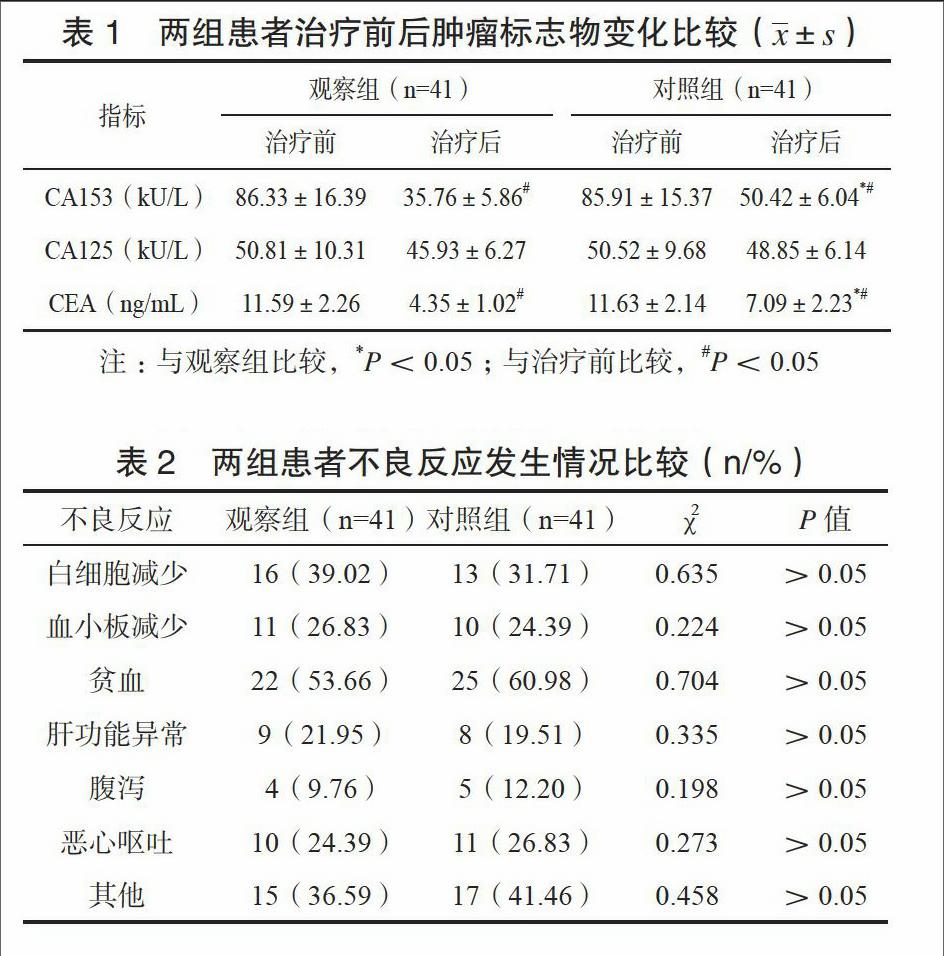
兩組患者治療后CA153、CEA均降低,觀察組降低更為明顯,差異有統計學意義(P<0.05),見表1。
5
2.2 臨床療效及不良反應
觀察組PR22例、SD13例、PD6例,對照組PR9例、SD11例、PD21例,觀察組客觀有效率、臨床受益率分別為56.10%、85.37%,均高于對照組的21.95%、48.78%,差異有統計學意義(P<0.05)。兩組患者不良反應發(fā)生率比較,差異無統計學意義(P>0.05),見表2。其不良反應多集中于貧血、白細胞減少,且以I~II級為主,經停藥或支持治療后均恢復。
3 討論
盡管對于乳腺癌的治療已取得了較大進展,但轉移性乳腺癌預后欠佳,與此同時,我國約有5%~15%的患者確診時已出現遠處轉移,為臨床治療方案的選擇提出了更高的要求[9]。
聯合化療的毒性反應及不穩(wěn)定的治療效果一直是困擾臨床的一大難題[10]。在保證耐受性的前提下,盡可能緩解腫瘤的快速生長、延長患者生存周期、提高患者生存質量是轉移性乳腺癌治療的首要原則[11]。多西他賽是一種強效紫杉醇類藥物,可結合游離微管蛋白,發(fā)揮促進小管聚合為穩(wěn)定的微管、抑制微管解聚等作用,從而抑制細胞有絲分裂,達到抗癌效果。其優(yōu)勢在于不會影響微管束中原絲數量,故與臨床中大多數紡錘體毒性抗癌藥物作用機制存在差異,對正常細胞的影響更小[12]。
吡柔比星屬蒽環(huán)類抗腫瘤藥物,可通過干擾堿基對配對過程,阻斷mRNA形成,發(fā)揮抗腫瘤作用[13-15]。
本研究就兩種藥物治療轉移性乳腺癌的效果與安全性進行了比較,結果表明,以多西他賽為主的聯合化療方案在降低患者血清腫瘤標志物,提高客觀有效率、臨床受益率方面發(fā)揮了良好效果。血清CA153、CEA水平與轉移性乳腺癌患者的預后具有密切關聯[16],其水平的升高預示著患者腫瘤轉移、浸潤風險升高,預后不良,本研究兩組患者治療后CA153、CEA水平均降低,觀察組降低更為明顯,提示觀察組患者有望獲得更佳的遠期預后質量,鑒于本研究隨訪時間有限,未能對患者遠期療效予以評價,這是此次研究的局限性所在。
安全性方面,兩組患者不良反應差異無統計學意義,且未對治療依從性造成明顯影響。同時,本研究患者于用藥前、用藥后均分別接受地塞米松、止吐藥物治療,故可進一步降低不良反應發(fā)生風險及發(fā)生程度[17]。此外,Hancox等[18]發(fā)現,多西他賽除具有良好的安全性及特異性作用機制外,其淋巴結、肝臟等部位分布濃度較高,故對于淋巴結轉移、肝轉移乳腺癌患者而言,該方案的針對性更強、療效更為確切。
綜上所述,多西他賽為主的聯合化療方案可有效降低轉移性乳腺癌患者血清腫瘤標志物,能在保持良好耐受性的前提下,顯著提高客觀有效率、臨床受益率,其良好的近期療效值得肯定。
參 考 文 獻
[1] Swain S M, Kim S B, Cortés J, et al. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA study): overall survival results from a randomised, double-blind, placebo-controlled, phase 3 study[J]. Lancet Oncol, 2013, 14(6): 461-471.
[2] 張丹華, 周恩相. 紫杉醇注射液、紫杉醇脂質體以及多西他賽治療乳腺癌的療效及安全性[J]. 中國癌癥雜志, 2013, 23(12): 1014-1016.
[3] 王建逵. 吡柔比星和環(huán)磷酰胺聯合多西他賽對乳腺癌的臨床療效觀察[J]. 實用癌癥雜志, 2015, 30(4): 537-540.
[4] Schott A F, Landis M D, Dontu G, et al. Preclinical and clinical studies of gamma secretase inhibitors with docetaxel on human breast tumors[J]. Clin Cancer Res, 2013, 19(6): 1512-1524.
[5] 吳志鵬. 吡柔比星和環(huán)磷酰胺聯合多西他賽在乳腺癌新輔助化療中的臨床療效觀察[J]. 中國腫瘤臨床與康復, 2014, 21(3): 304-306.
[6] Gianni L, Romieu G H, Lichinitser M, et al. AVEREL: a randomized phase III Trial evaluating bevacizumab in combination with docetaxel and trastuzumab as first-line therapy for HER2-positive locally recurrent/metastatic breast cancer[J]. Clin Oncol, 2013, 31(14): 1719-1725.
[7] 曾林文, 吳鳴, 宗兵. 環(huán)磷酰胺聯合多西他賽用于乳腺癌術后化療的近期療效觀察[J]. 山東大學學報:醫(yī)學版, 2014, 52(z1): 111.
[8] Swain S M, Baselga J, Kim S B, et al. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer[J]. N Engl J Med, 2015, 372(8): 724-734.
[9] 姚宇鋒, 龔建平, 唐金海,等. 多西他賽聯合洛鉑新輔助化療方案治療三陰性乳腺癌的臨床觀察[J]. 臨床腫瘤學雜志, 2013, 18(8): 723-725.
[10] Kolberg H C, Akpolat-Basci L, Stephanou M, et al. Neoadjuvant chemotherapy with docetaxel, carboplatin, and weekly trastuzumab (TCH) activity in HER2-positive early breast cancer: Results after a median follow-up of 4.5 years[C]//ASCO Annual Meeting Proceedings. 2015, 33(28 suppl): 140.
[11] Brahmer J, Reckamp K L, Baas P, et al. Nivolumab versus docetaxel in advanced squamous-cell non–small-cell lung cancer[J]. N Engl J Med, 2015, 373(2): 123-135.
[12] Miles D W, De Haas S L, Dirix L Y, et al. Biomarker results from the AVADO phase 3 trial of first-line bevacizumab plus docetaxel for HER2-negative metastatic breast cancer[J]. Br J Cancer, 2013, 108(5): 1052-1060.
[13] 王英哲,令狐銳霞,楊俊蘭.乳腺癌靶向藥物治療進展[J].中華保健醫(yī)學雜志,2015,17(1):74-78.
[14] Swain S M, Ewer M S, Cortés J, et al. Cardiac tolerability of pertuzumab plus trastuzumab plus docetaxel in patients with HER2-positive metastatic breast cancer in CLEOPATRA: a randomized, double-blind, placebo-controlled phase III study[J]. Oncologist, 2013, 18(3): 257-264.
[15] Coudert B, Pierga J Y, Mouret-Reynier M A, et al. Use of [18 F]-FDG PET to predict response to neoadjuvant trastuzumab and docetaxel in patients with HER2-positive breast cancer, and addition of bevacizumab to neoadjuvant trastuzumab and docetaxel in [18 F]-FDG PET-predicted non-responders (AVATAXHER): an open-label, randomised phase 2 trial[J]. Lancet Oncol, 2014, 15(13): 1493-1502.
[16] Singel S M, Cornelius C, Batten K, et al. A targeted RNAi screen of the breast cancer genome identifies KIF14 and TLN1 as genes that modulate docetaxel chemosensitivity in triple-negative breast cancer[J]. Clin Cancer Res, 2013, 19(8): 2061-2070.
[17] Murakami M, Ernsting M J, Undzys E, et al. Docetaxel Conjugate Nanoparticles That Target α-Smooth Muscle Actin–Expressing Stromal Cells Suppress Breast Cancer Metastasis[J]. Cancer Res, 2013, 73(15): 4862-4871.
[18] Hancox U, Cosulich S, Hanson L, et al. Inhibition of PI3Kβ signaling with AZD8186 inhibits growth of PTEN-deficient breast and prostate tumors alone and in combination with docetaxel[J]. Mol Cancer Ther, 2015, 14(1): 48-58.

