沉默EphA2表達對胃癌AGS細胞上皮-間質轉化的影響*
侯福濤,黃忠誠,陳子華
(1.湖南省人民醫院胃腸結直腸肛門外科,長沙410005;2.中南大學湘雅醫院胃腸外科,湖南長沙410008)
沉默EphA2表達對胃癌AGS細胞上皮-間質轉化的影響*
侯福濤1,黃忠誠1,陳子華2△
(1.湖南省人民醫院胃腸結直腸肛門外科,長沙410005;2.中南大學湘雅醫院胃腸外科,湖南長沙410008)
目的探討EphA2基因表達沉默對胃癌AGS細胞上皮-間質轉化的影響機制。方法將對數生長期的胃癌AGS細胞接種于6孔板并分為EphA2 siRNA組、陰性對照組和空白對照組。采用EphA2 siRNA轉染胃癌AGS細胞,采用實時定量聚合酶鏈反應檢測轉染細胞EphA2的表達,采用相差顯微鏡觀察細胞形態的變化,采用Transwell實驗檢測轉染細胞的侵襲能力,應用蛋白質印跡法檢測轉染細胞E-cadherin和vimentin蛋白的表達。結果EphA2 siRNA組的EphA2 mRNA相對表達量(0.343±0.035)明顯低于陰性對照組(0.950±0.036)和空白對照組(0.997±0.065),差異均有統計學意義(P<0.05);EphA2 siRNA組胃癌AGS細胞呈上皮細胞樣,陰性對照組和空白對照組細胞呈間質樣細胞;EphA2 siRNA組的侵襲細胞數[(29.1±2.6)個]明顯少于陰性對照組[(52.2±2.6)個]和空白對照組[(56.2±4.0)個],差異均有統計學意義(P<0.05);EphA2 siRNA組E-cadherin蛋白的表達量較陰性對照組和空白對照的E-cadherin蛋白的表達量明顯上調,而vimentin蛋白的表達量明顯下調,差異均有統計學意義(P<0.05)。結論沉默AGS細胞EphA2的表達能夠抑制胃癌細胞由上皮樣細胞向間質樣細胞轉化,降低AGS細胞的侵襲力,上調上皮性標志物E-cadherin的表達,下調間質性標志物vimentin的表達。
胃腫瘤; RNA; 基因表達; 蛋白質類; 基因沉默; 上皮細胞; 生物轉化
胃癌是消化系統最常見的惡性腫瘤,為惡性腫瘤第2死因[1]。侵襲轉移和術后復發是大多數胃癌患者的主要死亡原因。胃癌浸潤、轉移涉及多個分子、多條信號轉導通路的相互作用和交叉調控。上皮-間質轉化(epithelial mesenchymal transition,EMT)是上皮細胞在特定的生理和病理情況下向間質樣細胞轉化的現象[2]。具體表現為細胞間黏附連接表達下調,如E-cadherin/catenins復合體,出現間質細胞標志物如N-cadherin、vimentin等表達,細胞重排、形成新的細胞基質之間的黏附等,對于腫瘤細胞結果就是細胞之間的黏附力減弱,侵襲能力增強,通過EMT為上皮來源的腫瘤細胞提供侵襲轉移基礎[3]。Eph基因家族具有受體酪氨酸激酶的活性,在調控腫瘤細胞生長、增殖、轉移相關的信號轉導通路中起關鍵作用[4]。EphA2受體是目前發現的14種Eph受體之一,在多種上皮性腫瘤中呈高表達[5]。最近有研究發現,EphA2與EMT有關,但其機制尚不十分明確[6]。深入研究EphA2調控胃癌EMT的機制,能為胃癌的治療提供理論依據。
1 材料與方法
1.1 材料 人胃癌AGS細胞購自中科院上海細胞庫;選擇針對EphA2 mRNA第317~335位序列為RNA干擾的靶序列,由上海吉瑪制藥技術有限公司合成;EphA2抗體、E-cadherin抗體、vimentin抗體均購自美國Santa Cruz公司;GAPDH抗體購自北京中杉金橋生物公司;Transwell小室購自美國康寧公司;Lipofectamine2000購自美國Invitrogen公司;Matrigel基質膠購自美國BD公司;胎牛血清、PRMI1640培養基均購自美國Hyclone公司。
1.2 方法
1.2.1 細胞培養及EphA2 siRNA轉染 AGS細胞常規培養于PRMI1640培養基(含10%胎牛血清)中,1~2 d更換培養基,2~4 d用0.25%胰酶消化傳代,取對數生長期細胞進行實驗。將對數生長期AGS細胞接種于6孔板并分為三組(EphA2 siRNA組、陰性對照組、空白對照組),待細胞生長至80%左右融合時進行轉染:EphA2 siRNA轉染組加入Lipofectamine2000、無血清雙抗培養基(OPTI-MEMI)及siRNA(終濃度為20 mmol/L);陰性對照組加入 Lipofectamine2000、OPTI-MEMI及control siRNA(終濃度為20mmol/L)。質粒轉染按照Lipofectamine2000轉染試劑說明書進行。轉染后,三組細胞繼續培養6 h后更換PRMI-1640培養基(含10%胎牛血清),繼續培養24h。
1.2.2 轉染后AGS細胞EphA2 mRNA的檢測 轉染了EphA2 siRNA、control siRNA和未轉染的AGS細胞培養24 h后,收集細胞實時定量反轉錄聚合酶鏈反應(RT-PCR)檢測EphA2 mRNA的表達情況。用Trizol試劑盒提取各組細胞總RNA。實時定量RT-PCR套裝試劑盒進行反轉錄及PCR。定量PCR反應條件:42℃、90min,95℃、5 min,冰上冷卻,擴增40個循環。內參選用β-actin。引物序列:EphA2上游引物為5′-GAGAAGGATGGCGAGTTCAG-3′,下游引物為5′-TCAGACACCTTGCA GACCAG-3′;β-actin上游引物為5′-ACAGAGCCTCGCCTTTGCCGATC-3′,下游引物為5′-ATCCTTCTGACCCATGCCCACCA-3′。每個反應設3個復孔。EphA2 mRNA相對表達采用ΔΔCt法計算。
1.2.3 各組AGS細胞形態觀察 采用相差顯微鏡進行觀察。AGS細胞轉染EphA2 siRNA(EphA2 siRNA組)、control siRNA(陰性對照組)和未轉染細胞(空白對照組)培養48 h消化后制成細胞懸液,以每孔2×104個接種至6孔板。每組分別設3個復孔,相差顯微鏡觀察細胞形態變化并拍照。
1.2.4 各組AGS細胞侵襲能力檢測 采用Transwell實驗進行檢測。Transwell小室底部膜的上室面用50 mg/L基質膠1∶8稀釋液包被,4℃風干,然后加入50 μL含10 g/L胎牛血清的清蛋白培養液,于37℃、5%CO2培養箱30 min使基質膠凝固;胰酶消化收集各組細胞后調整細胞密度至每孔1×105個,制成單細胞懸液,取100μL加入小室上層,下層加入500 μL PRMI1640培養基(含10%胎牛血清),培養箱內培養24 h,取出小室,用棉簽擦去基質膠和上室內的細胞,然后95%乙醇固定15min,甲苯胺藍染色5 min,計數膜背面的細胞,計算10個視野細胞數的平均值。
1.2.5 各組AGS細胞E-cadherin、vimentin蛋白表達檢測 采用蛋白質印跡法(Western blotting)法進行檢測。轉染siRNA48h后收集各組細胞,加細胞裂解液裂解細胞并提取總蛋白;核酸檢測儀測定蛋白質濃度后,各組以每孔40 μg蛋白上樣;濃縮膠上電泳電壓為60 V,分離膠上電泳電壓為100 V,電泳3 h;用硝酸纖維素膜轉膜,用5%脫脂牛奶封閉后分別加E-cadherin抗體、vimentin抗體和GAPDH抗體4℃孵育過夜;以Tris-PBS洗膜3次,每次5 min,室溫下避光孵育二抗1 h;用Tris-PBS洗膜3次,每次5 min,用Odyssey雙色紅外熒光掃膜成像。以目的蛋白與內參GAPDH條帶灰度值的比值表示蛋白質的相對含量。
1.3 統計學處理 應用SPSS16.0統計軟件進行數據分析,計量資料以±s表示,組間比較采用t檢驗;檢驗水準α=0.05,P<0.05為差異有統計學意義。
2 結 果
2.1 三組胃癌AGS細胞EphA2 mRNA的相對表達量比較 EphA2 siRNA組的EphA2 mRNA相對表達量(0.343±0.035)明顯低于陰性對照組(0.950±0.036)和空白對照組(0.997±0.065),差異均有統計學意義(P<0.05)。陰性對照組與空白對照組EphA2 mRNA相對表達量比較,差異無統計學意義(P>0.05),見圖1。
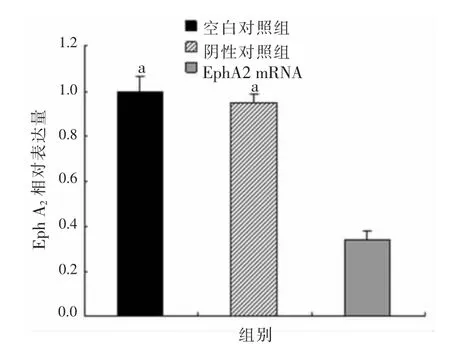
圖1 三組胃癌AGS細胞EphA2 mRNA的相對表達量比較
2.2 三組胃癌AGS細胞形態變化情況 EphA2 siRNA組胃癌AGS細胞呈上皮細胞樣,形態呈圓形、橢圓形、多角形等,陰性對照組和空白對照組細胞轉化為梭形,極性喪失,細胞間隙增寬,呈間質樣細胞,見圖2。
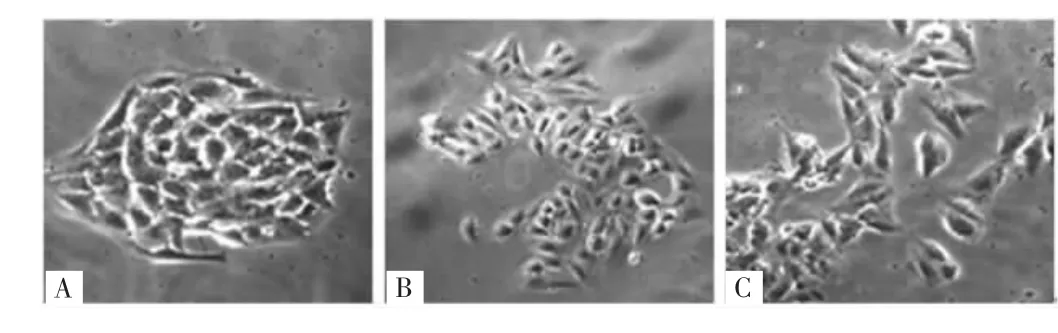
圖2 三組胃癌AGS細胞形態變化情況
2.3 三組胃癌AGS細胞侵襲能力比較 EphA2 siRNA組的侵襲細胞數[(29.1±2.6)個]明顯少于陰性對照組[(52.2±2.6)個]和空白對照組[(56.2±4.0)個],差異均有統計學意義(P<0.05),而陰性對照組和空白對照組的侵襲細胞數比較,差異無統計學意義(P>0.05),見圖3。
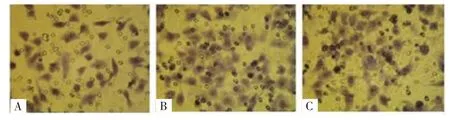
圖3 三組胃癌AGS細胞侵襲圖
2.4 三組胃癌AGS細胞E-cadherin、vimentin蛋白表達比較 EphA2 siRNA組E-cadherin蛋白的表達量較陰性對照組和空白對照明顯上調,差異均有統計學意義(P<0.05),陰性對照組和空白對照組E-cadherin蛋白的表達量比較,差異無統計學意義(P>0.05);EphA2 siRNA組vimentin蛋白的表達量較陰性對照組和空白對照明顯下調,差異均有統計學意義(P<0.05),而陰性對照組和空白對照組vimentin蛋白的表達量比較,差異無統計學意義(P>0.05)。見圖4、表1。
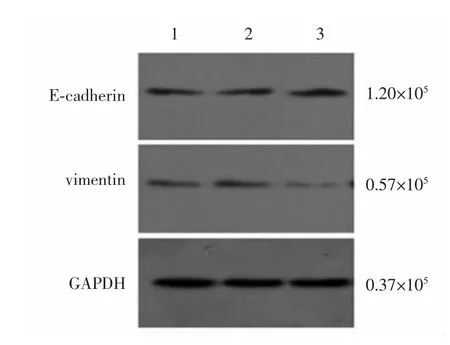
圖4 Western blotting檢測三組胃癌AGS細胞中E-cadherin、vimentin蛋白的表達
表1 各組AGS細胞E-cadherin、vimentin蛋白的相對表達量比較(±s)
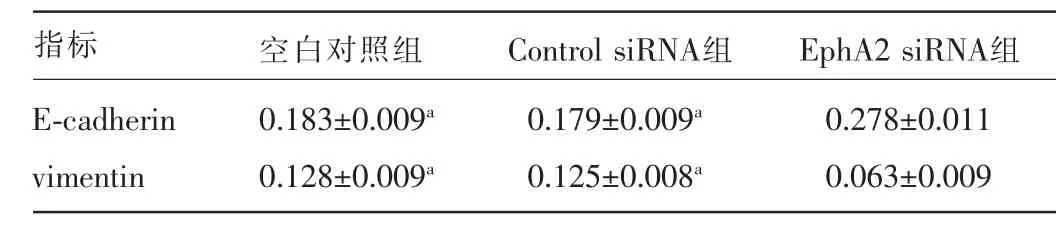
表1 各組AGS細胞E-cadherin、vimentin蛋白的相對表達量比較(±s)
注:與EphA2 siRNA組比較,aP<0.05。
指標 空白對照組 Control siRNA組 EphA2 siRNA組E-cadherin vimentin 0.183±0.009a0.128±0.009a0.179±0.009a0.125±0.008a0.278±0.011 0.063±0.009
3 討 論
胃癌在胃腸道腫瘤中預后較差,與其容易發生浸潤轉移相關。腫瘤的轉移主要包括侵襲、內滲、外滲和轉移4個步驟。遠處轉移具體表現為腫瘤細胞失去細胞間黏附,獲得遷移能力離開原發灶,滲入內皮血管或淋巴管進入體循環,然后外滲定居于遠端位點[7]。
近年來國內外研究發現,EMT與腫瘤浸潤轉移相關,可能與腫瘤細胞的侵襲轉移能力及腫瘤干細胞關系密切[8]。1982年Greenburg等[9]首次提出了EMT的概念,主要特征是上皮細胞表型的喪失和間質特性的獲得。EMT的主要分子特征為:上皮性標記物如E-cadherin、αcatenin、橋粒蛋白、細胞角蛋白等表達下調,間質性標記物如vimentin、粘連蛋白、N-cadherin、β-catenin、基質金屬蛋白酶類等表達上調[10]。
EphA2在上皮來源的腫瘤中高表達。本研究證實,胃癌AGS細胞EphA2呈高表達。有研究表明,EphA2在腫瘤中高表達存在轉錄和轉錄后的調節機制[11]。Fang等[12]研究發現,E-cadherin的功能也可以被Eph受體和配體調節,表明EphA2在腫瘤細胞的生物行為可能通過E-cadherin發揮作用,調節腫瘤細胞之間的黏附。本研究應用RNA干擾技術成功抑制了EphA2在AGS細胞中的表達,在EphA2 siRNA的作用下使AGS細胞在細胞形態方面呈現上皮樣改變,抑制了AGS細胞由上皮樣細胞向間質樣細胞的轉化,而且轉染EphA2 siRNA后AGS細胞的侵襲能力明顯下降。在EMT分子特征方面,通過EphA2 siRNA作用后,上調了AGS細胞上皮表型標志物E-cadherin的表達,下調了間質表型標志物vimentin的表達。因此,作者認為,EphA2 siRNA能夠抑制胃癌細胞EMT的發生,進而抑制胃癌細胞的侵襲轉移,為研究EphA2在胃癌EMT中的作用提供了一定的理論基礎,其具體機制有待進一步研究證實。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]Thiery JP,Acloque H,Huang RY,et al.Epithelial-Mesenchymal transitions in development and disease[J].Cell,2009,139(5):871-890.
[3]Kalluri R,Weinberg RA.The basics of epithelial-mesenchymal transition[J]. J Clin Invest,2009,119(6):1420-1428.
[4]Campbell TN,Robbins SM.The Eph receptor/ephrin system:an emerging player in the invasion game[J].Curr Issues Mol Biol,2008,10(1/2):61-65.
[5]Lee HY,Mohammed KA,Goldberg EP,et al.Silencing receptor EphA2 enhanced sensitivity to lipoplatin(TM)in lung tumor and MPM cells[J]. Cancer Invest,2016,34(7):293-304.
[6]Huang J,Xiao D,Li G,et al.EphA2 promotes epithelial-mesenchymal transition through the Wnt/β-catenin pathway in gastric cancer cells[J]. Oncogene,2014,33(21):2737-2747.
[7]Duffy MJ,Mcgowan PM,Gallagher WM.Cancer invasion and metastasis:changing views[J].J Pathol,2008,214(3):283-293.
[8]KongD,LiY,WangZ,etal.Cancerstemcellsand Epithelial-to-Mesenchymal transition(EMT)-Phenotypic cells:are they cousins or twins?[J]. Cancers(Basel),2011,3(1):716-729.
[9]Greenburg G,Hay ED.Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells[J].J Cell Biol,1982,95(1):333-339.
[10]Ouyang G,Wang Z,Fang X,et al.Molecular signaling of the epithelial to mesenchymal transition in generating and maintaining cancer stem cells[J]. Cell Mol Life Sci,2010,67(15):2605-2618.
[11]Kikuchi S,Kaibe N,Morimoto K,et al.Overexpression of ephrin a2 receptors in cancer stromal cells is a prognostic factor for the relapse of gastric cancer[J].Gastric Cancer,2015,18(3):485-494.
[12]Fang WB,Ireton RC,Zhuang GL,et al.Overexpression of EPHA2 receptor destabilizes adherens junctions via a RhoA-dependent mechanism[J]. J Cell Sci,2008,121(3):358-368.
Effect of silencing EphA2 expression on epithelial mesenchymal transition of gastric cancer AGS cells*
Hou Futao1,Huang Zhongcheng1,Chen Zihua2△
(1.Department of Gastrointestinal and Colorectal Anal Surgery,Hunan Provincial People′s Hospital,Changsha 410005,China;2.Department of Gastrointestinal Surgery,Xiangya Hospital,Central South University,Changsha,Hunan 410008,China)
ObjectiveTo study the effect of EphA2 gene expression silencing on epithelial mesenchymal transition of gastric cancer AGS cells and its mechanism.MethodsThe gastric cancer AGS cells at logarithmic growth phase were inoculated at the 6-well plate and divided into the EphA2 siRNA group,negative control group and blank control group.EphA2 siRNA was adopted to transfected to gastric cancer AGS cells.The EphA2 expression was detected by real time quantitative PCR.The cell morphology was observed by phase contrast microscope.The invasive ability of transfected cells was determined by Transwell invasion assay.The expression of E-cadherin and vimentin protein was detected by Western blotting.ResultsThe EphA2 mRNA relative expression amount in the EphA2 siRNA group was 0.343±0.035,which was lower than 0.950±0.036 in the negative control group and 0.997±0.065 in the blank control group,the differences were statistically significant(P<0.05);the gastric cancer AGS cells in the EphA2 siRNA group presented as the epithelioid cell,the cells in the negative and blank control groups showed the mesenchymal-like cells;the invasive cells number in the EphA2 siRNA group were 29.1±2.6,which was significantly less than 52.2±2.6 in the negative group and 56.2±4.0 in the blank control group,the differences were statistically significant(P<0.05);the E-cadherin protein expression amount in the EphA2 siRNA group was significantly up-regulated compared with the negative group and blank control group,while the vimentin protein expression amount was significantly down-regulated,the differences were sta tistically significant(P<0.05).ConclusionThe EphA2 expression of silencing AGS cells can inhibit the transition from epithelioid cells to mesenchymal like cells,reduces the invasive ability of AGS cells,up-regulates the expression of epithelial marker E-cadherin and down-regulates the expression of mesenchymal marker vimentin.
Stomach neoplasms; RNA; Gene expression; Proteins; Gene silencing; Epithelial cells; Biotransformation
10.3969/j.issn.1009-5519.2016.24.002
:A
:1009-5519(2016)24-3744-03
2016-11-01)
國家自然科學基金資助項目(81172297)。
侯福濤(1983-),博士研究生,主要從事胃腸道腫瘤治療研究。
△通訊作者,E-mail:122529274@qq.com。

