納米材料在影像輔助的腫瘤光熱治療中的應用
孫蒙蒙,王卓然,高衛平
清華大學 醫學院 生物醫學工程系,北京 100084
納米材料在影像輔助的腫瘤光熱治療中的應用
孫蒙蒙,王卓然,高衛平
清華大學 醫學院 生物醫學工程系,北京 100084
腫瘤光熱治療作為一種利用局部高溫熱殺傷腫瘤的療法,與傳統療法相比具有微創、副作用小、輔助殺菌等優勢。目前研究發現的光熱轉化材料種類繁多,將各種不同的納米材料應用于腫瘤光熱治療,在動物腫瘤模型實驗中都取得了較好的治療效果,其中許多材料兼具或易與影像探針結合而具有臨床成像功能。近年來影像輔助的腫瘤光熱治療的研究發展迅速。本文綜述了近年來兼具影像功能的納米材料在腫瘤光熱治療中的最新應用進展,并探討了這一新興領域的發展趨勢。
影像;腫瘤治療;光熱治療;納米材料
0 引言
癌癥已成為如今世界第二大致死病因,其發病率、致死率仍在逐年上升。目前癌癥臨床治療以手術、化療、放射治療為主,其缺點也十分明顯:手術創傷面大、易感染、易復發;化療與放療易產生耐藥性、副作用大。近年來新療法不斷涌現,如免疫治療、生物治療、熱療等。腫瘤熱療即利用激光、超聲、微波、磁場等物理能量加熱腫瘤,利用過高熱殺死腫瘤細胞。熱治療具有準確微創、低副作用、簡單易行、可重復治療、輔助消毒殺菌等多項優勢,其中近紅外激光熱療(簡稱光熱治療)納米材料的研究最為廣泛。
近紅外激光是指波長在700~1300 nm,即近紅外區的光束。許多納米材料在此區域有明顯的光吸收,并可將其轉化為熱量,具有光熱治療的潛力。主要包括:有機化合物如ICG[1],高分子如聚吡咯(Polypyrrole,PPy)[2]、聚苯胺[3],碳納米材料(碳納米管、C60)等共軛效應的納米體系;無機類包括金納米材料(金納米殼、金納米棒、金納米星)、鈀納米顆粒、硒化銅納米顆粒、氧化鎢納米線等[4]。此外,還包括新型的熱轉化納米體系,如通過自組裝或原位合成的金納米顆粒(Gold Nanoparticles,GNPs)膠束[5-6]。
這些納米材料的光熱轉化特性均可通過光熱成像(Photothermal Imaging,PTI)、光聲成像(Photoacoustic Imaging,PAI)形象表征,此外它們通常還具有其他的造影潛力。在臨床上影像技術可有效地應用于腫瘤的診斷,輔助或指導治療過程,實現可視化治療或診療一體化。影像可以輔助熱療以評價熱療效果,也可引導熱療。
納米材料根據其組成不同,具有不同的影像潛力。含高密度元素的納米材料,可用于X射線計算機斷層掃描(X-ray Computed Tomography,X-CT)成像,如Au、I[7];磁性納米材料可用于核磁共振成像(Magnetic Resonance Imaging,MRI),如磁性氧化鐵、Gd3+[8];含放射性核素的納米材料可用于正電子放射斷層成像(Positron Emission Tomography,PET),如18F、64Cu[9];含發射γ-光子的放射性元素的納米材料可用于單光子發射CT(Single Photon Emission CT,SPECT)成像,如125I[10]。
1 應用于光聲成像的光熱治療納米材料
用于光熱治療的納米材料由于近紅外區強吸收的特性,在入射光、尤其是近紅外激光照射下,呈現區別于正常組織的光吸收,納米材料吸收光子并轉化為熱,釋放的熱量導致局部溫度升高,熱膨脹而產生的壓力波便是可檢測的光聲信號。而光聲成像正是利用這些超聲波信號獲得組織器官或材料的斷層或三維圖像[11]。因而,光熱治療納米材料均可通過光聲成像檢測、表征其體內分布和代謝情況。
在光熱治療中,光聲成像可作為輔助手段表征納米材料在治療部位的富集情況。比如常用的光熱治療材料——金納米棒具有很好的光聲成像效果。Agarwal合成了最大吸收峰為810 nm的金納米棒,原位注射在小鼠后肢即可產生明顯區別于其他組織的光聲信號[12]。同理,其他可用于近紅外光熱治療的納米材料均可以通過光聲成像檢測其治療部位的信號分布情況。
此外,在光熱治療中,光聲成像更可以作為可視化手段監測納米材料的分布,從而利用光聲成像引導其光熱治療。陳小元和聶志鴻合成金納米囊泡負載光敏劑Ce6,系統注射后通過光聲成像監測納米顆粒在腫瘤內的停留情況。納米顆粒原位注射后在腫瘤局部的光聲信號提高3.8倍,此時利用近紅外激光照射可有效促進光熱轉換升溫與光敏劑釋放,通過光熱、光動力學治療有效殺傷腫瘤(圖1),并抑制復發[13]。戴志飛課題組合成了PPy光熱轉化納米材料,并利用光聲成像表征其不同時間內在體內分布的情況,以判斷光熱轉化劑PPy在體內可降解、代謝的性質[2]。

圖1 Ce6@金納米囊泡用于光聲成像輔助的腫瘤光學治療示意圖[13]
2 應用于X-CT影像的光熱治療納米材料
X-CT成像是臨床診斷和治療中常用的影像手段,根據不同組織、材料對X射線的吸收與透過率的不同,獲得斷面或立體圖像。含高密度元素的納米材料在X射線下具有較強、區別于正常組織的信號,因此在用于光熱治療的同時兼具CT造影功能。
金納米材料是常用的具有CT影像功能的光熱治療納米材料。Sangeeta N. Bhatia課題組合成了PEG化的金納米棒,通過CT影像判斷PEG-GNRs在腫瘤處的富集情況,從而引導腫瘤的光熱治療,并評價其生物分布[14]。崔大祥課題組則在GNRs表面包裹一層SiO2并修飾以葉酸(Folic Acid,FA)分子,獲得了具有靶向功能的光熱轉化納米材料。在光熱殺傷腫瘤的劑量下,通過明顯的CT影像快速、直觀的評價不同時間內納米材料在腫瘤處的腫瘤靶向功能與效果,結果發現靜脈注射后12 h腫瘤處富集劑量達到最大值,以此時間點指導腫瘤光熱治療可達到藥物的最大利用度[7]。
此外,鎢在X射線作用下具有區別于正常組織器官的信號。劉莊課題組合成的WS2-PEG納米片,利用CT輔助表征其瘤內分布:在原位注射的納米材料CT信號可提高5.7倍,靜脈注射24 h后腫瘤處信號強度增強至2.5倍,充分表征了納米材料在腫瘤處的富集情況,根據CT結果在合適的時間點開展光熱治療可有效殺滅腫瘤[15]。
3 應用于MRI影像的光熱治療納米材料
MRI可從組織器官中獲得電磁信號并重建信息,不使用影像探針也可成像,被認為是一種相對安全的臨床成像手段。磁性的光熱治療納米材料在MRI作用下可增強其影像效果,呈現出與正常組織器官明顯的信號差別,因此可輔助其光熱治療。
磁性氧化鐵相關的材料是光熱治療與MRI結合中最常用的納米材料。但單獨的磁性氧化鐵納米顆粒不具有近紅外光熱轉化效果,因此多與常見的光熱轉化材料相結合,如金納米材料。Chen-Chi M. Ma和Kuo-Chen Wei利用高分子鏈將磁性納米顆粒修飾在金納米棒的表面(圖2A),得到具有MRI影像功能的光熱治療納米材料[16]。Myung-Haing Cho和Taeghwan Hyeon利用化學鍵將磁性納米顆粒與金種結合在SiO2納米顆粒表面,并原位生長金殼層(圖2B),形成光熱治療納米顆粒,既保存了磁性納米顆粒的MRI信號、又實現光熱材料殺傷腫瘤細胞的效果[17]。施劍林和李永生則利用高分子聚集成有機層包裹超順磁氧化鐵納米材料、外側生長一層金殼合成Fe3O4@hybrid@Au納米顆粒(圖2C),兼具光熱治療與MRI影像雙功能[18]。同時,施劍林和陳航榕以磁性氧化鐵為核心通過雙層SiO2連接金納米棒,合成Fe3O4@SiO2@mSiO2-GNRs納米材料(圖2D),在光熱治療、MRI影像外還吸附化療藥物,實現了影像輔助的組合治療[19]。
此外,磁性氧化鐵還常與碳基光熱轉化納米材料形成復合材料。李勇剛、郭亮和劉莊利用氧化石墨烯負載磁性氧化鐵,并利用PEG修飾穩定納米結構,合成了GO–IONP–PEG納米材料[20],經靜脈注射后通過MRI跟蹤材料的體內分布,在24 h(腫瘤最佳富集時間點)進行光熱治療,可達到最佳治療效果。
除了磁性氧化鐵納米顆粒,許多其他材料也具有磁性。Gd3+具有良好的磁性,戴志飛通過聚乙二醇將Gd3+連接到PPy納米材料表面,合成的PPy-PEG-Gd是具有MRI影像功能的光熱轉化納米材料[12]。
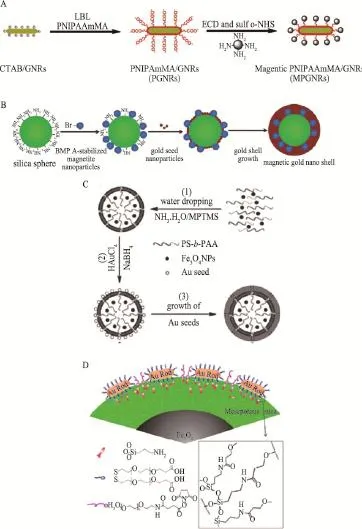
圖2 MRI輔助的腫瘤光熱治療納米材料合成示意圖
4 應用放射成像的光熱治療納米材料
光熱治療納米材料表面大多容易修飾,若在其中引入放射性元素,如18F、64Cu,則可在光熱治療的同時實現功能性PET成像,具有區別于正常組織的高靈敏度。其中64Cu由于其適合的半衰期與正電子活力的特性,是最常用的通過被光熱治療納米材料螯合而實現PET影像的放射性源[13]。碳納米管作為一種光熱治療納米材料,具有良好的共軛結構,是常用的螯合劑。戴宏杰和陳小元課題組就利用單臂碳納米管表面修飾的螯合劑螯合64Cu合成了兼具PET影像的光熱治療納米材料[21],可清晰地顯示出材料在體內的代謝及分布情況。Chun Li課題組不通過螯合劑直接合成了[64Cu]CuS納米顆粒,巧妙地將光熱治療與PET成像直接結合,通過影像引導,靜脈注射的納米材料也可有效抑制腫瘤生長(~ 65%)[22]。
5 應用光學成像的光熱治療納米材料
光熱轉化納米材料在近紅外激光作用下吸收光子,能量以熱的形式釋放,有些材料也可同時以光的形式釋放能量,如碳納米管。碳納米管特殊的共軛結構及表面缺陷,可在近紅外波段吸收光子而激發熒光,是一種兼具熒光性質的近紅外光熱轉化材料。戴宏杰利用高分子修飾單臂碳納米管(Single-walled Carbon Nanotubes,SWNTs),在腫瘤熒光成像(Fluorescence Imaging,FI)中呈現較高的空間分辨率,在低濃度下即可實現光熱治療[23]。
將熒光分子探針與光熱轉化納米材料相結合是最常見的設計策略,貴金屬納米材料由于其特殊的表面等離子體共振效應可增強多種熒光分子的熒光信號,如金納米棒、金納米殼等。何賽靈正是利用GNRs表面的LSPR效應對3.3’二乙基硫醛三碳菁化碘(DTTC)的熒光增強效應,設計合成了GNRs-DTTC-PEG納米顆粒。納米顆粒的尺寸效應更容易在腫瘤中滯留、富集,即利用腫瘤增強滲透和滯留效應(Enhanced Permeability and Retention,EPR)使納米材料在腫瘤局部的濃度增加,也加強了影像效果,因此可利用熒光成像輔助腫瘤的光熱治療[24]。利用類似的原理,Yongdoo Choi在GNRs表面連接了光敏劑——氯酞菁鋁(Al(III) Phthalocyanine Chloride Tetrasulfonic Acid,AlPcS4)熒光染料及PEG,在近紅外激光作用下,GNRs發熱變形并釋放AlPcS4,恢復熒光,實現光熱治療同步的熒光成像與光動力學治療[25]。Kwangmeyung Kim和Cheol-Hee Ahn則在GNRs表面通過酶響應多肽引入熒光染料Cy5.5,多肽在腫瘤部位被特有的基質金屬蛋白酶識別、切割從而釋放染料并恢復熒光,從而實現了靶向的熒光輔助成像[26]。
類似的,有機光熱治療納米材料也可結合熒光分子實現輔助的熒光成像。劉莊利用PEG將熒光分子Cy7修飾在石墨烯表面[27],利用熒光成像輔助表征光熱材料的體內代謝及分布情況。陳華兵則利用聚天冬氨酸-PEG的嵌段高分子與ICG組裝為納米顆粒,其中ICG兼具光熱治療和熒光成像功能[1],實現了光熱治療-熒光成像一體化。
6 應用多模態造影的光熱治療納米材料
光熱治療中的影像研究已逐漸多樣化,單一的影像手段有時并不能完全準確的表征光熱轉化納米材料。許多光熱治療納米材料可結合多種影像探針,同時進行多種成像,即多模態成像。CT與MRI作為最常用的影像手段,在光熱治療輔助影像的研究中也是最常與其他影像結合的手段,如PET-CT、SPECT-CT、MRI-熒光成像等。不同納米材料在多模態影像輔助的光熱治療中的應用情況,見表1。
7 總結與展望
腫瘤光熱治療以其局部精準微創、對正常組織無損傷等優勢,受到了越來越多的關注,有望在淺表腫瘤的治療中發揮更大優勢。光熱轉化納米材料的設計也正在向著多元化、多功能化發展,結合影像手段實現可視化治療也已經成為腫瘤光熱治療的熱點之一。影像與光熱治療相結合不僅可以輔助判斷治療效果,還可以引導光熱治療,這為腫瘤光熱治療的準確性以及臨床應用提供了重要的輔助作用。實現腫瘤可視化的光熱治療,最直接的策略是利用光熱轉化納米材料易修飾的特性,將影像分子探針與之結合,形成穩定的多功能納米體系,根據不同需求在光熱治療的同時實現影像功能。這種策略為腫瘤光熱治療的可行性提供了重要支持并取得了廣泛的研究成果,但仍存在許多問題與挑戰,亟待進一步解決。
腫瘤光熱治療納米材料的毒性一直是制約其應用的重要問題,在設計影像結合的光熱治療納米體系時,既要考慮材料毒性,也要考慮成像探針的生物安全性。如何利用生物相容性的材料、分子,通過簡單易行的策略合成具有生物相容性、安全性、功能性的多功能納米材料,是一個結合了化學、材料學、藥學、臨床醫學等多學科交叉的關鍵科學問題,也是可視化光熱治療最終走向臨床應用的重要研究方向。
目前腫瘤的臨床治療中,傳統、單一的療法并不能有效、理想地治愈腫瘤,腫瘤治療正向著多功能化、可視化的方向發展。因此,在結合影像手段之外,光熱治療應進一步結合化療、放療,實現組合治療或輔助手術治療,不僅有望治愈原發腫瘤,更有希望解決轉移性腫瘤的治療問題。
納米材料在體內靶向腫瘤的問題也是一項挑戰,目前的多功能光熱治療納米材料多通過EPR效應在腫瘤內富集,靶向分子、配體修飾后在體內應用的效果仍不明顯;原位注射的納米材料不易滯留,也存在利用度低的問題。如何利用有效的主動靶向和被動靶向實現多功能光熱轉化納米材料在腫瘤部位的有效富集,仍需進一步研究和探索。

表1 不同納米材料在多模態影像輔助的光熱治療中的應用
[1] Yang H,Maoa H,Wan Z,et al.Micelles assembled with carbocyanine dyes for theranostic near-infrared fuorescent cancer imaging and photothermal therapy[J].Biomaterials,2013,34(36):9124-9133.
[2] Zha Z,Deng Z,Li Y,et al.Biocompatible polypyrrole nanoparticles as a novel organic photoacoustic contrast agent for deep tissue imaging[J].Nanoscale,2013,5(10):4462-4467.
[3] Ju E,Dong K,Liu Z,et al.Tumor Microenvironment Activated Photothermal Strategy for Precisely Controlled Ablation of Solid Tumors upon NIR Irradiation[J].Adv Funct Mater,2015,25:1574-1580.
[4] Jaque D,Martínez Maestro L,del Rosal B,et al.Nanoparticles for photothermal therapies[J].Nanoscale,2014,6(16):9494-9530.
[5] Huang P,Lin J,Li W,et al.Biodegradable Gold Nanovesicles with an Ultrastrong Plasmonic Coupling Effect for Photoacoustic Imaging and Photothermal Therapy[J].Angew Chem Int Ed Engl,2013,52(52):13958-13964.
[6] Nakamura T,Tamura A,Murotani H,et al.Large payloads of gold nanoparticles into the polyamine network core of stimuliresponsive PEGylated nanogels for selective and noninvasive cancer photothermal therapy[J].Nanoscale,2010,2(5):739-746.
[7] Huang P,Bao L,Zhang C,et al.Folic acid-conjugated Silicamodified gold nanorods for X-ray/CT imaging-guided dualmode radiation and photo-thermal therapy[J].Biomaterials, 2011,32(36):9796-9809.
[8] Liang X,Li Y,Li X,et al.PEGylated Polypyrrole Nanoparticles Conjugating Gadolinium Chelates for Dual-Modal MRI/ Photoacoustic Imaging Guided Photothermal Therapy of Cancer[J].Adv Funct Mater,2015,25(9):1451-462.
[9] Shokeen M,Anderson CJ.Molecular Imaging of Cancer with Copper-64 Radiopharmaceuticals and Positron Emission Tomography (PET)[J].Acc Chem Res,2009,42(7):832-841.
[10] Jang B,Park S,Kang SH,et al.Gold nanorods for target selective SPECT/CT imaging and photothermal therapy in vivo[J].Quant Imaging Med Surg,2012,2(1):1-11.
[11] Wang LV,Hu S.Photoacoustic tomography:in vivo imaging from organelles to organs[J].Science,2012,335(6075):1458-1462.
[12] Agarwal A,Huang SW,O’Donnell M,et al.Targeted gold nanorod contrast agent for prostate cancer detection by photoacoustic imaging[J].J Appl Phys,2007,102:064701.
[13] Lin J,Wang S,Huang P,et al.Photosensitizer-Loaded Gold Vesicles with Strong Plasmonic Coupling Effect for Imaging-Guided Photothermal/ Photodynamic Therapy[J].ACS Nano,2013,7(6):5320-5329.
[14] von Maltzahn G,Park JH,Agrawal A,et al.Computationallyguided photothermal tumor therapy using long-circulating gold nanorod antennas[J].Cancer Res,2009,69(9):3892-3900.
[15] Cheng L,Liu J,Gu X,et al.PEGylated WS2Nanosheets as a Multifunctional Theranostic Agent for in vivo Dual-Modal CT/ Photoacoustic Imaging Guided Photothermal Therapy[J].Adv Mater,2014,26(12):1886-1893.
[16] Yang HW,Liu HL,Li ML,et al.Magnetic gold-nanorod/ PNIPAAmMA nanoparticles for dual magnetic resonance and photoacoustic imaging and targeted photothermal therapy[J].Bi omaterials,2013,34(22):5651-5660.
[17] Kim J,Park S,Lee JE,et al.Designed fabrication of multifunctional magnetic gold nanoshells and their application to magnetic resonance imaging and photothermal therapy[J].Angew Chem Int Ed Engl,2006,45(46):7754-7758.
[18] Dong W,Li Y,Niu D,et al.Facile synthesis of monodisperse superparamagnetic Fe3O4 Core@hybrid@Au shell nanocomposite for bimodal imaging and photothermal therapy[J].Adv Mater,2011,23(45):5392-5397.
[19] Ma M,Chen H,Chen Y,et al.Au capped magnetic core/mesoporous silica shell nanoparticles for combined photothermo-/chemo-therapy and multimodal imaging[J].Biomaterials, 2012,33(3):989-998.
[20] Ma X,Tao H,Yang K,et al.A Functionalized Graphene Oxide–Iron Oxide Nanocomposite for Magnetically Targeted Drug Delivery, Photothermal Therapy, and Magnetic Resonance Imaging[J].Nano Res,2012,5(3):199–212.
[21] Liu Z,Cai WB,He LN,et al.In vivo biodistribution and highly effcient tumour targeting of carbon nanotubes in mice[J].Nat Nanotechnol,2007,2:47-52.
[22] Zhou M,Zhang R,Huang M,et al.A chelator-free multifunctional [64Cu]CuS nanoparticle platform for simultaneous micro-PET/CT imaging and photothermal ablation therapy[J].J Am Chem Soc,2010,132(43):15351-15358.
[23] Robinson JT,Welsher K,Tabakman SM,et al.High performance in vivo near-IR (> 1μm) imaging and photothermal cancer therapy with carbon nanotubes[J].Nano Res,2010,3(11):779-793.
[24] Qian J,Jiang L,Cai F,et al.Fluorescence-surface enhanced Raman scattering co-functionalized gold nanorods as near-infrared probes for purely optical in vivo imaging[J].Biomaterials, 2011,32(6):1601-1610.
[25] Jang B,Park JY,Tung CH,et al.Gold nanorod-photosensitizer complex for near-infrared fluorescence imaging and photodynamic/photothermal therapy in vivo[J].ACS Nano, 2011,5(2):1086-1094.
[26] Yi DK,Sun IC,Ryu JH,et al.Matrix metalloproteinase sensitive gold nanorod for simultaneous bioimaging and photothermal therapy of cancer. [J].Bioconjugate Chem,2010,21(12):2173-2177.
[27] Yang K,Zhang S,Zhang G,et al.Graphene in mice: ultrahigh in vivo tumor uptake and effcient photothermal therapy[J].Nano Lett,2010,10(9):3318-3323.
[28] Lu W,Zhang G,Zhang R,et al.Tumor site-specifc silencing of NF-kappaB p65 by targeted hollow gold nanosphere-mediated photothermal transfection[J].Cancer Res,2010,70(8):3177-3188.
[29] Lu W,Melancon MP,Xiong C,et al.Effects of photoacoustic imaging and photothermal ablation therapy mediated by targeted hollow gold nanospheres in an orthotopic mouse xenograft model of glioma[J].Cancer Res,2011,71(19):6116-6121.
[30] Shi X,Gong H,Li Y,et al.Graphene-based magnetic plasmonic nanocomposite for dual bioimaging and photothermal therapy[J].Biomaterials,2013,34(20):4786-4793.
[31] Ma Y,Tong S,Bao G,et al.Indocyanine green loaded SPIO nanoparticles with phospholipid-PEG coating for dualmodal imaging and photothermal therapy[J].Biomaterials, 2013,34(31):7706-7714.
[32] Yang K,Hu L,Ma X,et al.Multimodal imaging guided photothermal therapy using functionalized graphene nanosheets anchored with magnetic nanoparticles[J].Adv Mater,2012,24(14):1868-1872.
[33] Peng CL,Shih YH,Lee PC,et al.Multimodal imageguided photothermal therapy mediated by 188Re-labeled micelles containing a cyanine-type photosensitizer[J].ACS nano,2011,5(7):5594-5607.
Nano-materials for Image-guided Tumor Photo-thermal Therapy
SUN Meng-meng, WANG Zhuo-ran, GAO Wei-ping
Department of Biomedical Engineering, School of Medicine, Tsinghua University, Beijing 100084, China
Photo-thermal therapy (PTT) is based on localized heating by light absorption for selective ablation of abnormal cells. PTT is highly selective to diseased sites, minimally invasive to normal tissues, and antiseptic in comparison with traditional therapies. The key component of PTT is photothermal transducers that can absorb and convert near-infrared light (NIR) into heat with high effciency. Up to date, a variety of NIR photothermal transducers have been developed. Application of NIR photothermal conversion nano-materials in imaging-assisted PTT as well as its development trend is focused in this review.
imaging; tumor therapy; photothermal therapy; nano-materials
R730.5
A
10.3969/j.issn.1674-1633.2016.06.005
1674-1633(2016)06-0024-05
2015-10-24
2015-12-17
國家自然科學基金面上項目(21274043);國家自然科學基金重點項目(21534006)。
高衛平,教授,從事生物材料與納米醫學研究。
通訊作者郵箱:gaoweiping@mail.tsinghua.edu.cn

