酶解銀杏蛋白制備α-葡萄糖苷酶抑制肽的研究
張 燦
吳彩娥1
范龔健1
李婷婷1
王佳宏1
曹福亮2
(1. 南京林業大學輕工科學與工程學院,江蘇 南京 210037; 2. 南京林業大學森林資源與環境學院,江蘇 南京 210037)
?
酶解銀杏蛋白制備α-葡萄糖苷酶抑制肽的研究
張 燦1
吳彩娥1
范龔健1
李婷婷1
王佳宏1
曹福亮2
(1. 南京林業大學輕工科學與工程學院,江蘇 南京 210037; 2. 南京林業大學森林資源與環境學院,江蘇 南京 210037)
為了獲得銀杏α-葡萄糖苷酶抑制肽,利用木瓜蛋白酶酶解銀杏蛋白,以α-葡萄糖苷酶抑制率為指標,考察底物濃度、酶底比、pH值、酶解溫度和酶解時間對酶解效果的影響,并且利用超濾截留不同分子量(100,50,30,10,3 kDa)的多肽。結果表明:在pH 7.36,酶解時間4.4 h,酶底比(5 g/100 g),酶解溫度57.9 ℃的條件下,α-葡萄糖苷酶抑制率最高為17.18%。分子量小于3 kDa多肽組分的α-葡萄糖苷酶抑制率最高為50.43%。因此,銀杏蛋白水解產物或其活性肽可應用在食品中用于高血糖及相關疾病的治療。
銀杏;α-葡萄糖苷酶;酶解;活性多肽
銀杏(Ginkgobiloba)為銀杏科銀杏屬多年生落葉喬木,被稱為“活化石”“植物界的大熊貓”,在中國的分布極廣。銀杏種仁又稱為白果,可以食用,具有止咳、化痰、潤肺平喘的作用[1]。銀杏種子營養豐富,其蛋白質含量(干基含量)約為10%,氨基酸組成合理,因此它屬于優質蛋白質。已經報道了銀杏蛋白具有抗氧化劑[2-3]和抗菌[4-5]的功能。
蛋白質多肽鏈內蘊含著很多功能活性多肽,經過水解后功能集團就會暴露出來,便顯出不同的活性,如調節神經、激素和免疫肽化合物、抗高血壓、降低膽固醇、抗癌、抗氧化等作用[6]。近年來,有許多文獻報道[7-10]從天然的動植物以及機體分離到降血糖肽,并且研究了它的結構和機制,其中一些已被用作抗糖尿病藥物或保健食品。
目前,糖尿病已經成為威脅人類健康的三大慢性病之一。它是胰島素分泌不足所引起的代謝紊亂[11],目前有效的治療方法是通過抑制碳水化合物水解酶的活性,如抑制α-葡萄糖苷酶的活性可以延緩餐后對葡萄糖的吸收[12-14]。據報道[15],從蛋清中已經分離得到α-葡萄糖苷酶抑制肽,可以發展為口服抗糖尿病藥物以控制高血糖癥2型糖尿病,且沒有副作用。最近,從蠶蛹[16]、雞蛋[15,17]、滿天星[18]、五味子[19]、牛[20]和益生菌[21]也得到了α-葡萄糖苷酶抑制肽。有關銀杏蛋白的研究多集中在抗氧化肽[22]和抑菌肽[23],銀杏蛋白制備α-葡萄糖苷酶抑制肽的研究卻沒有報道。本研究擬利用木瓜蛋白酶制備α-葡萄糖苷酶抑制肽,通過超濾純化,并驗證其降血糖的功能,旨在為銀杏資源的深加工和銀杏多肽的開發提供理論依據。
1 材料與方法
1.1 試驗材料與儀器
白果:產于江蘇泰興;
α-葡萄糖苷酶(100 U):分析純,美國Sigma公司;
木瓜蛋白酶:分析純,瑞陽生物工程有限公司;
堿性蛋白酶、風味蛋白酶、胰蛋白酶和胃蛋白酶:分析純,奧多福尼生物工程有限公司;
對硝基-α-吡喃葡萄糖苷:分析純,北京索萊寶專業生化公司;
其它試劑國產分析純;
電熱恒溫振蕩水槽:DKZ-2型,上海精宏試驗設備有限公司;
大容量低速離心機:DD-5M型,湖南湘儀實驗室儀器開發有限公司;
紫外可見分光光度計:UV-2802型,北京普析通用儀器有限責任公司;
pH計:PP-20-P1型,德國Sartorius公司;
冷凍干燥機:12L型,美國Labconco公司。
1.2 試驗方法
1.2.1 工藝流程
銀杏→預處理→堿溶酸沉→得沉淀→沉淀復溶→蛋白溶液→酶解→滅酶→離心→取上清→冷凍干燥→銀杏多肽
1.2.2 操作要點
(1) 預處理:將新鮮銀杏果去殼、去內種皮、去芯,真空冷凍干燥后,將其磨粉并過80目篩。之后用石油醚脫脂,按1∶10(g/mL)混勻,置于4 ℃下處理72 h,隔1~2 h攪拌一次,每隔24 h更換一次石油醚。用蒸餾水浸泡清洗至溶液變為無色,以除去殘留的石油醚。真空冷凍干燥48 h,壓力降到100 Pa。
(2) 堿溶酸沉:按1∶20(g/mL)料液比將脫脂白果粉溶于純水中,超聲20 min,超聲功率為300 W,用1%的NaOH溶液調pH至10.0,45 ℃水浴50 min,3 000 r/min離心15 min,取上清,用0.01%的HCl調pH至蛋白等電點4.62(采用聚丙烯酰胺凝膠等電聚焦電泳法測得其等電點),靜置2 h,3 000 r/min離心15 min,取沉淀,真空冷凍干燥48 h,得白果蛋白。
(3) 酶解:往蛋白溶液中加入蛋白酶水浴振蕩酶解,酶解后100 ℃滅酶10 min,然后在 3 000 r/min下離心15 min,取上清液。
1.2.3 酶活力的測定 按SB/T 23527—2009執行。
1.2.4α-葡糖苷酶抑制率的測定 在梁凱[24]的方法基礎上做一定的修改,加448 μL磷酸鉀緩沖液(pH 6.8),再加入 0.2 U/mLα-葡萄糖苷酶溶液 80 μL,45 μL樣品溶液(對照組用緩沖液代替),混勻,然后 37 ℃恒溫 15 min,加入80 μL 2.5 mmol/L PNPG(4-硝基苯-α-D-吡喃葡萄糖苷),混勻后再 37 ℃恒溫反應 15 min。最后加入 0.2 mol/L 的 Na2CO3溶液320 μL,再加入3 mL磷酸緩沖液,于405 nm波長下測定吸光值(A)。α-葡糖苷酶抑制率按式(1)計算:
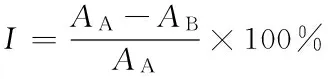
(1)
式中:
I——α-葡糖苷酶抑制率,%;
AA——樣 A 的光密度值,樣 A 在反應中不加抑制劑,用蒸餾水代替;
AB——樣 B 的光密度值,樣 B 在反應中加抑制劑。
1.3 試驗設計
1.3.1 蛋白酶的篩選 配制一定濃度的銀杏蛋白溶液,分別加入堿性蛋白酶、木瓜蛋白酶、胰蛋白酶、風味蛋白酶、胃蛋白酶,酶底比為5%,將其混合均勻,然后分別在各種酶的最適條件下(表1)水解4 h,以α-葡萄糖苷酶抑制率為考察指標,選擇最適蛋白酶進行后續的酶解試驗。
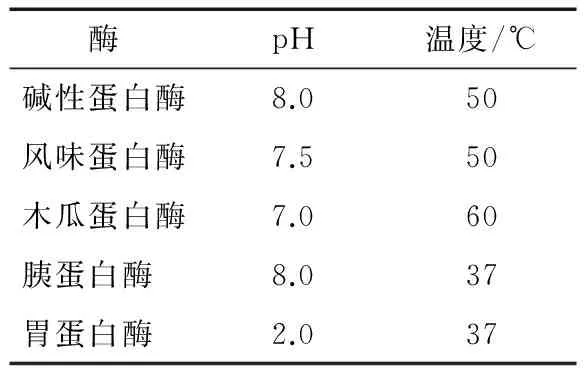
表1 5種蛋白酶的說明書反應條件Table 1 The instruction reaction conditions offive enzymes
1.3.2 酶解制備活性多肽單因素試驗 根據蛋白酶篩選的預試驗,利用篩選出最適蛋白酶進行酶解試驗,考察底物濃度、酶底比兩個因素對酶解效果的影響,以α-葡萄糖苷酶抑制率為指標,并對酶解工藝進行優化。
(1) 底物濃度對酶解效果的影響:固定酶底比為5%、pH值為7.0、溫度為60 ℃、酶解時間為4 h的條件下,以α-葡萄糖苷酶抑制率為指標,考察底物濃度(0.5%,1.0%,1.5%,2.0%,2.5%,3.0%)對酶解效果的影響。
(2) 酶底比對酶解效果的影響:固定底物濃度為1.5%、pH值為7.0、溫度為60 ℃、酶解時間為4 h的條件下,以α-葡萄糖苷酶抑制率為指標,考察蛋白酶底比(1,3,5,7,9,11 g/100 g)對酶解效果的影響。
1.3.3 銀杏蛋白酶解工藝優化 在預試驗的基礎上,以pH值、酶解溫度和酶解時間為考察因素,以α-葡萄糖苷酶抑制率為指標,對酶解工藝進行優化。選取pH、酶解溫度和酶解時間作為試驗因素,以α-葡萄糖苷酶抑制率為指標,設計三因素三水平響應面試驗(表2),分析各試驗因素及交互作用對α-葡萄糖苷酶抑制率的影響。
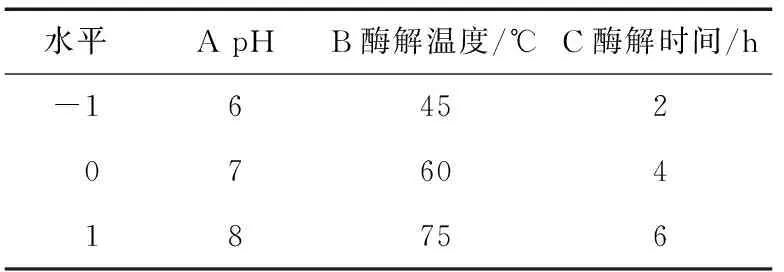
表2 響應面設計因素水平表Table 2 Factors and levels in response surface design
1.3.4 銀杏多肽的分離 參照文獻[25],采用超濾離心管(100,50,30,10,3 kDa)進行分離。共得到6個組分(>100,50~100,30~50,10~30,3~10,<3 kDa),然后測定不同組分對α-葡萄糖苷酶的抑制率。
1.4 數據分析
采用統計學軟件SPSS 20.0進行單因素方差分析,以平均數±標準差表示;采用Design-Expert 7.0軟件對響應面設計試驗數據進行分析。
2 結果與分析
2.1 酶活力的測定
圖1是以酪氨酸濃度為橫坐標,吸光度值為縱坐標繪制的標準曲線以測酶活。試驗測得堿性蛋白酶、木瓜蛋白酶、胰蛋白酶、風味蛋白酶和胃蛋白酶的酶活力分別為73 527.16,78 579.24,71 098.28,8 551.61,8 229.10 U/g。

圖1 酪氨酸標準曲線圖Figure 1 Standard curve of tyrosine
2.2 蛋白酶的篩選
由圖2可知,木瓜蛋白酶的抑制率最強,堿性蛋白酶其次,風味蛋白酶效果最差。因此,以下試驗選擇木瓜蛋白酶進行。
2.3 底物濃度的確定
由圖3可知,在底物濃度為1.5%時,酶解產物對α-葡萄糖苷酶抑制率達到最大。在0.5%~1.5%時,隨著底物濃度的增加,對α-葡萄糖苷酶的抑制率也逐漸增加,這是因為當底物濃度含量較低時,在一定的時間內只有一部分的酶可以與底物結合形成中間產物,但是隨著酶濃度增加,底物與酶結合的機會也增加,因此對α-葡萄糖苷酶抑制率變大;在1.5%~3.0%時,隨著底物濃度的增加,對α-葡萄糖苷酶抑制率逐漸降低,因為當濃度很大時,反應體系中的酶分子完全與底物結合生產中間產物,此時底物濃度雖然再增加但已經沒有可以利用的酶與之結合,因此導致酶解產物對α-葡萄糖苷酶抑制率不再增加。

圖2 酶種類對α-葡萄糖苷酶抑制率的影響
Figure 2α-glucosidase inhibitory activities of enzymatic hydrolysates fromGinkgobyproduct protein

圖3 底物濃度對α-葡萄糖苷酶抑制率的影響Figure 3 Effect of substrate concentration on papain hydrolization
2.4 酶底比的確定
由圖4可知,隨著酶底比(E/S)的增加,α-葡萄糖苷酶抑制率先增加,這是由于E/S比例增加時更多的酶能夠與底物結合,α-葡萄糖苷酶抑制率明顯增加。當E/S的比值超過5 g/100 g時,雖然酶的數量仍在增加,但底物已經充分與酶結合,蛋白酶達到一定量時,大部分蛋白質幾乎達到了水解平衡,所以α-葡萄糖苷酶抑制率不再隨著E/S增加而增加,其機理目前尚不清楚,有待進一步研究,個人認為酶解反應是在液體環境中進行的,當酶的量越來越多時,會影響酶解反應的環境,受此影響,α-葡萄糖苷酶抑制率會有所下降。因此,最佳酶底比為5 g/100 g。
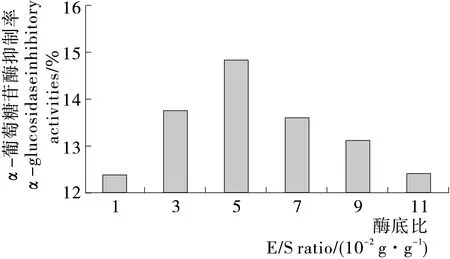
圖4 對α-葡萄糖苷酶抑制率的影響Figure 4 Effect of E/S ratio on papain hydrolization
2.5 酶解工藝條件優化
2.5.1 Box-Behnken試驗結果 在單因素試驗基礎上,選pH、酶解溫度和酶解時間作為試驗因素,以α-葡萄糖苷酶抑制率為響應值,采用Box-Behnken試驗設計,試驗方案及結果見表3。
2.5.2 Box-Behnken試驗結果方差分析 利用Design expert軟件對表3數據進行多元回歸擬合,得到響應值Y對α-葡萄糖苷酶抑制率為響應關鍵因素的二次多項回歸模型為:
Y=16.74+1.56A-0.70B+1.10C+0.62AB-0.81AC+0.12BC-1.82A2-1.70B2-1.94C2。
(2)
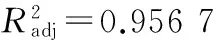
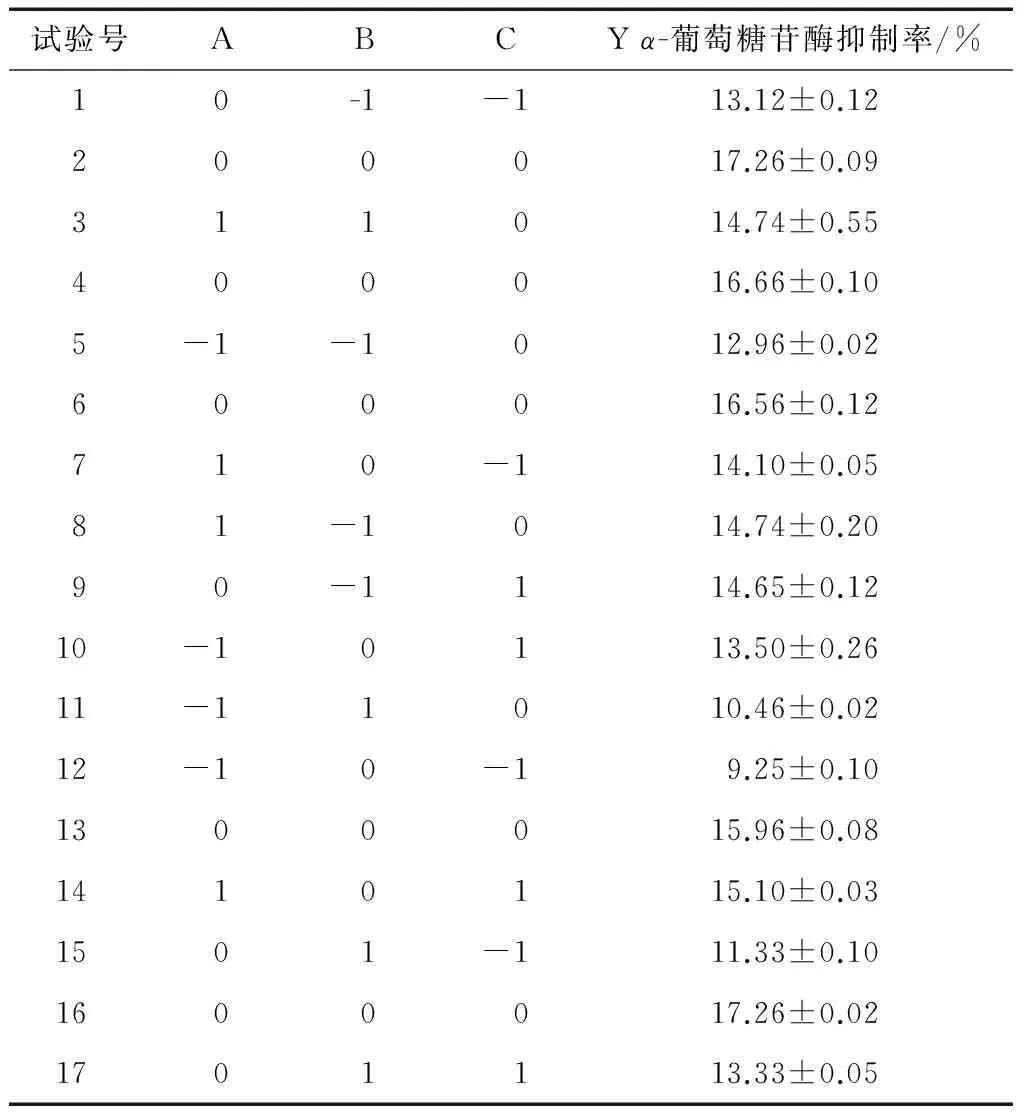
表3 響應面分析試驗設計及結果Table 3 The design and results of response surface experiment

表4 α-葡萄糖苷酶抑制率回歸模型方差分析Table 4 Significance check of the regression equation
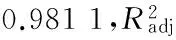
2.5.3 響應面因素的效應分析及優化結果 由圖5可知,在選定的試驗條件之內,固定一個變量,α-葡萄糖苷酶抑制率的大小先隨著另一個變量的升高而增大,在達到最高值后會隨著另一個變量的升高而減小。規律符合預試驗及方差分析結果。

圖5 AB及AC對α-葡萄糖苷酶抑制率交互影響 的響應曲面圖
Figure 5 Response surface piotshowing the interactive effects ofpH and temperature, pH and time on α- glucosidase inhibitory rate
通過軟件分析:最適pH 值為7.36,酶解時間4.40 h,最適溫度57.9 ℃。在此條件下,進行3次實驗取平均值,測得α-葡萄糖苷酶抑制率為 17.09%與預測值(17.18%)較接近,證明該模型的可行性和有效性。
2.6 超濾分離
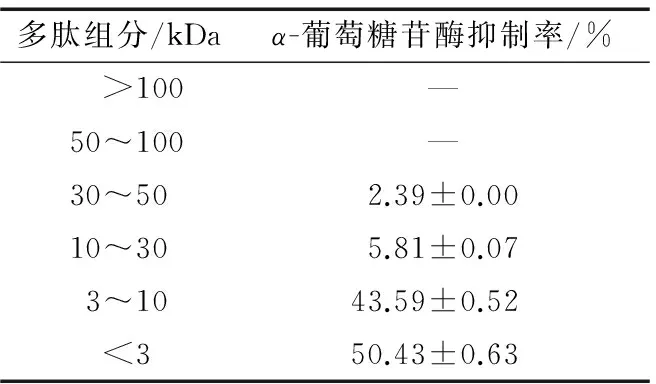
采用超濾離心管對最佳工藝制備出的銀杏活性多肽進行分離,得到6個組分,不同組分對α-葡萄糖苷酶抑制率見表5。
表5 不同多肽組分的α-葡萄糖苷酶抑制率
Table 5α-glucosidase inhibitory activities of each peptide fraction ofGinkgoprotein hydrolysates
多肽組分/kDaα-葡萄糖苷酶抑制率/% >100—50~100—30~502.39±0.0010~305.81±0.073~1043.59±0.52<350.43±0.63
? “—”表示無α-葡萄糖苷酶抑制率。
由表5可知,分子量<3 kDa組分的α-葡萄糖苷酶抑制率最高,為50.43%;低分子量肽具有更高α-葡萄糖苷酶抑制活性,可能是它們可以與α-葡萄糖苷酶作用的底物對硝基苯-α-D-葡萄糖苷競爭性地抑制,從而降低了α-葡萄糖苷酶活性。
3 結論
本試驗結果表明,最佳酶源是木瓜蛋白酶,酶解的最佳工藝為底物濃度1.5%,酶底比5 g/100 g,pH值7.36,酶解時間4.4 h,酶解溫度57.9 ℃。此條件下對α-葡萄糖苷酶抑制率為 17.09%。同時經過超濾得到不同分子量大小的組分,其中分子量<3 kDa的組分對α-葡萄糖苷酶抑制率最高為50.43%。
銀杏多肽具有抗氧化和抑菌的作用,但有關銀杏多肽的降血糖作用的報道幾乎沒有,本研究體外試驗僅證實銀杏多肽具有α-葡萄糖苷酶抑制率,但并不能說明其具有體內降血糖活性。研究其對動物的血糖、膽固醇和甘油三酯等方面的影響需做進一步的動物試驗。
[1] 曹福亮. 銀杏[M]. 北京: 中國林業出版社, 2007: 102-103.
[2] RUAN Gui-hua, CHEN Zheng-yi, WEI Mei-ping, et al. The study on microwave assisted enzymatic digestion of ginkgo protein[J]. Journal of Molecular Catalysis B: Enzymatic, 2013, 94: 23-28.
[3] HATANO K I, MIYAKAW T, SAWANO Y, et al. Antifungal and lipid transfer proteins from ginkgo (Ginkgo biloba) seeds[J]. Nuts and Seeds in Health and Disease Prevention, 2011, 63: 527-534.
[4] HUANG Xu, XIE Wei-jun, GONG Zhen-zhen. Characteristics and antifungal activity of a chitin binding protein from Ginkgo biloba[J]. Febs Letters, 2000, 478: 123-126.
[5] WANG Hui, DU Yang-ji, SONG Hua-can.α-Glucosidase andα-amylase inhibitory activities of guava leaves[J]. Food Chemistry, 2010, 123(1): 6-13.
[6] 孔令明, 李芳, 陶永霞, 等. 多肽的功能活性與研究進展[J]. 中國食品添加劑, 2009(3): 71-73.
[7] HEMALATHA P, BOMZAN D P, SATHYENDRA Rao B V, et al. Distribution of phenolic antioxidants in whole and milled fractions of quinoa and their inhibitory effects onα-amylase andα-glucosidase activities[J]. Food Chemistry, 2016, 199: 330-338.[8] LIU Chao, XIANG Wei, YU Yan, et al. Comparative analysis of 1-deoxynojirimycin contribution degree to α-glucosidase inhibitory activity and physiological distribution in Morus alba L[J]. Industrial Crops and Products, 2015, 70: 309-315.
[9] ZHAO Deng-gao, ZHOU Ai-yu, DU Zhi-yun, et al. Coumarins withα-glucosidase andα-amylase inhibitory activities from the flower of Edgeworthiagardneri[J]. Fitoterapia, 2015, 107: 122-127.
[10] CHOI CI, LEE SR, KIM KH. Antioxidant andα-glucosidase inhibitory activities of constituentsfromEuonymus alatustwigs[J]. Ind. Crop Prod., 2015, 76: 1 055-1 060.
[11] SHARMA A K, THANIKACHALAM P V, RAJPUT S K. Albiglutide: Is a better hope against diabetes mellitus?[J]. Biomedicine & Pharmacotherapy, 2016, 77: 120-128.
[12] YANG Dan, XIE Hai-hui, JIANG Yue-ming, et al. Phenolics from strawberry cv. Falandi and their antioxidant andα-glucosidase inhibitory activities[J]. Food Chemistry, 2016, 194: 857-863.
[13] QIAN Jian-ya, BAI Ye-yu, TANG Jing, et al. Antioxidation andα-glucosidase inhibitory activities of barley polysaccharides modified with sulfation[J]. LWT - Food Science and Technology. 2015, 64(1): 104-111.
[15] YU Zhi-peng, YIN Yong-guang, ZHAO Wen-zhu, et al. Novel peptides derived from egg white protein inhibiting alpha-glucosidase[J]. Food Chemistry, 2011, 129(4): 1 376-1 382.
[16] ZHANG Yu, WANG Nan, WANG Wei, et al. Molecular mechanisms of novel peptides from silkworm pupae that inhibit α-glucosidase[J]. Peptides, 2016, 76: 45-50.
[17] YU Zhi-peng, YIN Yong-guang, ZHAO Wen-zhu, et al. Anti-diabetic activity peptides from albumin against α-glucosidase and α-amylase[J]. Food Chemistry, 2012, 135(3): 2 078-2 085.
[18] LUO Jian-guang, WANG Xiao-bing, MA Li, et al. Gypsophin: A novelα-glucosidase inhibitory cyclic peptide from the roots of Gypsophila oldhamiana[J]. Bioorganic & Medicinal Chemistry Letters, 2007, 17(16): 4 460-4 463.
[19] FANG Lin-lin, CAO Jia-qing, DUAN Li-li, et al. Protein tyrosine phosphatase 1B (PTP1B) and α-glucosidase inhibitory activities of Schisandrachinensis (Turcz.) Baill[J]. Journal of Functional Foods, 2014, 9: 264-270.
[20] BRANDELLI A, DAROIT D J, CORRA A P F. Whey as a source of peptides with remarkable biological activities[J]. Food Research International, 2015, 73: 149-161.
[21] RAMCHANDRAN L, SHAH N P. Influence of addition of Raftiline HP? on the growth, proteolytic, ACE- and α-glucosidase inhibitory activities of selected lactic acid bacteria and Bifidobacterium[J]. LWT - Food Science and Technology, 2010, 43(1): 146-152.
[22] 賈韶千. 銀杏抗氧化肽的制備活性研究分離純化[D]. 南京: 南京林業大學, 2011: 67-81.
[23] 荊貝貝. 銀杏種仁抗菌肽的分離純化、性質鑒定及其總RNA提取[D]. 陜西: 西北農林科技大學, 2006: 45-51.
[24] 梁凱. 漢麻籽粕降血糖肽的酶法制備及其分離純化[D]. 廣州: 華南理工大學, 2011: 39.
[25] POWER O, FERNNDEZ A, NORRIS R, et al. Enzyme-assisted extraction and identification of antioxidative andα-amylase inhibitory peptides from Pinto beans (Phaseolus vulgaris cv. Pinto)[J]. J. Funct. Foods, 2014, 9: 38-47.
Preparation ofα-glucosidase inhibitory peptides derived from Ginkgo biloba by enzymatic method
ZHANG Can1
WUCai-e1
FANGong-jian1
LITing-ting1
WANGJia-hong1宮 號1GONGHao1
CAOFu-liang2
(1.CollegeofLightIndustryScienceandEngineering,NanjingForestryUniversity,Nanjing,Jiangsu210037,China;2.CollegeofForestResourcesandEnvironment,NanjingForestryUniversity,Nanjing,Jiangsu210037,China)
The preparation ofα-glucosidase inhibitory peptides was gotten, which was derived from ginkgobilobaby enzymatic hydrolysis with papain. A factorial design experiment was conducted, while, the effects of concentration of substrate, pH, E/S ratio, extraction temperature and time were studied. And then, it was fractioned by using membrane ultrafiltration with molecular weight cutoffs of 100, 50, 30, 10 and 3 kDa. The results showed: with the concentration of substrate 1.5%, pH 7.36, E/S ratio of 5 g/100 g, temperature of 57.9 ℃ and extraction time of 4.4 h, the inhibitory activities ofα-glucosidase was the highest, and reached 17.18%. The inhibitory activities ofα-glucosidase, peptide fraction <3 kDa, exhibited the highest and reached 50.43%. Therefore, the ginkgo protein hydrolysate or its active peptides can be used in foods against hypertension and related diseases.Keywords:Ginkgobiloba; alpha-glucosidase; enzymatic hydrolysis; bioactive peptide
國家科技支撐計劃項目(編號:2012BAD21B04) ;江蘇省科技支撐計劃重點研發項目(編號:BE2015315);江蘇高校優勢學科建設工程資助項目(編號:PAPD)
張燦,女,南京林業大學在讀碩士研究生。
吳彩娥(1963—),女,南京林業大學教授,博士。 E-mail:wucaie@njfu.edu.cn
2016—07—29
10.13652/j.issn.1003-5788.2016.11.031

