軟體動物扇貝橫紋肌中類肌聯蛋白的純化
包玉龍,張三潤,薩日娜,鄭明霞,邢萬金,周好樂
(1.內蒙古醫科大學基礎醫學院,內蒙古 呼和浩特 010059;2.鄂爾多斯市衛生學校,內蒙古 鄂爾多斯 017000;3.內蒙古大學生命科學學院,內蒙古 呼和浩特 010022)
軟體動物扇貝橫紋肌中類肌聯蛋白的純化
包玉龍1,張三潤1,薩日娜2,鄭明霞1,邢萬金3,周好樂1
(1.內蒙古醫科大學基礎醫學院,內蒙古 呼和浩特 010059;2.鄂爾多斯市衛生學校,內蒙古 鄂爾多斯 017000;3.內蒙古大學生命科學學院,內蒙古 呼和浩特 010022)
利用含1 mol/L尿素的0.15 mol/L磷酸鉀緩沖液(pH=7.0)從扇貝橫紋肌肌原纖維中提取了相對分子質量為2.0×106的類肌聯蛋白.將類肌聯蛋白提取液添加到DEAE-TOYOPEARL 650M型層析柱,利用陰離子交換柱層析法對其進行了純化,并利用共沉淀法研究了扇貝類肌聯蛋白與纖維型肌動蛋白(F-actin)的相互作用.結果表明:纖維型肌動蛋白不產生沉淀,但扇貝類肌聯蛋白和纖維型肌動蛋白產生共沉淀,類肌聯蛋白可能是存在于軟體動物橫紋肌中的一種新型的肌聯蛋白樣蛋白.
軟體動物;扇貝;肌聯蛋白樣蛋白;蛋白提取;蛋白純化;蛋白相互作用
肌聯蛋白是相對分子質量約為3.0×106的巨大彈性蛋白質[1],由1個分子連接肌小節的Z線到M線[2-3].肌聯蛋白的彈性與肌小節的結構維持和被動張力有關[4].這種彈性性質與存在于肌小節I帶區域的免疫球蛋白(immunoglobulin,Ig)結構域、PEVK區域、特殊序列有關[2,5-7].
另一方面,在無脊椎動物橫紋肌中從其一級結構到抗體交叉反應上,存在很多類似肌聯蛋白的肌聯蛋白樣蛋白(connectin-like protein).如線蟲TTN-1(C.elegansTTN-1)、小龍蝦凸出蛋白(crayfish projectin)、昆蟲凸出蛋白等[8-12].
在軟體動物平滑肌中,在細肌絲(thin filament)與粗肌絲(thick filament)相互作用而產生收縮后,存在一種叫作捕捉(catch)的結構,它能利用少量能量維持長時間的張力.這種狀態與相對分子質量為53萬的肌聯蛋白樣蛋白顫搐蛋白(twitchin)有關.貽貝顫搐蛋白的一級結構已被確定,它是由24個Ig結構域和15個纖連蛋白3型(fibronectin type 3,Fn)結構域組成,在C末端附近存在1個激酶結構域.在肌小節中定位于粗肌絲,與肌球蛋白等粗肌絲組成的蛋白相結合[13-14].
到目前為止,軟體動物肌聯蛋白樣蛋白,除了顫搐蛋白以外尚未有報道.關于軟體動物橫紋肌收縮、舒展時肌小節結構維持的機制尚不明確.在對扇貝橫紋肌全蛋白提取液進行SDS-PAGE檢測時,發現在相對分子質量為2.0×106(類肌聯蛋白)的位置出現了條帶,并與脊椎動物肌聯蛋白抗體產生交叉反應.因此,該蛋白可能是存在于軟體動物中的新型的肌聯蛋白樣蛋白,可能對軟體動物橫紋肌的結構維持與被動張力的產生起到決定性的作用.本實驗對扇貝橫紋肌中存在的相對分子質量為2.0×106的蛋白進行提取純化,探討了該蛋白與肌動蛋白的相互作用.
1 材料與方法
1.1 材料
在蝦夷扇貝(Mizuhopectenyessoensis)橫紋肌中提取扇貝類肌聯蛋白;在兔骨骼肌中提取球型肌動蛋白.
1.2 實驗方法
1.2.1 SDS-PAGE和蛋白印記實驗
SDS-PAGE采用Laemmli[15]的方法進行,使用無濃縮膠的2.3%~4%,2%~15%,2%~6%的梯度凝膠,凝膠染色使用考馬斯亮藍.
蛋白印記時,先用SDS-PAGE將蛋白質分離后,再轉膜到硝酸纖維素(NC)膜上[16].使用含3%明膠(Gelatin)的TBS緩沖液(pH=7.5)將此膜封閉,使用含1%明膠的TBS緩沖液(pH=7.5)稀釋的一抗進行反應.TBS緩沖液漂洗后,使用含1%明膠的TBS緩沖液(pH=7.5)稀釋的辣根過氧化物酶(HRP)標記的二抗進行反應.用TBS緩沖液漂洗后,用3,3,-二氨基聯苯胺(DAB)顯色.
1.2.2 扇貝類肌聯蛋白的提取
在肌原纖維緩沖液(40 mmol/L KCl,5 mmol/L 磷酸鉀(pH=7.0),1 mmol/L MgCl2,0.1 mmol/L EGTA)中將扇貝橫紋肌粉碎,5 000 r/min離心5 min,棄上清,此步反復6次,制備肌原纖維.然后用1 mmol/L NaHCO3將肌原纖維漂洗10 min,6 000 r/min離心10 min,棄上清,此步反復3次;待充分膨脹后,再用30 mmol/L NaCl漂洗10min,6 000 r/min離心10 min,棄上清.離心后的殘渣用0.1 mol/L磷酸鉀(pH=7.0)提取15 min,6 000 r/min離心20 min,棄上清液,保留殘渣.用蒸餾水將此殘渣漂洗3次,使殘渣中的離子強度降下來后,再用30 mmol/L NaCl洗滌3次.最后使用含1 mol/L尿素的0.15 mol/L磷酸鉀(pH =7.0)提取5 min,7 000 r/min離心20 min,得到的上清液即為扇貝類肌聯蛋白提取液.
1.2.3 扇貝類肌聯蛋白的純化
將扇貝類肌聯蛋白提取液添加到用0.15 mol/L磷酸鉀(含1 mol/L尿素,pH=7.0)平衡的DEAE-TOYOPEARL 650M(TOSOH)型層析柱,然后用0.25 mol/L磷酸鉀(含1 mol/L尿素,pH=7.0)洗脫,得到扇貝類肌聯蛋白的粗純化組分.
將得到的粗純化組分在含2 mol/L尿素的0.15 mol/L磷酸鉀(pH=7.0)中透析12 h,再度添加到用0.15 mol/L磷酸鉀(含2 mol/L尿素)平衡的DEAE-TOYOPEARL 650M(TOSOH)型層析柱中,用含2 mol/L尿素的0.25 mol/L磷酸鉀緩沖液洗脫,得到扇貝類肌聯蛋白的純化組分.
1.2.4 共沉淀實驗
將扇貝類肌聯蛋白純化組分經0.15 mol/L磷酸鉀緩沖液(pH=7.0)透析一夜后,13 000 r/min離心20 min,取上清液作為類肌聯蛋白使用.對上清液進行BCA法蛋白濃度測定,其質量濃度為228 mg/mL.肌聯蛋白和肌動蛋白物質的量比約為1∶190,因此肌動蛋白的質量濃度為160 mg/mL,應混合的肌聯蛋白質量濃度為60 mg/mL.但實驗中考慮到扇貝類肌聯蛋白純化物中的雜質蛋白較多,估算扇貝類肌聯蛋白約占1/3,因此用扇貝類肌聯蛋白原始的質量濃度228 mg/mL和肌動蛋白質量濃度160 mg/mL進行實驗.將類肌聯蛋白(228 mg/mL)和肌動蛋白(160 mg/mL)在45 mmol/L磷酸鉀緩沖液(pH=7.0)、10 mmol/L KCl 24℃條件下反應1 h;13 000 r/min,離心30 min,分離上清和沉淀,用2%~15%的梯度凝膠進行分離觀察.
2 結果
2.1 扇貝橫紋肌蛋白的提取
利用2.3%~4.0%梯度凝膠分離的扇貝橫紋肌全蛋白提取物的結果表明,相對分子質量2.0×105以上的位置出現了4個條帶.相對分子質量約為2.0×106的蛋白為類肌聯蛋白,相對分子質量為5.3×105的蛋白為顫搐蛋白,其他蛋白尚不清楚(見圖1A).
使用脊椎動物肌聯蛋白單克隆抗體(Mc3Bq)進行的蛋白印記結果表明,相對分子質量5.3×105的顫搐蛋白和類肌聯蛋白產生了交叉反應,但與類肌聯蛋白的反應較弱(見圖1B).
2.2 扇貝類肌聯蛋白的提取
從0.15 mol/L磷酸鉀(含1 mol/L尿素,pH=7.0)溶液提取的類肌聯蛋白的SDS-PAGE結果可以看出,扇貝類肌聯蛋白提取液中除了類肌聯蛋白以外還含有大量的肌球蛋白、肌動蛋白等其他蛋白質(見圖2).

圖1 扇貝橫紋肌全蛋白提取液的SDS-PAGE和蛋白印跡
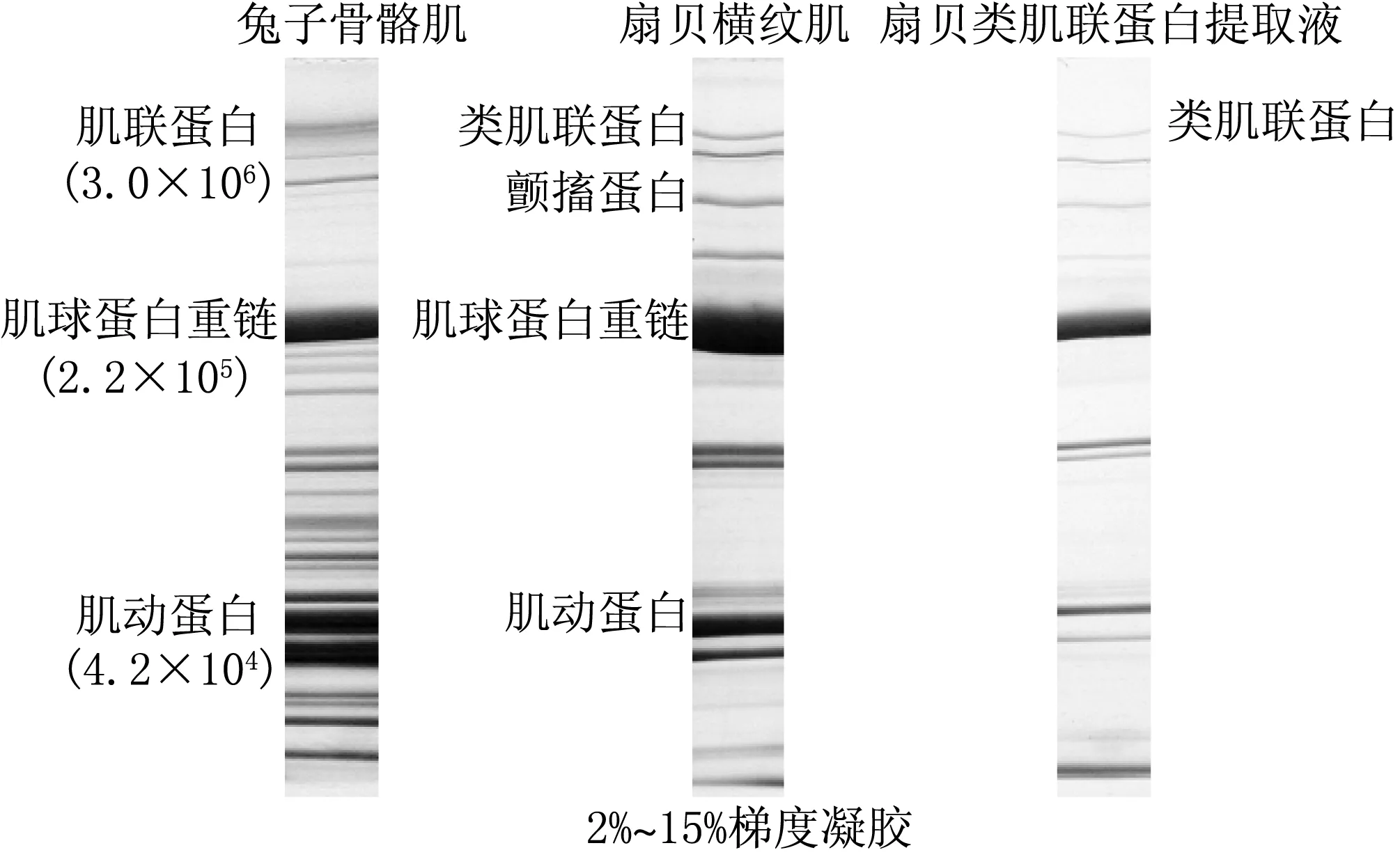
圖2 扇貝類肌聯蛋白提取液SDS-PAGE
2.3 扇貝類肌聯蛋白的純化
使用陰離子交換柱層析法對類肌聯蛋白進行第一次純化的結果表明,用0.25 mol/L磷酸鉀(含1 mol/L尿素,pH=7.0) 階段洗脫后,出現了明顯的洗脫高峰.對純化的各組分進行的SDS-PAGE結果顯示,流出液當中沒有出現扇貝類肌聯蛋白的條帶,說明扇貝類肌聯蛋白被層析柱充分吸附.而在洗脫峰d點的洗脫液中出現了較粗的扇貝類肌聯蛋白條帶,說明得到了較高濃度的扇貝類肌聯蛋白的粗純化組分.但其粗純化組分中混有較多的肌球蛋白和肌動蛋白(見圖3A).
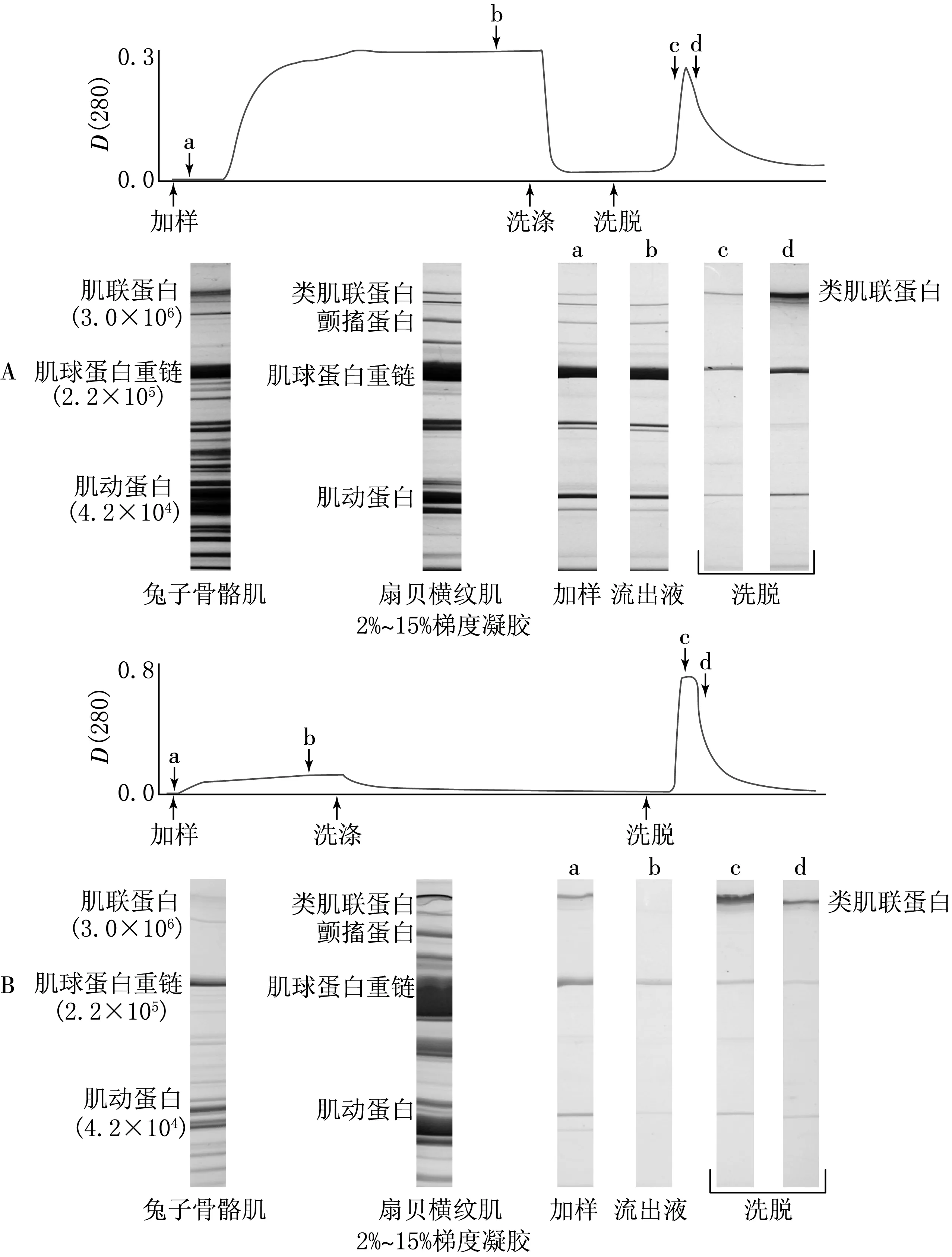
A第一次柱層析;B第二次柱層析
為了去除扇貝類肌聯蛋白粗純化組分中的雜質蛋白,進行第二次柱層析.結果表明,在利用含0.25 mol/L磷酸鉀(pH=7.0)洗脫時,出現了洗脫峰,對其洗脫組分進行的SDS-PAGE結果顯示,各洗脫組分均含有較高濃度的扇貝類肌聯蛋白,但仍混有少量的肌球蛋白和肌動蛋白,未能將其完全除去(見圖3B).
2.4 扇貝類肌聯蛋白與纖維型肌動蛋白的結合性

T 未離心;S 上清液;P 沉淀圖4 扇貝類肌聯蛋白與肌動蛋白的共沉淀實驗
將得到的類肌聯蛋白純化組分與兔骨骼肌的纖維型肌動蛋白進行共沉淀實驗.SDS-PAGE檢測結果表明,僅對纖維型肌動蛋白離心分離后,纖維型肌動蛋白大部分在上清中可見;僅對類肌聯蛋白離心分離后,類肌聯蛋白有近一半在上清,另一半存在于沉淀;而對類肌聯蛋白和纖維型肌動蛋白反應后的混合物進行分離后,纖維型肌動蛋白和類肌聯蛋白幾乎都存在于沉淀中(見圖4).這表明,纖維型肌動蛋白和類肌聯蛋白發生了結合.
3 討論
扇貝類肌聯蛋白難溶于鹽,在不用尿素的條件下提取量非常少,因此,在提取時加入了尿素,以得到高濃度的類肌聯蛋白(見圖2).在加入1 mol/L和2 mol/L尿素的實驗條件下,未發現差異,所以本實驗使用了較低濃度的1 mol/L尿素進行提取.在提取類肌聯蛋白時加入尿素使得類肌聯蛋白的提取量大大增加,但同時其他蛋白的提取量也隨之增加,所以進行柱層析時出現了阻塞的現象,因此,使用10倍體積的液體量進行提取,使類肌聯蛋白的提取量增加的同時,降低了其他蛋白的濃度,解決了層析柱阻塞的問題.SDS-PAGE的結果顯示,在類肌聯蛋白提取液中除了類肌聯蛋白以外還混有肌球蛋白等多種蛋白質,但通過初次的陰離子交換柱層析法去除了大量的雜質蛋白(見圖3A).在粗純化組分中,除了類肌聯蛋白以外還有未能去除的肌球蛋白等.因此,對粗純化組分再度利用柱層析進行了純化.再度純化時,為了降低蛋白間的相互作用,在加入了2 mol/L尿素的0.15 mol/L 磷酸鉀緩沖液(pH=7.0)中進行12 h的透析.在加入2 mol/L尿素的條件下,再度進行陰離子交換柱層析,得到了類肌聯蛋白的純化組分(見圖3B).與加入1 mol/L尿素的條件下進行的柱層析相比較,不附著于樹脂柱的肌球蛋白的量增加,洗脫出的類肌聯蛋白的比例增加.
為闡明扇貝類肌聯蛋白的性質,我們研究了類肌聯蛋白與肌動蛋白間的相互作用.因為類肌聯蛋白純化組分中含有尿素,使用不含尿素的溶液(0.15 mol/L 磷酸鉀,pH=7.0)進行透析后,進行了結合實驗.類肌聯蛋白和纖維型肌動蛋白的結合實驗結果證明,類肌聯蛋白和纖維型肌動蛋白可相互結合(見圖5).結合的原因可能是:(1)類肌聯蛋白和纖維型肌動蛋白直接結合;(2)類肌聯蛋白和纖維型肌動蛋白通過與類肌聯蛋白純化組分中未被去除的肌球蛋白相互作用而結合.我們的結果雖然不能否定類肌聯蛋白純化組分中未能完全去除的肌球蛋白與肌動蛋白相互作用而產生沉淀,但從類肌聯蛋白純化組分中含有的肌球蛋白的量與類肌聯蛋白相比其量較少,與類肌聯蛋白的沉淀和纖維型肌動蛋白的沉淀相比較,類肌聯蛋白和纖維型肌動蛋白混合反應后,兩者的沉淀比例明顯增加,表明類肌聯蛋白和纖維型肌動蛋白極可能是直接相結合的.
綜上所述,扇貝類肌聯蛋白與顫搐蛋白一樣可以和肌動蛋白相互作用.軟體動物中存在的顫搐蛋白已證實是與肌動蛋白、肌球蛋白相互作用的肌聯蛋白樣蛋白.本實驗的結果表明,扇貝類肌聯蛋白與顫搐蛋白一樣具有與肌動蛋白結合的能力.因此類肌聯蛋白可能是存在于軟體動物橫紋肌中的一種新型的肌聯蛋白樣蛋白.有關該蛋白的一級結構及其在肌原纖維中的定位,以及進一步證明該蛋白是軟體動物橫紋肌中的一種新型的肌聯蛋白樣蛋白還需更深入的研究.
[1] MARUYAMA K.Connectin,an elastic filamentous protein of striated muscle[J].Int Rev Cytol,1986,104:81-114.
[2] FURST D O,OSBORN M,NAVE R,et al.The organization of titin filaments in the half-sarcomere revealed by monoclonal antibodies in immunoelectron microscopy: a map of ten nonrepetitive epitopes starting at the Z line extends close to the M line[J].J Cell Biol,1988,106:1563-1572.
[3] MARUYAMA K.Connectin,an elastic protein of striated muscle[J].Biophys Chem,1994,50: 73-85.
[4] NEIVA-SOUSA M,ALMEIDA-COELHO J,FALCO-PIRES I,et al.Titin mutations: the fall of Goliath[J].Heart Fail Rev,2015,20(5):579-588.
[5] LINKE W A,HAMDANI N.Gigantic business: titin properties and function through thick and thin[J].Circ Res,2014,114(6):1052-1068.
[6] GRITSYNA IU V,SALMOV N N,VIKHLIANTSEV I M,et al.Changes in gene expression and content of titin(connectin) in striated muscles of chronically etihanol-fed rats[J].Mol Biol(Mosk),2013,47(6):996-1003.
[7] OHTSUKA S,HANASHIMA A,KUBOKAWA K,et al.Amphioxus connectin exhibits merged structure as invertebrate connectin in I-band region and vertebrate connectin in A-band region[J].J Mol Biol,2011,409(3): 415-426.
[8] FORBES J G,FLAHERTY D B,MA K,et al.Extensive and modular intrinsically disordered segments inC.elegansTTN-1 and implications in filament binding,elasticity and oblique striation[J].J Mol Biol,2010,398(5):672-689.
[9] YUAN C C,MA W,SCHEMMEL P,et al.Elastic proteins in the flight muscle ofManducasexta[J].Arch Biochem Biophys,2015,568:16-27.
[10] AYME-SOUTHGATE A J,TURNER L,SOUTHGATE R J.Molecular analysis of the muscle protein projectin in Lepidoptera[J].J Insect Sci,2013(13):88.
[11] AYME-SOUTHGATE A,PHILIPP R A,SOUTHGATE R J.Projectin PEVK domain,splicing variants and domain structure in basal and derived insects[J].Insect Mol Biol,2011,20(3):347-356.
[12] HU D H,MATSUNO A,TERAKADO K,et al.Projectin is an invertebrate connectin(titin): isolation from crayfish claw muscle and localization in crayfish claw muscle and insect flight muscle[J].J Muscle Res Cell Motil,1990,11(6):497-511.
[13] FUNABARA D,WATANABE D,SATOH N,et al.Genome-wide survey of genes encoding muscle proteins in the pearl oyster,Pinctada fucata[J].Zoolog Sci,2013,30(10):817-825.
[14] BUTLER T M,SIEGMAN M J.A force-activated kinase in a catch smooth muscle[J].J Muscle Res Cell Motil,2011,31(5/6):349-358.
[15] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259): 680-685.
[16] TOWBIN H,STAEHELIN T,GORDON J.Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications[J].Biotechnology,1992,24:145-149.
(責任編輯:方 林)
Purification of similar-connectin in scallop striated muscle
BAO Yu-long1,ZHANG San-run1,Sarina2,ZHENG Ming-xia1,XING Wan-jin3,ZHOU Hao-le1
(1.College of Basic Medical,Inner Mongolia Medical University, Hohhot 010059,China;2.Erdos Health School,Erdos 017000,China;3.College of Life Science,Inner Mongolia University,Hohhot 010022,China)
The similar-connectin was extracted with 0.15 mol/L buffer of potassium phosphate(pH=7.0),in which 1 mol/L urea was added,from the scallop striated myofibrils.Then the supernatant containing the similar-connectin was loaded onto DEAE-Toyopearl 650M column( anion exchange column chromatography),the protein was purified.Finally,tested the interaction of the similar-connectin on F-actin with co-sedimentation assay.The results showed that F-actin alone did not precipitate,but when similar-connectin was added in,F-actin co-precipitated with the similar-connectin,indicating that similar-connectin may be a new type of connectin-like protein in scallop striated muscle.
mollusks;scallop;connetin-like protein;protein extraction;protein purification;protein interaction
1000-1832(2016)04-0111-05
10.16163/j.cnki.22-1123/n.2016.04.024
2015-10-22
國家自然科學基金資助項目(31460600);內蒙古自然科學基金資助項目(2014MS08106).
包玉龍(1976—),男,博士研究生,講師,主要從事分子細胞生物學研究;通訊作者:周好樂(1962—),女,教授,主要從事動物遺傳學研究.
Q 952 [學科代碼] 180·5727
A

