不同生長調節物質對水稻生長及鎘積累的影響
何 冰,陳小勤,辛子兵,陸覃昱,石 橋,顧明華,王學禮
廣西大學農學院,南寧 530005
不同生長調節物質對水稻生長及鎘積累的影響
何 冰,陳小勤,辛子兵,陸覃昱,石 橋,顧明華*,王學禮
廣西大學農學院,南寧 530005
比較脫落酸(ABA)、乙烯利(ETH)、水楊酸(SA)和茉莉酸甲酯(MeJA)4種植物生長調節物質(PGR)對水稻生長及籽粒鎘(Cd)積累的影響差異。試驗采用重金屬污染土種植水稻,于分蘗期、灌漿期各進行1次PGR葉面噴施處理,分析灌漿期葉片光合指標,丙二醛(MDA)含量以及收獲期各部位生物量和Cd含量。結果表明:(1) 低濃度ABA(5mg/L)可維持水稻正常產量;高濃度ABA(15mg/L)則導致產量下降。ETH對水稻地上部生長和單株產量有顯著抑制作用,SA和MeJA(0.56mg/L)均可保證地上部正常生長,維持正常產量。(2) 外施4種PGR均抑制灌漿期葉片氣孔開放,降低蒸騰速率和光合速率,抑制效果最明顯的是高濃度MeJA(0.56mg/L)。(3) 在供試濃度范圍內SA、低濃度ABA(5mg/L)以及高濃度MeJA均可降低灌漿期葉片MDA含量,減少質膜過氧化水平。(4) 4種PGR均可降低水稻籽粒Cd含量,其中低濃度ABA(5mg/L)抑制籽粒Cd積累的效應最佳。相關性分析結果表明,PGR抑制籽粒積累Cd的效應與地上部向籽粒轉運Cd的調控機制有關,與蒸騰速率無顯著相關關系。(5) 綜上所述,低濃度ABA(5mg/L)處理對水稻產量無影響,且籽粒Cd含量降低程度最大。適當濃度的PGR可降低水稻籽粒Cd含量,在中低度重金屬污染農田生態修復實踐中具有一定的應用前景,但必須精確控制PGR的處理時間和處理濃度,避免出現抑制生長和降低產量的負效應。
水稻;鎘(Cd);生長調節物質(PGR)
鎘(Cd)是生物毒性最強的重金屬之一[1]。工業“三廢”大量排放,礦業的過度開采以及不合理的農業措施,導致土壤Cd污染日趨嚴重,大量農田存在Cd污染問題[2]。作為非必需元素,Cd在作物體內過量積累將導致作物產量和質量下降,更為嚴重的是Cd通過食物鏈進入人體,對身體健康造成嚴重的危害[1, 3]。因此,減少作物對Cd的吸收和積累,保障農產品的安全生產迫在眉睫。
植物生長調節物質(PGR)是一類對植物的生長發育有調節作用的化學物質,包括植物內源激素和人工合成的生長調節劑。其中脫落酸(ABA)、水楊酸類(SAs)、茉莉酸類(JAs)以及油菜素甾醇類(BRs)等被認為在植物抵御干旱、鹽堿、低溫、高溫、重金屬等逆境方面起重要作用[4- 10]。PGR參與植物對重金屬污染的反應[11-13]。有研究表明,PGR可能通過提高抗氧化劑的活性調節氧化還原水平,或者直接作為一種抗氧化劑淬滅活性氧,對研究植物的重金屬抗性有重要意義[14- 16]。Hsu[17]認為在Cd脅迫下水稻通過增加內源ABA,降低了蒸騰效率,使Cd由根系向地上部的轉運下降。
本文通過比較脫落酸(ABA)、乙烯利(ETH)、水楊酸(SA)以及茉莉酸甲酯(MeJA)處理后水稻生長及籽粒積累Cd的差異,初步分析不同PGR影響水稻籽粒Cd積累的效應機制。
1 材料與方法
1.1 試驗設計
試驗供試土壤采自廣西壯族自治區某重金屬污染地區農田。土壤基本理化性質和重金屬含量為:全氮,1.411 g/kg;全磷,0.3084 g/kg;全鉀,9.861 g/kg;有機質,23.30 g/kg;堿解氮,62.48 mg/kg;速效磷,33.50 mg/kg;速效鉀,88.00 mg/kg;土壤pH,6.16;總Cd含量,7.67 mg/kg;有效態Cd含量,4.00 mg/kg。
將采集的污染土自然風干,過篩(孔徑5 mm),裝入不透光塑料桶(高24 cm,直徑25.5 cm)中,每桶裝土7.5 kg,并施入0.675 g K2O和0.75 g P2O5做基肥,混勻,完全淹水平衡兩周。供試水稻品種為宜香9303。將培育好的水稻秧苗(4葉1心期)移入裝有污染土的塑料盆中,每盆5株。移苗時每盆追施0.45 g 氮,分蘗期追施0.3375 g 氮(均為尿素提供)。試驗共設9組處理(表1),每組4個重復。分別于分蘗期、灌漿期各進行1次PGR葉面噴施,平均用量為每盆30 mL,以葉面均勻覆有水珠、葉尖滴水為限。

表1 PGR處理濃度
ABA: 脫落酸; ETH: 乙烯利; SA: 水楊酸; MeJA: 茉莉酸甲酯. ABA, ETH, SA, MeJA means Abscisic acid, Ethylene, Salicylic acid and Methyl Jasmonate,respectively
1.2 測定項目及方法
1.2.1 植株株高和干重
植株收獲前,用卷尺測定株高,以莖基部到所有葉片向上伸展最高點的長度表示株高。植株收獲后分為根、地上部(莖和葉)和籽粒,分別用自來水沖洗干凈,然后用20 mmol/L EDTA-Na2浸泡20 min,最后用去離子水反復沖洗,吸水紙擦干表面水分。籽粒置于烘箱中35 ℃恒溫烘干,稱干重,脫殼,留糙米。根、地上部分別置于烘箱中105 ℃殺青30 min,65 ℃恒溫烘干至恒重,稱重。
1.2.2 葉片光合指標
試驗進行于水稻灌漿期噴施PGR處理后第2天,用光合作用測定儀(LI-6400xt,美國LI-COR公司)測定水稻完全展開葉的凈光合速率、蒸騰速率、胞間CO2濃度和氣孔導度。測定時間為9: 00—12: 00。
1.2.3 植物Cd含量
將根部、地上部(莖和葉)和籽粒樣品分別粉碎,過100目篩,稱取0.300g植物樣品裝入微波消解管中,加入8 mL優級純HNO3,于微波消解儀(MARS 6,美國CEM公司)中消解,采用石墨原子吸收法(PinAAcle 900T,美國鉑金公司)測定消解液中的Cd含量。
1.2.4 葉片MDA含量
在灌漿期PGR處理后第2天取水稻第一片完全展開葉,每盆的樣品分別剪碎混勻,各稱取0.5g新鮮葉片,液氮研磨,加入5 mL 0.05 mol/L磷酸緩沖液(pH 7.8),于10000r/min(0—4℃)離心10 min,取上清液按陳建勛等[17]方法測定MDA含量。
1.2.5 數據分析
文中所有數據均為4次重復的平均值,數據的處理采用Excel 2010進行統計,使用SPSS進行方差分析(ANVON)和多重比較(Duncan)。
2 結果分析
2.1 供試PGRs對Cd脅迫下水稻生物量、株高、根冠比的影響
土壤中過量的Cd抑制作物生長[21],降低作物產量[22]。不同PGR對Cd脅迫下水稻生長的影響并不相同(表2)。ABA與ETH均進一步降低了水稻株高和地上部干重,提高了根系干重和根冠比。說明在供試濃度范圍內,ABA和ETH均表現出促進根系生長,抑制地上部生長的效應。SA處理后水稻根系和地上部干重增加,根冠比略有提高,但株高隨著處理濃度增加呈下降趨勢。說明在供試濃度范圍內,SA可促進根系和地上部生長,促進水稻植株矮壯。MeJA處理后水稻根系和地上部干重變化不大,根冠比略有增加,但株高隨著處理濃度增加呈下降趨勢,說明在供試濃度范圍內,MeJA對根系生長無影響,但可促使水稻植株變矮。
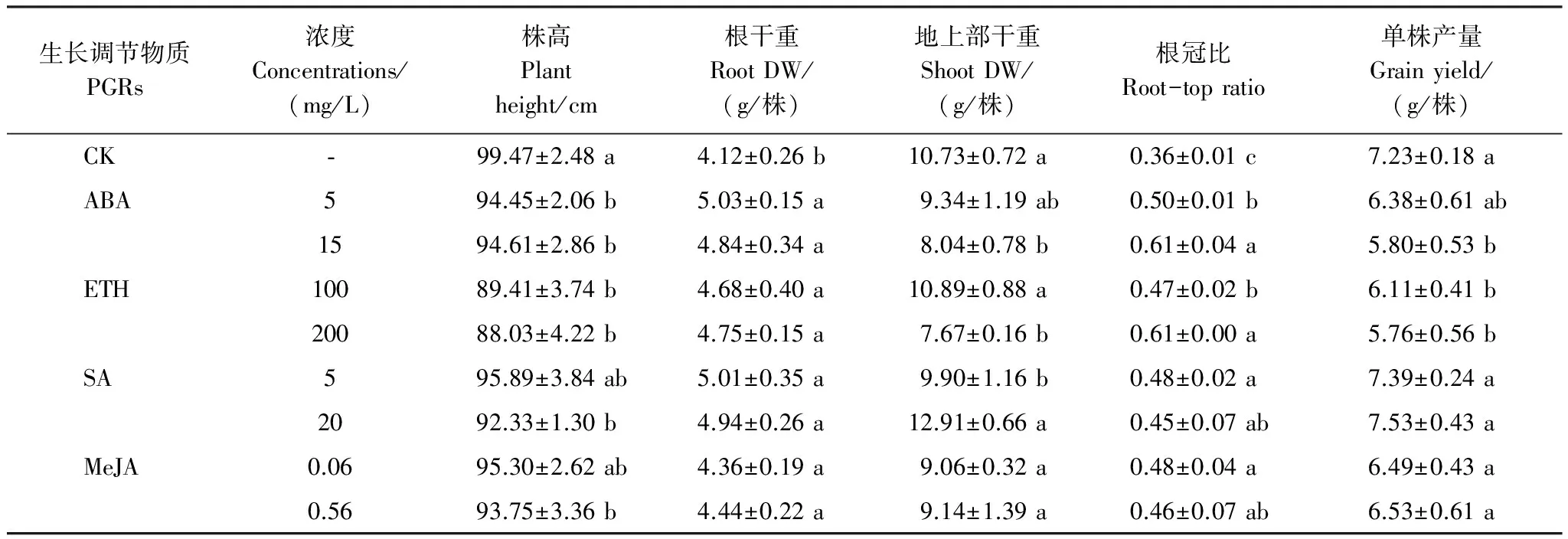
表 2 PGR對Cd脅迫下水稻生長的影響
不同字母表示同一激素不同濃度處理組與對照組相比差異顯著(P<0.05);DW: 干重dry weight
2.2 供試PGRs對Cd脅迫下水稻單株產量的影響
產量是評估水稻生長的重要指標。低濃度(5 mg/L)ABA對水稻單株產量無影響,而高濃度(15 mg/L)ABA處理的水稻單株產量比對照下降了19.78%;高濃度(200 mg/L)ETH和低濃度(100 mg/L)ETH均顯著抑制了水稻單株產量,分別比對照下降了15.49%和20.33%;供試濃度范圍內的SA和MeJA處理對水稻單株產量無影響(表2)。從相關性分析上看(表3),水稻產量與地上部干重呈顯著正相關,與根冠比呈顯著負相關,與根系干重和株高無顯著相關關系。由此推測,抑制地上部生長是ABA和ETH導致水稻產量降低的主要原因。而SA和MeJA對地上部生長無影響,在單株產量上也未表現出抑制效應。

表3 Cd脅迫下水稻生長及產量性狀相關性分析
*,**分別表示在0.05、0.01水平(雙側)上顯著相關
2.3 供試PGRs對Cd脅迫下葉片光合速率、蒸騰速率、氣孔導度和胞間CO2濃度的影響
4種PGR均有降低氣孔導度和蒸騰速率的作用(表4),其中MeJA降低氣孔導度和蒸騰速率的幅度最大。高濃度(0.56 mg/L)MeJA處理后水稻葉片氣孔導度和蒸騰速率分別下降了75.8%和66.9%;高濃度(15 mg/L)ABA處理后水稻葉片氣孔導度和蒸騰速率分別下降了44.8%和32.2%。從凈光合速率上看,MeJA處理后光合速率的下降幅度最大,其次為ETH,而ABA和SA對光合作用的影響最小。除MeJA處理后的胞間CO2濃度低于對照外,其它3種PGR處理并不影響胞間CO2濃度。MeJA處理組的葉片氣孔導度和蒸騰速率下降的同時伴隨著胞間CO2濃度的下降,暗示MeJA處理導致氣孔導度降低是引起凈光合速率下降的主要因素;ABA、SA和ETH處理后水稻氣孔導度和蒸騰速率下降的同時并未伴隨著胞間CO2濃度的下降,暗示3種PGR引起的凈光合速率下降并不僅僅是由于氣孔關閉,還可能存在對光合作用暗反應的抑制。
相關分析表明,水稻籽粒Cd含量與光合速率呈極顯著正相關(P<0.01),與蒸騰速率無顯著相關關系(表5)。

表4 PGR處理對水稻葉片光合作用的影響

表5 Cd脅迫下水稻籽粒Cd含量與葉片光合速率和蒸騰速率相關性分析
2.4 供試PGRs對Cd脅迫下葉片MDA含量的影響
MDA是植物體內膜脂過氧化產物,其含量反映植物遭受逆境傷害的程度[23-24]。從圖1可知,低濃度ABA(5 mg/L)處理后MDA含量低于對照,但高濃度ABA(15 mg/L)處理無此效應;高濃度和低濃度的ETH處理后水稻葉片MDA含量均與對照持平;SA和MeJA處理后MDA含量均低于對照。說明供試濃度范圍內的SA和MeJA以及低濃度ABA可一定程度地減緩植株受到的Cd傷害;而供試濃度范圍內的ETH以及高濃度ABA并未能減少Cd脅迫造成的膜質過氧化損傷。

圖1 不同PGR處理對Cd脅迫下葉片MDA含量的影響 Fig.1 The effect of different PGRs on MDA concentration in leaves of rice under Cd stress
2.5 供試PGRs對Cd脅迫下水稻籽粒Cd含量以及Cd轉運系數的影響
在4種PGR中,僅高濃度(15 mg/L)ABA和高濃度(200 mg/L)ETH處理降低水稻根部Cd含量。與對照相比,ABA對水稻地上部Cd含量無影響,高濃度ETH使水稻地上部Cd含量降低11%,而低濃度SA和MeJA則分別使水稻地上部Cd含量增加18%和23%。籽粒Cd含量是衡量稻米品質的重要指標。從表6可知,4種PGR處理均可降低水稻籽粒Cd含量,其中ABA的抑制效果最明顯,5 mg/L 和15 mg/L ABA處理條件下籽粒Cd含量分別比對照降低了37%和21%。100 mg/L ETH、20 mg/L SA和0.56 mg/L MeJA處理后籽粒Cd含量的下降幅度分別為13%、11%和15%。
從表6可知,高濃度ABA、低濃度的ETH、SA以及MeJA均提高了根部向地上部的Cd轉運系數,增加程度最大的是高濃度ABA,增加程度為對照的55%。除高濃度ETH外,其余各PGR處理的地上部向籽粒的Cd轉運系數均比對照有所降低,其中低濃度ABA下降程度最大,與對照相比下降33%;低濃度ETH下降程度最小,與對照相比下降19%。
相關分析表明,水稻籽粒Cd含量與根部Cd含量及地上部向籽粒轉運系數呈顯著正相關(P<0.01),水稻籽粒Cd含量與地上部Cd含量及根部向地上部轉運系數無顯著相關關系。

表6 PGR對水稻Cd含量及Cd轉運系數的影響

表7 水稻籽粒Cd含量與其他部位Cd含量及轉移系數相關性分析
3 討論
植物體內存在5大類激素:生長素、赤霉素、細胞分裂素、脫落酸和乙烯。此外,還有一些“新發現的植物激素類物質”,如水楊酸(SA)、茉莉酸(MJ)、油菜素內酯(BL)、獨角金內酯(SLs)等[25]。脫落酸、水楊酸、茉莉酸和乙烯被認為是植物的主要“脅迫激素”,在植物處于低溫脅迫、鹽脅迫、滲透脅迫、干旱脅迫、重金屬脅迫、病害等逆境時,這些物質在植物體內迅速積累,提高細胞抗氧化水平,保護生物膜和蛋白質,維持一定的光合作用,減少逆境對植物生長的影響[26]。近年來,研究發現外施生長調節物質可促進植物的生長,增強抗氧化能力,提高生物量或作物產量,減少重金屬積累[27-29]。這些結果促進了生長調節劑在重金屬污染土壤修復實踐中的應用。
3.1 供試PGRs對增強水稻抗性,維持正常生長的影響
植物激素在植物應答逆境脅迫中有至關重要的作用,非生物脅迫導致內源激素增加,誘導植物產生抗性,維持正常生長。本試驗結果表明,高濃度ABA和ETH導致水稻地上部生長受抑和單株產量降低;而SA和MeJA未表現出抑制效應。研究表明,Cd,Zn 和Al等重金屬或有毒元素脅迫可誘導植物體內的ABA水平增加[30-31]。Stroiński[32]推測ABA 參與根細胞中Cd 脅迫信號的轉導。乙烯通過調節小麥葉片脯氨酸、谷胱甘肽代謝,從而緩解Cd脅迫引起的脂質過氧化反應[33]。Monteiro[34]認為乙烯信號傳導通路的改變可能與細胞內氧化應激的代謝途徑有關。Chen[35]等發現外源MeJA通過增加秋茄葉片抗壞血酸含量、過氧化氫酶活性、抗壞血酸過氧化物酶活性從而降低Cd脅迫造成的脂質過氧化損傷。研究表明,外源SA可通過增加細胞膜中的不飽合脂防酸比例[36]、抑制大麥幼苗根系中活性氧的產生[37]或作為抗氧化劑直接參與活性氧的淬滅過程[38],減少Cd脅迫對植物的損傷。本試驗結果表明,高濃度ABA(15mg/L)處理的水稻葉片MDA含量高于低濃度ABA(5mg/L)處理,而水稻單株產量低于低濃度ABA處理,說明低ABA處理水平有利于水稻抵御Cd的傷害,而高ABA處理水平則不利于增強水稻抗性。100—200 mg/L乙烯處理并不能緩解Cd脅迫引起的葉片膜質過氧化,最終表現為地上部生物量和產量下降。SA和高濃度MeJA處理均表現為葉片MDA含量比對照降低,說明SA和MeJA處理具有減緩質膜過氧化的作用,在Cd脅迫下維持地上部正常生長,最終表現為產量與對照持平。總之,在Cd脅迫下,15mg/L ABA和100—200 mg/L ETH未能表現出減緩質膜過氧化和維持生長的效應;而5—20 mg/L SA和0.56 mg/L MeJA處理對減少膜質過氧化,維持正常產量有積極的作用,說明4種PGR在誘導水稻對Cd的抗性方面具有不同的調控機制。必須注意的是,合適的施用濃度是PGR能否發揮調節作用、誘導植物抗性增強的重要影響因素。
3.2 供試PGRs對水稻籽粒積累Cd的影響
本試驗結果表明, 4種PGR均可在一定程度上減少水稻籽粒對Cd的積累。低濃度ABA對水稻籽粒積累Cd的抑制效應最強。土壤中的Cd需要經過根系吸收、根系向莖部轉運、莖部向上運輸及莖部木質部向韌皮部的橫向轉運等過程才能進入籽粒[39]。光合作用為植物生理活動包括Cd的運輸和積累直接或間接地提供能量,蒸騰作用被認為是Cd吸收和向上遷移的動力來源[40]。Salt[41]等認為ABA引起的氣孔關閉和蒸騰作用下降是抑制Brassicajuncea從根向地上部轉運Cd的可能機制。Hsu[17]等認為Cd 脅迫導致水稻內源ABA 增加,而增加的ABA 降低了蒸騰效率使Cd 由根系向地上部的轉運下降,最終表現為ABA 降低了水稻地上部對Cd 的積累。錢海勝[42]等發現外源ABA處理降低不結球白菜地上部分Cd含量主要是通過抑制Cd向地上部的運輸,這與ABA降低氣孔導度、抑制蒸騰速率有著密切的關系。在本試驗中,低濃度ABA處理后葉片蒸騰速率與對照持平,但籽粒Cd含量與對照相比明顯下降;高濃度ABA處理后葉片蒸騰速率高于低濃度ABA處理組,但籽粒Cd含量低于低濃度ABA處理。Hossain[43]等認為MeJA與ABA均可誘導擬南芥氣孔關閉,而且ABA在MeJA的信號轉導過程中起重要作用。在本試驗中,MeJA處理后葉片蒸騰速率下降程度比ABA處理更大,但其籽粒Cd含量高于ABA處理。相關性分析(表5)結果表明,籽粒Cd含量與葉片光合速率呈極顯著正相關關系,與蒸騰作用無顯著相關關系,暗示水稻葉片維持一定的光合作用有利于籽粒對Cd的積累,而蒸騰速率并不是PGR調控水稻向上運輸Cd的主要影響因素。雖然試驗結果無法排除蒸騰速率在ABA或MeJA抑制籽粒積累Cd等方面的積極作用,但暗示該影響效應比較小。
試驗結果表明,水稻籽粒Cd含量與根系Cd含量、地上部向籽粒的Cd轉運系數均表現為極顯著正相關(P<0.01)(表7)。高濃度ABA與ETH處理降低水稻根部Cd含量,而SA與MeJA無此效應(表6)。從地上部向籽粒的Cd轉運系數分析,ABA、SA和MeJA在供試濃度范圍內均抑制Cd從地上部向籽粒的轉運,而ETH僅在低濃度(100 mg/L)條件下表現出相似效應(表6)。因此,ABA處理使籽粒Cd含量下降可能是由于ABA抑制根系吸收和Cd從莖部向籽粒轉運的雙重影響的結果;100 mg/L ETH,20 mg/L SA和0.56 mg/L MeJA處理使籽粒Cd含量降低可能是由于Cd從地上部向籽粒轉運受到抑制的結果。水稻莖節是地上部Cd積累的主要部位,控制水稻體內Cd從本質部向韌皮部轉運,以及灌漿期Cd向籽粒的轉運[44]。由于在水稻莖節中網絡狀分布的維管束并不直接相通,因此木質部導管的元素向周圍韌皮部的運輸不是一個連續的過程,阻礙了元素向葉片和籽粒的遷移。Yu[45]觀察到水稻第一莖節中金屬硫蛋白基因的轉錄水平比劍葉高150倍,受Cd、Pb、Al、Cu等金屬離子誘導表達,這一結果暗示莖節是水稻莖部向籽粒轉運重金屬的主要關隘。在本試驗中,水稻籽粒Cd含量與地上部向籽粒的Cd轉運系數的相關系數達0.690(P<0.01)。與其他3種PGR相比,低濃度ABA處理后地上部向籽粒的Cd轉運系數最低,這與“低濃度ABA處理后籽粒Cd含量最低”的結果相一致。由此推測,PGR抑制籽粒對Cd的積累主要與Cd在莖節部位從木質部向韌皮部轉運的過程有關,但目前相關的報道較少。PGR如何直接或間接地調控水稻地上部向籽粒運輸Cd的過程,需要進一步的研究。
綜上所述,供試4種PGR均可在一定程度上減少水稻籽粒對Cd的積累。低濃度ABA對水稻籽粒積累Cd的抑制效應最強,推測其中機制與ABA減緩地上部向籽粒運輸Cd有關;低濃度ABA并不降低產量,但高濃度ABA導致水稻減產。供試濃度范圍內的ETH處理既減少水稻籽粒中的重金屬含量同時也明顯降低產量。SA和MeJA雖不影響產量但水稻籽粒中的重金屬含量降低程度低于ABA。由于具有施用簡單、成本低、環境友好等特點,PGR在中低度重金屬污染農田的生態治理實踐中應具有一席之地。PGR對時間和劑量的準確性要求較高,不同時間處理、不同劑量水平可能會導致不同的生理效應,這是PGR在實際應用中必須注意的問題。
[1] 崔玉靜, 趙中秋, 劉文菊, 陳世寶, 朱永官. 鎘在土壤-植物-人體系統中遷移積累及其影響因子. 生態學報, 2003, 23(10): 2133- 2143.
[2] 國家環境保護總局. 中東部地區生態環境現狀調查報告. 環境保護, 2003, (8): 3- 8.
[3] He J Y, Zhu C, Ren Y F, Yan Y P, Jiang D A. Genotypic variation in grain cadmium concentration of lowland rice. Journal of Plant Nutrition and Soil Science, 2006, 169(5): 711- 716.
[4] 劉林德, 姚敦義. 植物激素的概念及其新成員. 生物學通報, 2002, 37(8): 18- 20.
[5] 吳耀榮, 謝旗. ABA與植物脅迫抗性. 植物學通報, 2006, 23(5): 511- 518.
[6] 劉紅娟, 劉洋, 劉琳. 脫落酸對植物抗逆性影響的研究進展. 生物技術通報, 2008, (6): 7- 9.
[7] 丁義峰, 劉萍. 水楊酸誘導植物抗逆性研究進展. 生物學教學, 2011, 36(11): 2- 4.
[8] 陳珍, 朱誠. 水楊酸在植物抗重金屬元素脅迫中的作用. 植物生理學通訊, 2009, 45(5): 497- 502.
[9] 康云艷, 郭世榮, 段九菊. 新型植物激素與蔬菜作物抗逆性關系研究進展. 中國蔬菜, 2007, (5): 39- 42.
[10] 蔡昆爭, 董桃杏, 徐濤. 茉莉酸類物質(JAs)的生理特性及其在逆境脅迫中的抗性作用. 生態環境, 2006, 15(2): 397- 404.
[11] Fuhrer J. Ethylene biosynthesis and cadmium toxicity in leaf tissue of beans (PhaseolusvulgarisL.). Plant Physiology, 1982, 70(1): 162- 167.
[12] Zawoznik M S, Groppa M D, Tomaro M L, Benavides M P. Endogenous salicylic acid potentiates cadmium-induced oxidative stress inArabidopsisthaliana. Plant Science, 2007, 173(2): 190- 197.
[13] Jin X, Heng X Y, Xia L. Protective effects of proline against cadmium toxicity in micropropagated hyperaccumulator,SolanumnigrumL.. Plant Cell Reports, 2009, 28(2): 325- 333.
[14] 何俊瑜, 任艷芳, 王陽陽, 李兆君. 不同耐性水稻幼苗根系對鎘脅迫的形態及生理響應. 生態學報, 2011, 31(2): 522- 528.
[15] 丁佳紅, 薛正蓮, 楊超英. 水楊酸對銅脅迫下水稻幼苗膜脂過氧化作用的影響. 黑龍江農業科學, 2013, (1): 14- 18.
[16] Ahmad P, Nabi G, Ashraf M. Cadmium-induced oxidative damage in mustard [Brassicajuncea(L.) Czern. & Coss. ] plants can be alleviated by salicylic acid. South African Journal of Botany, 2011, 77(1): 36- 44.
[17] Hsu Y T, Kao C H. Role of abscisic acid in cadmium tolerance of rice (OryzasativaL.) seedlings. Plant, Cell and Environment, 2003, 26(6): 867- 874.
[18] 文廷剛, 陳昱利, 杜小鳳, 吳傳萬, 錢新民, 吳雪芬, 王偉中. 不同植物生長調節劑對小麥籽粒灌漿特性及粒重的影響. 麥類作物學報, 2014, 34(1): 84- 90.
[19] Mishra A, Choudhuri M A. Effects of salicylic acid on heavy metal-induced membrane deterioration mediated by lipoxygenase in rice. Biologia Plantarum, 1999, 42(3): 409- 415.
[20] Beltrano J, Ronco M G, Montaldi E R, Carbone A. Senescence of flag leaves and ears of wheat hastened by methyl jasmonate. Journal of Plant Growth Regulation, 1998, 17(1): 53- 57.
[21] Ci D W, Jiang D, Dai T B, Jing Q, Cao W X. Effects of cadmium on plant growth and physiological traits in contrast wheat recombinant inbred lines differing in cadmium tolerance. Chemosphere, 2009, 77(11): 1620- 1625.
[22] Wu F D, Zhang G P, Dominy P, Wu H X, Bachir D M L. Differences in yield components and kernel Cd accumulation in response to Cd toxicity in four barley genotypes. Chemosphere, 2007, 70(1): 83- 92.
[23] 吳靈瓊, 成水平, 楊立華, 吳振斌. Cd2+和Cu2+對美人蕉的氧化脅迫及抗性機理研究. 農業環境科學學報, 2007, 26(4): 1365- 1369.
[24] 彭艷, 李洋, 楊廣笑, 何光源. 鋁脅迫對不同小麥SOD、CAT、POD活性和MDA含量的影響. 生物技術, 2006, 16(3): 38- 42.
[25] Bulak P, Walkiewicz A, Brzezińska M. Plant growth regulators-assisted phytoextraction. Biologia Plantarum, 2014, 58(1): 1- 8.
[26] de Vleesschauwer D, Gheysen G, H?fte M. Hormone defense networking in rice: tales from a different world. Trends in Plant Science, 2013, 18(10): 555- 565.
[28] Hadi F, Bano A, Fuller M P. The improved phytoextraction of lead (Pb) and the growth of maize (ZeamaysL.): the role of plant growth regulators (GA3and IAA) and EDTA alone and in combinations. Chemosphere, 2010, 80(4): 457- 462.
[29] Agami R A, Mohamed G F. Exogenous treatment with indole- 3-acetic acid and salicylic acid alleviates cadmium toxicity in wheat seedlings. Ecotoxicology and Environmental Safety, 2013, 94: 164- 171.
[30] Hollenbach B, Schreiber L, Hartung W, Dietz K J. Cadmium leads to stimulated expression of the lipid transfer protein genes in barley: implications for the involvement of lipid transfer proteins in wax assembly. Planta, 1997, 203(1): 9- 19.
[31] Fediuc E, Herman Lips S, Erdei L. O-acetylserine (thiol) lyase activity inPhragmitesandTyphaplants under cadmium and NaCl stress conditions and the involvement of ABA in the stress response. Journal of Plant Physiology, 2005, 162(8): 865- 872.
[33] Khan M I R, Nazir F, Asgher M, Per T S, Khan N A. Selenium and sulfur influence ethylene formation and alleviate cadmium-induced oxidative stress by improving proline and glutathione production in wheat. Journal of Plant Physiology, 2015, 173: 9- 18.
[34] Monteiro C C, Carvalho R F, Grat?o P L, Carvalho G, Tiago T, Medici L O, Peres L E P, Azevedo R A. Biochemical responses of the ethylene-insensitive Never ripe tomato mutant subjected to cadmium and sodium stresses. Environmental and Experimental Botany, 2011, 71(2): 306- 320.
[35] Chen J, Yan Z Z, Li X Z. Effect of methyl jasmonate on cadmium uptake and antioxidative capacity inKandeliaobovataseedling under cadmium stress. Ecotoxicology and Environmental Safety, 2014, 104: 349- 356.
[36] Belkadhi A, de Haro A, Obregon S, Cha?bi W, Djebali W. Exogenous salicylic acid protects phospholipids against cadmium stress in flax (LinumusitatissimumL.). Ecotoxicology and Environmental Safety, 2015, 120: 102- 109.
[37] Tamás L, Mistrík I, Alemayehu A, Zelinová V, Bocová B, Huttová J. Salicylic acid alleviates cadmium-induced stress responses through the inhibition of Cd-induced auxin-mediated reactive oxygen species production in barley root tips. Journal of Plant Physiology, 2015, 173: 1- 8.
[38] Popova L P, Maslenkova L T, Yordanova R Y, Ivanova A P, Krantev A P, Szalai G, Janda T. Exogenous treatment with salicylic acid attenuates cadmium toxicity in pea seedlings. Plant Physiology and Biochemistry, 2009, 47(3): 224- 231.
[39] Hart J J, Welch R M, Norvell W A, Sullivan L A, Kochian L V. Characterization of cadmium binding, uptake, and translocation in intact seedlings of bread and durum wheat cultivars. Plant Physiology, 1998, 116(4): 1413- 1420.
[40] Marschner H. Marschner′s Mineral Nutrition of Higher Plants. London: Academic Press, 1986: 674- 674.
[41] Salt D E, Prince R C, Pickering J I, Raskin I. Mechanisms of cadmium mobility and accumulation in Indian mustard. Plant Physiology, 1995, 109(4): 1427- 1433.
[42] 錢海勝, 陳亞華, 王桂萍, 沈振國. 鎘在不結球白菜中的積累及外源脫落酸對鎘積累的影響. 南京農業大學學報, 2008, 31(4): 61- 65.
[43] Hossain M A, Munemasa S, Uraji M, Nakamura Y, Mori I C, Murata Y. Involvement of endogenous abscisic Acid in methyl jasmonate-induced stomatal closure in Arabidopsis. Plant Physiology, 2011, 156(1): 430- 438.
[44] Fujimaki S, Suzui N, Ishioka N S, Kawachi N, Ito S, Chino M, Nakamura S. Tracing cadmium from culture to spikelet: noninvasive imaging and quantitative characterization of absorption, transport, and accumulation of cadmium in an intact rice plant. Plant Physiology, 2010, 152(4): 1796- 1806.
[45] Yu L H, Umeda M, Liu J Y, Zhao N M, Uchimiya H. A novel MT gene of rice plants is strongly expressed in the node portion of the stem. Gene, 1998, 206(1): 29- 35.
Effects of four plant growth regulators on growth and cadmium accumulation in rice
HE Bing, CHEN Xiaoqin, XIN Zibing, LU Qinyu, SHI Qiao, GU Minghua*, WANG Xueli
CollegeofAgriculture,GuangxiUniversity,Nanning530005,China
Cadmium (Cd) pollution has become a serious problem following rapid industrial development. The increasing amounts of Cd in farmlands are the result of increased discharge of industrial waste, abuse of chemical fertilizers, and other man-made sources. Cd likely causes damage to crop physiology when its concentration in soil exceeds the maximum tolerable limit, resulting in growth inhibition and grain yield reduction. Continuous intake of Cd causes human health problems. Therefore, reducing Cd concentration in rice grain, a staple food for half of the world′s population, is extremely important and urgent. Plant growth regulators (PGRs) are chemicals—plant endogenous hormones and artificially synthetic growth regulators—that affect and regulate plant growth and/or development at trace levels. Some PGRs play important roles in inducing plant tolerance to drought, salt, low temperature, high temperature, and heavy metals. In this study, the roles of four PGRs, abscisic acid (ABA), ethylene (ETH), salicylic acid (SA), and methyl jasmonate (MeJA), were investigated during stress responses to Cd treatments in rice. Rice seedlings, grown in heavy metal-contaminated soil, were sprayed with the four PGRs on leaves twice, one time each during tillering and filling stages. On the second day after the PGR treatments during the filling stage, the photosynthesis indices and malondialdehyde (MDA) contents of the upper leaves were analyzed. After harvesting, the roots, shoots, and grains were collected to investigate Cd content, biomass, and yield. The results were as follows: (1) The ABA treatment at 5 mg/L maintained normal rice growth and yield, while the ABA treatment at 15 mg/L showed the opposite effects. Treatment with two different levels of ETH significantly decreased the grain yield compared to that of the control. However, SA and MeJA high-level treatments maintained normal yields. (2) The exogenous application of the four PGRs inhibited stomatal opening and reduced the transpiration and photosynthetic rates. Interestingly, the most obvious inhibitory action was observed following the treatment with 0.56 mg/L MeJA. (3) Both the SA treatments, 5 mg/L ABA and 0.56 mg/L MeJA treatments, reduced MDA production and prevented plasma membrane peroxidation of leaves at the tillering stage. (4) Decreases in the Cd concentrations were observed in rice grain treated with the four PGRs at their appropriate levels, and the ABA treatment at 5 mg/L showed the strongest inhibitory effect. The grain Cd content showed positive and highly significant (P<0.01) correlation with the Cd translocation factor from shoot to grain, but it did not show a significant correlation with the transpiration rate. PGRs may inhibit the accumulation of Cd in the grain by regulating Cd transport from shoots to grain. (5) In summary, ABA treatment at 5 mg/L had no effect on grain yield but induced the maximum decline in grain Cd content compared to the treatments with other PGRs. Proper application of PGRs can reduce the Cd content in rice grain and can be used in bioremediation of heavy metal polluted farmland. For a practical application of PGRs, appropriate timing, and accurate concentrations are the critical factors to avoid negative effects of inhibited growth and reduced rice yields.
rice; Cd; plant growth regulator
農業部專項資助項目(2014- 2016);廣西土壤污染與生態修復人才小高地項目;國家自然科學基金金資助項目(31560122)
2015- 04- 27;
日期:2016- 03- 03
10.5846/stxb201504270861
*通訊作者Corresponding author.E-mail: gumh@gxu.edu.cn
何冰,陳小勤,辛子兵,陸覃昱,石橋,顧明華,王學禮.不同生長調節物質對水稻生長及鎘積累的影響.生態學報,2016,36(21):6863- 6871.
He B, Chen X Q, Xin Z B, Lu Q Y, Shi Q, Gu M H, Wang X L.Effects of four plant growth regulators on growth and cadmium accumulation in rice.Acta Ecologica Sinica,2016,36(21):6863- 6871.

