鹿茸多肽誘導心肌干細胞向心肌細胞分化的機制研究Δ
王艷玲,黃曉巍,李 哲,何 璐,徐 巖,曲曉波(.吉林大學基礎醫學院,長春 300;.長春中醫藥大學藥學院,長春 307)
鹿茸多肽誘導心肌干細胞向心肌細胞分化的機制研究Δ
王艷玲1*,黃曉巍2,李 哲1,何 璐1,徐 巖2,曲曉波2(#1.吉林大學基礎醫學院,長春 130021;2.長春中醫藥大學藥學院,長春 130117)
目的:探討鹿茸多肽誘導心肌干細胞(CSCs)向心肌細胞分化的機制。方法:從SD大鼠體內分離CSCs,鑒定后培養傳代至P3代后,分為空白對照組、5-氮胞苷誘導組(3 μmol/L)、鹿茸多肽誘導組(800 μg/ml)及其聯合誘導組,除空白對照組細胞只加含3%胎牛血清的培養液外,其余各組細胞加入含相應誘導劑的培養液,培養14 d。采用免疫組化法檢測細胞表面心肌肌鈣蛋白T(cTnT)表達,免疫印跡技術檢測細胞cTnT、活化復制因子2(ATF-2)和肌細胞增強因子2C(MEF-2C)表達,實時定量聚合酶鏈式反應技術檢測細胞cTnT和轉錄因子Nkx2.5、GATA4 mRNA表達。結果:成功制得CSCs,純度>97%。與空白對照組(cTnT呈陰性)比較,各誘導組細胞cTnT呈陽性,cTnT、ATF-2、MEF-2C蛋白表達和cTnT、Nkx2.5、GATA4 mRNA表達均增強(P<0.05)。與5-氮胞苷誘導組比較,鹿茸多肽誘導組細胞cTnT、MEF-2C蛋白表達和cTnT、GATA4 mRNA表達均增強(P<0.05),聯合誘導組細胞cTnT、ATF-2、MEF-2C蛋白表達和cTnT、GATA4 mRNA表達均增強(P<0.05)。結論:鹿茸多肽可能通過增強Nkx2.5、GATA4、ATF-2、MEF-2C等轉錄因子的表達來誘導CSCs向心肌細胞分化。
鹿茸多肽;心肌干細胞;心肌細胞;分化
心肌細胞死亡多發于缺血性心臟病和心力衰竭患者,最終導致功能性心肌細胞受損[1-2]。因此,如何通過增加心肌細胞數量來促進心肌細胞再生,恢復心臟功能的研究具有重要的現實意義。隨著細胞移植療法研究的不斷深入,心臟損傷疾病的治療有了希望。心肌干細胞(CSCs)由于具有向心肌細胞分化的潛能和生理學特性,被認為是一個理想的種子細胞[3]。CSCs在移植后可以分化成為心肌細胞修復心肌組織損傷,因此其在心肌細胞替代治療方面受到了廣泛關注。但如何通過小分子藥物激活患者的CSCs,讓其充分增殖和分化,是CSCs研究的重點之一[4]。多種物質可誘導CSCs分化為心肌細胞[5],但均存在不足。因此,發現新的誘導劑,建立穩定、安全、有效、定向誘導CSCs分化為心肌細胞的方法成為研究的重點。
本研究組多年來一直從事鹿茸多肽的開發利用研究,已經證明從新鮮鹿茸中分離提取的鹿茸多肽是具有較強生物活性的多肽混合物,對神經纖維、骨組織損傷的修復有明顯的促進作用[6]。本文研究的核心思路是使用體外培養技術制備大鼠CSCs,以鹿茸多肽作為誘導劑進一步研究其對心肌細胞定向分化的作用及可能機制。
1 材料
1.1 儀器
倒置顯微鏡(日本Olympus公司);Biofuge Primp R低溫離心機(德國Heraeus公司);VDS凝膠成像系統(瑞典Pharmacia公司);DT5-3低速自動平衡離心機(北京醫用離心機廠);聚合酶鏈式反應(PCR)擴增儀(美國Bio-Rad公司);Syngene Bio Imaging System、BD FACSCantoⅡ流式細胞儀(美國BD Biosciences公司)。
1.2 藥品與試劑
鹿茸多肽(長春中醫藥大學藥學院自制,批號:20150417,純度:>97%);5-氮胞苷(中國上海阿拉丁試劑有限公司,批號:B1412007,純度:>98%);胎牛血清(FBS)、RPMI-1640(美國Gibco公司,批號:10099-141、31800-022);胰蛋白酶(美國Sigma公司,批號:T0303);抗大鼠CD45抗體、干細胞生長因子c-kit抗體、活化復制因子2(ATF-2)抗體、肌細胞增強因子2C(MEF-2C)抗體(美國Biosynthesis Biotechnology公司,批號:bs-0522r、bs-04130r、bs-0518r、bs-0672r);抗大鼠心肌肌鈣蛋白T(cTnT)抗體、β-肌動蛋白(β-actin)抗體(碧云天生物技術有限公司,批號:F19064、A0208);Trizol試劑(美國Life Technologies公司,批號:15596-026);逆轉錄試劑盒(日本Takara公司,批號:RR037A);cTnT、Nkx2.5、GATA4 mRNA PCR引物(中國上海生物工程有限公司);二喹啉甲酸(BCA)蛋白定量試劑盒(北京百泰克生物技術有限公司,批號:0020160129);辣根過氧化物酶(HRP)標記的羊抗鼠免疫球蛋白G(IgG)(H+L)(北京鼎國生物技術公司,批號:IH-0031);PVDF膜(美國Millipore公司,批號:IPVH00010);增強化學發光(ECL)試劑(美國Biosharp公司,批號:BL520A)。
1.3 動物
清潔級新生Wister大鼠10只,♂,體質量6~8 g,由吉林大學實驗動物中心提供,生產許可證號:SCXK(吉)2013-0001。
2 方法
2.1 CSCs的制備
CSCs的分離、培養參考王彤等[7]報道的分離方法。將大鼠乙醇浸泡消毒后,無菌取心臟。采用0.25%胰酶和0.1%的Ⅱ型膠原酶交替消化法制成心肌組織碎塊懸液,接種到50 ml培養瓶內,于37℃、5%CO2下培養過夜后,每瓶補加CEM培養液(含FBS、L-谷氨酰胺、β-巰基乙醇的DMEM培養液)3 ml后,繼續培養。每隔2~3 d更換一次培養液,同時觀察記錄細胞的形態、生長變化情況。采用流式細胞術對CSCs特異性表面標志物c-kit和CD45進行檢測分析,以鑒定CSCs純度。
2.2 CSCs的傳代培養
待心臟細胞長滿培養瓶底,棄培養液,用0.05%胰酶消化細胞,用CEM培養液終止胰酶消化反應。將消化細胞液離心后用CEM培養液制成細胞懸液,接種到兩個培養瓶內,置于37℃、5%CO2下繼續培養,每2~3 d換一次培養液,觀察細胞的生長情況和形態變化。細胞傳代到P3代即可用于試驗。
2.3 流式細胞儀檢測c-kit和CD45陽性細胞占比
按流式細胞儀分析操作規程,將培養的原代細胞與抗c-kit和CD45抗體進行結合反應過夜;用磷酸鹽緩沖液(PBS)洗3次后,分別加異硫氰酸熒光素(FITC)和藻紅蛋白(PE)標記的熒光抗體,室溫孵育60 min;經PBS/Azide液洗滌、1 000 r/min(離心半徑15.6 cm,下同)離心6 min后,棄上清,用2%多聚甲醛固定后,用流式細胞儀檢測c-kit和CD45陽性細胞數,計算其占比。
2.4 分組與給藥
P3代CSCs經胰酶消化后,制成濃度為105ml-1的細胞懸液,分別接種到孔內放有載玻片的12孔細胞培養板的孔內和50 ml塑料培養瓶中。待細胞貼壁后分為4組,分別為空白對照組、5-氮胞苷誘導組(3 μmol/L)、鹿茸多肽誘導組(800 μg/ml)及其聯合誘導組。除空白對照組細胞只加含3%FBS的培養液外,其余各組細胞加含相應藥物和3%FBS的培養液,每組3個復孔,于37℃、5%CO2下繼續培養,每隔2~3 d換一次培養液。在倒置顯微鏡下觀察細胞形態學變化。12孔細胞培養板接種的細胞培養3 d后,免疫組化染色,其余8瓶連續誘導培養14 d后收集細胞。
2.5 免疫組化染色檢測c-kit、cTnT表達
取“2.4”項下培養14 d后的細胞,PBS沖洗后,滴加4%多聚甲醛,室溫固定30 min;PBS清洗后,再用冰丙酮固定15 min,完成細胞膜打孔;之后依次加0.5%聚乙二醇辛基苯基醚(Triton X-100),室溫孵育20 min,使細胞脫脂;加0.3%H2O2室溫避光孵育20 min,阻斷內源性過氧化物酶的活性;加FBS孵育20 min,封閉非特異性抗體結合位點;加cTnT抗體孵育60 min,完成抗原抗體的特異性結合;加二抗孵育60 min,完成酶標抗體的特異性結合反應,PBS洗3次,再加4′,6-二脒基-2-苯基吲哚(DAPI)溶液浸染3 min,對細胞核進行染色,封片。熒光顯微鏡下觀察拍照、記錄c-kit或cTnT表達情況。c-kit或cTnT表達陽性的細胞免疫熒光呈綠色熒光,采用顯微成像系統對陽性細胞進行定量分析。
2.6 免疫印跡技術檢測cTnT、ATF-2和MEF-2C蛋白表達
取“2.4”項下培養14 d后的細胞,加適量緩沖液,用超聲破碎法制備細胞勻漿,4℃下5 000 r/min離心30 min,上清用BCA蛋白定量試劑盒測定蛋白濃度后,將樣品稀釋為1 mg/ml用于免疫印跡分析。分別吸取制得的待測蛋白樣品50 μl于1.5 ml EP管中,加等體積的上樣緩沖液,沸水中煮沸5 min,3 000 r/min離心10 min后,取上清液中的蛋白用十二烷基磺酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳分離(分離膠濃度為10%,濃縮膠濃度為4%,在100 V的恒壓下電泳100 min)。電泳結束后,將SDS-PAGE膠內蛋白轉到硝酸纖維素膜上,加入10 ml封閉液,封閉過夜;加入一抗特異性反應2 h;用洗滌液搖洗5次,洗去殘留的未結合的一抗后,再加入二抗應用液10 ml,結合反應1 h;用洗滌液搖洗5次后,將ECL試劑A和B按1∶1比例混合后加入到雜交袋中反應2 min,去掉膜表面液體,放于兩層塑料薄膜中間,用免疫印跡儀觀察、記錄結果。用凝膠成像系統掃描結果,以β-actin為內參,以cTnT、ATF-2和MEF-2C的目的條帶的吸光度值與相應的內參條帶的吸光度值的比值作為衡量指標進行結果分析。
2.7 RT-PCR分析cTnT、Nkx2.5、GATA4 mRNA表達
首先按照Trizol試劑使用操作程序提取細胞內總RNA;然后通過逆轉錄將mRNA轉錄為cDNA(反應條件為37℃孵育60 min,90℃孵育5 min后,冰浴上迅速冷卻);再通過PCR反應,擴增得到目的基因。實驗中所用引物的核苷酸序列為:cTnT基因的上游引物為5′-ACCGGGCGTTGGAAATAG-3′,下游引物為5′-CATAGTGCGGGCATAGGG-3′,產物大小為180 bp;轉錄因子Nkx2.5基因的上游引物為5′-GCTACAAGTGCAAGCGACAG-3′下游引物為5′-GGGTAGGCGTTGTAGCCATA-3′,產物大小為184 bp;GATA4基因的上游引物為5′-CGAGGGTGAGCCTGTATGT-3′,下游引物為5′-TGCTGTGCCCATAGTGAGAT-3′,產物大小為281 bp;甘油醛-3-磷酸脫氫酶(GAPDH)為內參,上游引物為5′-TGGTGAAGGTCGGTGTGAAC-3′,下游引物為5′-GCTCCTGGAAGATGGTGATGG-3′,產物大小為231 bp。PCR反應過程簡述如下:首先將各引物用無DEPC水稀釋為10 pmol/L,以10×Taq酶buffer 5 μl、dNTPs(10 mmol/L)溶液2 μl、目的基因上下游引物各10 μl、內參上下游引物各5 μl、cDNA溶液5 μl、Taq酶3 μl的順序,依次加入到0.2 ml PCR反應管中,加入DEPC水到50 μl,點動離心后,94℃預變性5 min,再擴增30個循環(循環條件:94℃變性1 min,56℃退火1 min,72℃延伸2 min,最后72℃延長10 min)。含有EB的2.5%瓊脂糖膠凝電泳對PCR產物分析,通過凝膠成像系統進行拍照、掃描分析。以目的基因與內參的灰度值之比表示目的基因在條件培養細胞中的mRNA表達量。
2.8 統計學方法
應用SPSS 17.0軟件進行統計學分析處理。試驗數據采用±s表示,采用單因素方差分析,兩兩比較行t檢驗。檢驗水準α=0.05,P<0.05表示差異有統計學意義。
3 結果
3.1 細胞形態
心肌組織碎塊種植入培養瓶2 d后倒置顯微鏡下可見心肌組織碎塊的邊緣有細胞長出,且向外發散性生長。熒光染色結果顯示,P0和P1代細胞內c-kit陽性細胞較少,細胞的大小和形狀與CSCs明顯不同;傳代至P3代后,雜細胞越來越少,最后得到純度較高的CSCs。不同培養時間和培養代次的CSCs形態學變化見圖1。
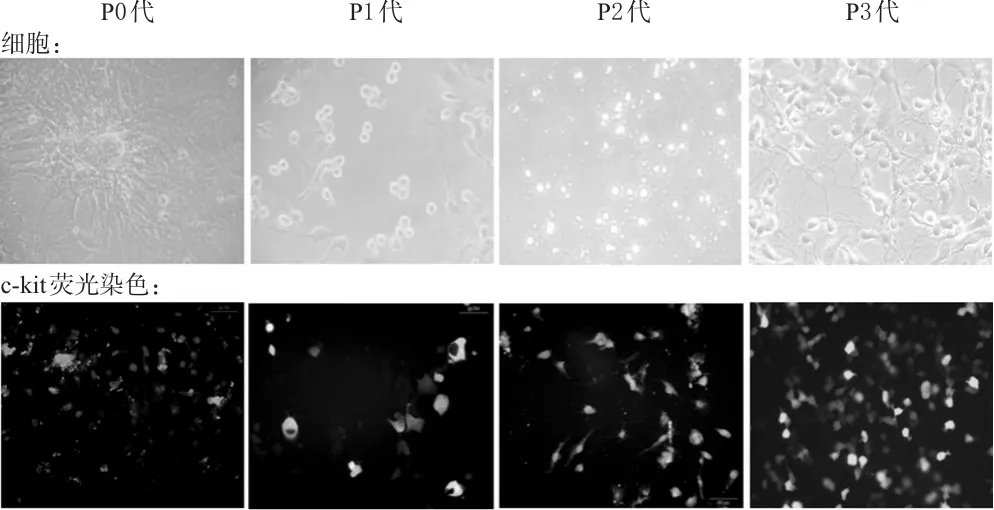
圖1 不同培養時間和培養代次的CSCs形態學變化(×100)Fig 1 Morphology of CSCs with different generations after culturing for different periods(×100)
3.2 CSCs純度
P0代細胞c-kit陽性細胞占比較少、CD45陽性細胞占比相對較多,隨著細胞傳代次數增加,c-kit陽性細胞占比明顯增高;到P3代時,大多數細胞均為c-kit陽性,而CD45陽性細胞占比和雜細胞占比共占約2.7%,說明細胞經過4次傳代后得到純化的CSCs。CSCs純度分析結果見表1。
表1 CSCs純度分析結果(±s,n=3,%%)Tab 1 Purity of CSCs cell(s±s,n=3,%%)
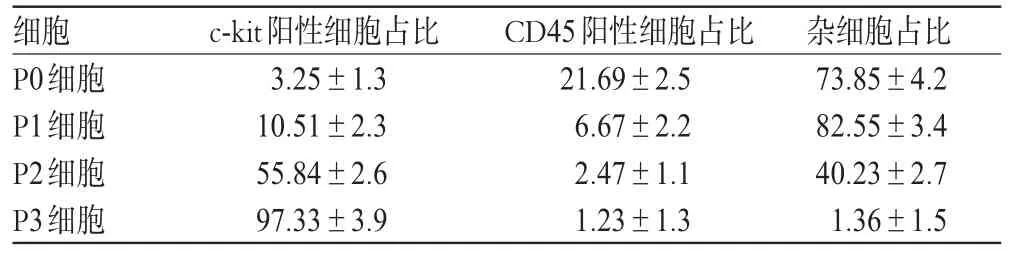
表1 CSCs純度分析結果(±s,n=3,%%)Tab 1 Purity of CSCs cell(s±s,n=3,%%)
細胞P0細胞P1細胞P2細胞P3細胞c-kit陽性細胞占比3.25±1.3 10.51±2.3 55.84±2.6 97.33±3.9 CD45陽性細胞占比21.69±2.5 6.67±2.2 2.47±1.1 1.23±1.3雜細胞占比73.85±4.2 82.55±3.4 40.23±2.7 1.36±1.5
3.3 cTnT表達
與空白對照組比較,各誘導組細胞均有明顯的cTnT陽性表達(P<0.01),其中5-氮胞苷誘導組和鹿茸多肽誘導組效果相當,聯合誘導組效果最明顯。各組細胞cTnT表達的免疫熒光圖見圖2。
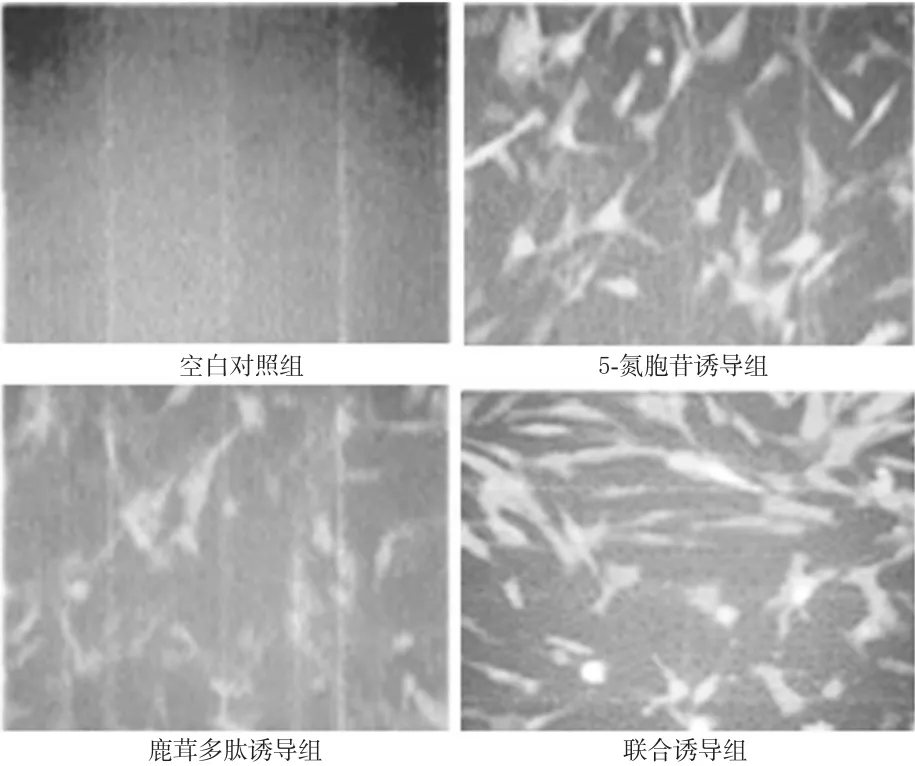
圖2 各組細胞cTnT表達的免疫熒光圖(×200)Fig 2 Immunofluorescence diagram of the expression of cTnT in CSCs(×200)
3.4 cTnT、ATF-2、MEF-2C蛋白表達
與空白對照組比較,各誘導組細胞cTnT、ATF-2和MEF-2C蛋白表達增強(P<0.05)。與5-氮胞苷誘導組比較,鹿茸多肽誘導組細胞cTnT、MEF-2C蛋白表達增強,聯合誘導組細胞cTnT、ATF-2、MEF-2C蛋白表達均增強(P<0.05)。各組CSCs細胞cTnT、ATF-2、MEF-2C蛋白表達的電泳圖見圖3,檢測結果見表2。
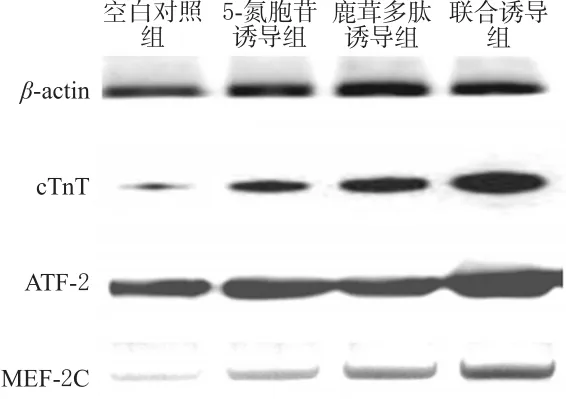
圖3 各組CSCs細胞cTnT、ATF-2、MEF-2C蛋白表達的電泳圖Fig 3 Electrophoretogram of the protein expression of cTnT,ATF-2 and MEF-2C in CSCs
表2 各組CSCs細胞cTnT、ATF-2、MEF-2C蛋白表達的檢測結果(±s,n=3)Tab 2 The protein expression of cTnT,ATF-2 and MEF-2C in CSC(s±s,n=3)
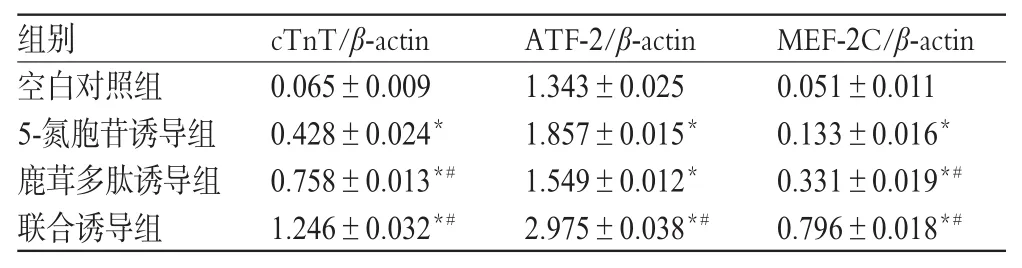
表2 各組CSCs細胞cTnT、ATF-2、MEF-2C蛋白表達的檢測結果(±s,n=3)Tab 2 The protein expression of cTnT,ATF-2 and MEF-2C in CSC(s±s,n=3)
注:與空白對照組比較,*P<0.05;與5-氮胞苷誘導組比較,#P<0.05Note:vs.blank control group,*P<0.05;vs.5-azacitidine induction group,#P<0.05
組別cTnT/β-actin ATF-2/β-actin MEF-2C/β-actin空白對照組5-氮胞苷誘導組鹿茸多肽誘導組聯合誘導組0.065±0.009 0.428±0.024*0.758±0.013*#1.246±0.032*#1.343±0.025 1.857±0.015*1.549±0.012*2.975±0.038*#0.051±0.011 0.133±0.016*0.331±0.019*#0.796±0.018*#
3.5 cTnT、Nkx2.5、GATA4 mRNA表達
與空白對照組比較,各誘導組細胞cTnT、Nkx2.5、GATA4 mRNA表達增強(P<0.05)。與5-氮胞苷誘導組比較,鹿茸多肽誘導組和聯合誘導組細胞cTnT、GATA4 mRNA表達增強(P<0.05)。各組CSCs細胞cTnT、Nkx2.5、GATA4 mRNA表達的電泳圖見圖4,檢測結果見表3。
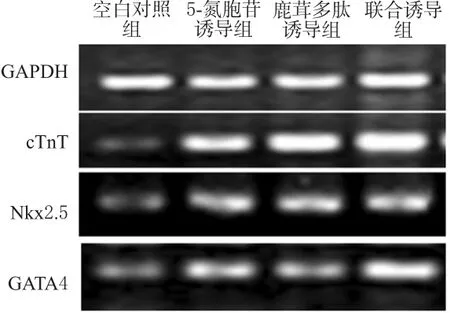
圖4 各組CSCs細胞cTnT、Nkx2.5、GATA4 mRNA表達的電泳圖Tab 4 Electrophoretogram of mRNA expression of cTnT,Nkx2.5 and GATA4 in CSCs
表3 各組CSCs細胞cTnT、Nkx2.5、GATA4 mRNA表達的檢測結果(±s,n=3)Tab 3 mRNA expression of cTnT,Nkx2.5 and GATA4 in CSCs(±s,n=3)
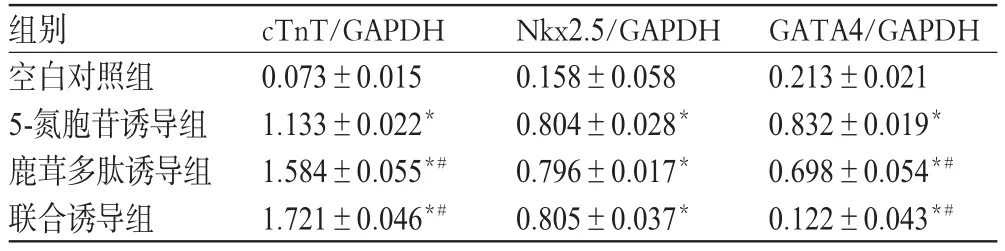
表3 各組CSCs細胞cTnT、Nkx2.5、GATA4 mRNA表達的檢測結果(±s,n=3)Tab 3 mRNA expression of cTnT,Nkx2.5 and GATA4 in CSCs(±s,n=3)
注:與空白對照組比較,*P<0.05;與5-氮胞苷誘導組比較,#P<0.05Note:vs.blank control group,*P<0.05;vs.5-azacitidine induction group,#P<0.05
組別空白對照組5-氮胞苷誘導組鹿茸多肽誘導組聯合誘導組cTnT/GAPDH 0.073±0.015 1.133±0.022*1.584±0.055*#1.721±0.046*#Nkx2.5/GAPDH 0.158±0.058 0.804±0.028*0.796±0.017*0.805±0.037*GATA4/GAPDH 0.213±0.021 0.832±0.019*0.698±0.054*#0.122±0.043*#
4 討論
大量的實驗模型及人類心臟疾病證實凋亡造成的心肌細胞的減少在人類多種類型的心臟疾病中占據極其關鍵的地位,并最終導致心臟功能的衰竭[8];同時,由于心肌生理結構的原因,心肌細胞的再生能力十分有限[3],故一旦出現受損,心功能水平和心肌細胞數量會長期處于較低水平。所以,目前臨床已經將通過何種方法可以顯著促進心肌細胞的增殖,進而達到恢復心臟功能的方法作為研究的熱點、難點問題。隨著細胞移植療法研究的不斷深入和臨床實踐應用成果的取得,使心臟疾病的細胞移植治療成為可能。干細胞是來源于骨髓組織,并具有多向分化潛能的細胞,在體內或體外均可向多譜系的細胞分化[9-11]。CSCs在移植后可以分化成為心肌細胞而實現心肌組織損傷的修復,因此其在心肌細胞移植治療方面的應用研究備受關注,是心肌細胞移植和心肌組織工程最具應用前景的干細胞之一。
CSCs向心肌細胞分化必須有Nkx2.5、GATA4和MEF-2C等早期心肌形成轉錄因子的表達的啟動[12]。cTnT分子的啟動子區有GATA4和Nkx2.5結合位點,且GATA4的表達要先于cTnT表達,這一結果提示通過心肌特異性基因的轉錄調節,干細胞獲得心肌細胞的表型[13]。5-氮胞苷是經典的干細胞誘導劑,多見于骨髓間充質干細胞、胚胎干細胞等向心肌細胞分化[14]。本試驗應用5-氮胞苷和鹿茸多肽誘導CSCs 14 d,結果顯示5-氮胞苷和鹿茸多肽誘導均使cTnT、ATF-2、MEF-2C、Nkx2.5和GATA4表達明顯增加(P<0.05);而鹿茸多肽誘導組和5-氮胞苷誘導組cTnT、Nkx2.5、GATA4 mRNA的表達量幾乎一樣(P>0.05)。這說明鹿茸多肽和5-氮胞苷具有同樣的體外誘導cTnT、Nkx2.5、GATA4基因表達的作用。而5-氮胞苷是化學誘導劑,具有一定的毒性,長期使用,可能誘導細胞變異或死亡[15]。鹿茸多肽具有與5-氮胞苷相同的作用,但目前未見毒性報道。本研究表明,鹿茸多肽可通過誘導ATF-2、MEF-2C、Nkx2.5和GATA4的表達增加,促進cTnT增高,促進心肌細胞分化。
綜上所述,本實驗應用鹿茸多肽誘導CSCs,可使c-kit陽性表達早期心肌特異性轉錄因子GATA4、Nkx2.5、ATF-2、MEF-2C,從而顯示出了強效的誘導心肌細胞分化的作用,但其機制有待進一步深入研究。
[1] Wang L,Hu X,Zhu W,et al.Increased leptin by hypoxicpreconditioning promotes autophagy of mesenchymal stem cells and protects them from apoptosis[J].Sci China Life Sci,2014,57(2):171.
[2] Huang K,Liu P,Li X,et al.Neural progenitor cells from human induced pluripotent stem cells generated less autogenous immune response[J].Sci China Life Sci,2014,57(2):162.
[3] 李朝政,許佳明,王燁,等.鹿茸多肽誘導心肌干細胞分化作用及對心肌細胞特征性MHC基因表達的影響[J].吉林中醫藥,2014,34(8):825.
[4] 廖聯明,鄭友生,江敏,等.黃芪甲苷促進心肌干細胞分化的作用研究[J].中華細胞與干細胞雜志:電子版,2011,1(1):52.
[5] 劉博武,呂安林,黃煒,等.四種誘導劑誘導骨髓間充質干細胞向心肌樣細胞的分化[J].中國組織工程研究,2012,16(14):2 471.
[6] 李朝政,徐巖,黃曉巍.鹿茸多肽對神經細胞損傷修復的研究進展[J].中國老年學雜志,2016,36(3):763.
[7] 王彤,萬智,黃輝,等.大鼠心肌干細胞的體外分離培養和生物學特性鑒定[J].嶺南急診醫學雜志,2008,13(2):81.
[8] 陳少賢,劉曉穎,林秋雄,等.三七總皂苷抑制心肌細胞凋亡的作用機制研究[J].熱帶醫學雜志,2010,10(1):11.
[9] 丁志,楊松林.間充質干細胞生物學特性及其分化潛能[J].中國組織工程研究,2011,15(1):147.
[10] 高平,孫占勝,王伯珉,等.骨髓間充質干細胞誘導成神經元樣細胞移植治療脊髓損傷[J].中國組織工程研究,2013,17(23):4 256.
[11] 于海生,王寧.促進骨髓間充質干細胞增殖方法的研究進展[J].中國藥房,2014,25(37):3 533.
[12] 張曉瓊,凌斌,孫潔.關于骨髓間充質干細胞向心肌樣細胞分化的誘導劑研究概況[J].心血管康復醫學雜志,2014,123(6):683.
[13] 李普.外源性基因Nkx2.5、GATA-4轉染兔BMSCs與心肌細胞共培養后治療心肌梗死的實驗研究[D].石家莊:河北醫科大學,2014.
[14] 侯紅,呂安林,達晶,等.人心臟干細胞向心肌細胞分化的研究[J].生物醫學工程研究,2015,34(3):182.
[15] 陳立朋,晏平,郭天柱,等.心肌干細胞移植心肌梗死區12周后的心電生理穩定性及室顫閾值改善效應[J].中國組織工程研究,2015,19(10):1 516.
Study on the Mechanism of Differentiation from Cardiac Stem Cells into Cardiac Cells Induced by Cornu Corvi Polypeptides
WANG Yanling1,HUANG Xiaowei2,LI Zhe1,HE Lu1,XU Yan2,QU Xiaobo2(1.Basic Medical College,Jilin University,Changchun 130021,China;2.School of Pharmacy,Changchun University of TCM,Changchun 130117,China)
OBJECTIVE:To explore the mechanism of differentiation from cardiac stem cells(CSCs)into cardiac cells induced by Cornu Corvi polypeptides.METHODS:CSCs were isolated from SD rats,and cultured to P3 generation after identification and then divided into blank control group,5-azacitidine induction group(3 μmol/L),Cornu Corvi polypeptides induction group(800 μg/ml)and combination induction group.Except blank control group was cultured with culture solution containing 3% FBS,other groups were cultured with culture solution containing relevant derivant for 14 d.The expression of cTnT was determined by immunohistochemical method;the expression of cTnT,ATF-2 and MEF-2C were determined by immunoblot assay;mRNA expression of cTnT,Nkx2.5 and GATA4 were detected by RT-PCR.RESULTS:CSCs were prepared successfully with purity>97%.Compared with blank control group(cTnT being negative),cTnT of induction groups were positive,and the protein expression of cTnT,ATF-2 and MEF-2C and mRNA expression of cTnT,Nkx2.5 and GATA4 were all increased(P<0.05).Compared with 5-azacitidine induction group,the protein expression of cTnT and MEF-2C and mRNA expression of cTnT and GATA4 were decreased in Cornu Corvi polypeptide groups(P<0.05);the protein expression of cTnT,ATF-2 and MEF-2C and mRNA expression of cTnT and GATA4 were all increased in combination induction group(P<0.05).CONCLUSIONS:Cornu Corvi polypeptides can induce differentiation of CSCs into cardiac cells by promoting the expression of Nkx2.5,GATA4,ATF-2,MEF-2C and other transcription factors.
Cornu Corvi polypeptides;Cardiac stem cells;Cardiac cells;Differentiation
R361+.3
A
1001-0408(2016)34-4780-04
2016-03-16
2016-06-06)
(編輯:鄒麗娟)
吉林省中醫藥科技項目(No.2014ZD6);吉林省衛生計生科研計劃項目(No.2015Z062)
*高級實驗師,碩士。研究方向:細胞結構與功能。電話:0431-85619783。E-mail:wangyanl@jlu.edu.cn
#通信作者:教授,博士。研究方向:中藥藥理學。電話:0431-86172508。E-mail:quxiaobo0504@hotmail.com
DOI 10.6039/j.issn.1001-0408.2016.34.09

