當歸補血湯對大鼠腎缺血-再灌注損傷后T L R4/N F- B信號通路的影響
劉福和,倪文娟,王國康,徐權毅
(1.浙江醫藥高等專科學校藥學院,浙江 寧波 315100; 2.華東寧波醫藥有限公司,浙江 寧波 315806)
當歸補血湯對大鼠腎缺血-再灌注損傷后T L R4/N F- B信號通路的影響
劉福和1,倪文娟2,王國康1,徐權毅1
(1.浙江醫藥高等專科學校藥學院,浙江 寧波 315100; 2.華東寧波醫藥有限公司,浙江 寧波 315806)
目的 探討當歸補血湯對大鼠腎缺血-再灌注損傷(RIRI)后TLR4/NF- B信號通路的影響,為RIRI的作用機制及其干預提供參考。方法 將45只SD大鼠隨機分為假手術組(Sham組)、缺血-再灌注模型對照組(IR組)、當歸補血湯預處理組(IR+DG組),每組15只。實驗前5 d,Sham組和IR組以生理鹽水10 mL/(kg·d)每天灌胃1次,IR+DG組以當歸補血湯10 mL/(kg·d)每天灌胃1次。所有大鼠均切除右腎,Sham組僅游離左腎蒂,不夾閉左腎動脈;IR組和IR+DG組均行RIRI模型制備。比較各組血清肌酐(Cr)、尿素氮(BUN)水平,行腎臟組織形態學檢查及腎小管評分,檢測腎組織TLR4,NF- B p65 mRNA水平。結果 各組均按預定方案完成手術,IR組、IR+DG組大鼠均順利完成RIRI模型制備;IR組、IR+DG組血清Cr,BUN水平及腎組織中TLR4 mRNA和NF- B p65 mRNA的表達水平均高于Sham組(t=3.72~7.05,P<0.05或 P<0.01),IR+DG組血清Cr,BUN水平及腎組織中TLR4 mRNA和NF- B p65 mRNA的表達水平均低于IR組(t=4.16~5.37,P<0.05);Sham組腎臟呈正常的組織結構,IR組、IR+DG組均呈程度不一的炎性反應,但 IR+DG組炎性程度輕于 IR組;IR組、IR+DG組腎小管評分均高于 Sham組水平(tIR=9.02,tIR+DG=6.21,P<0.01),IR+DG組腎小管評分低于IR組(tIR=5.15,P<0.05)。結論 大鼠RIRI后可能通過TLR4/NF- B信號通路介導下游級聯炎癥免疫反應,當歸補血湯預處理可能通過抑制TLR4/NF- B信號通路而緩解RIRI損傷過程中的炎性反應,對大鼠RIRI損傷具有積極的保護作用。
缺血-再灌注損傷;信號轉導;免疫炎性反應;當歸補血湯;干預;大鼠
腎臟是哺乳動物的高灌注器官,對缺血及缺血-再灌注均比較敏感,腎缺血-再灌注損傷(RIRI)是臨床常見的病理現象[1]。免疫炎性反應在RIRI的發病機制中可能有重要作用[2]。近年來發現的一類細胞表面信號傳導跨膜受體,即Toll樣受體(TLRs)是參與非特異性免疫的一類重要蛋白質分子,可通過激活核因子-κB(NF-κB)上調炎癥介質表達,進而介導下游的級聯炎癥免疫反應[2-3]。前期實驗研究[4]及臨床實踐表明,當歸補血湯對腎臟具有較好的保護作用,但其作用機制尚未完全闡明。基于此,筆者探討了當歸補血湯對大鼠腎RIRI后 Toll樣受體4(TLR4)/NF-κB信號通路的影響,旨在為闡述當歸補血湯對RIRI的可能的保護機制提供參考,現報道如下。
1 材料與方法
1.1 動物、試藥及引物
動物:健康雄性SD大鼠45只,體質量230~260 g,鼠齡8~12周,SPF級,由浙江中醫藥大學動物實驗中心提供,實驗前常規分籠飼養至少7 d。
試藥:當歸(河南省宛西制藥股份有限公司,批號為080303)6 g,黃芪(河南省宛西制藥股份有限公司,批號為090203)30 g,加蒸餾水煎煮至100 mL(質量濃度為0.36 g/mL)備用。
引物:TRIzol試劑(美國Invitrogen公司);逆轉錄及定量聚合酶鏈式反應(PCR)試劑盒(美國Fermentas)。
目的基因及內參所用引物為(5′-3′)β-actin:正向GAAGTACCCCATTGAACACG,反向CAGGTCCAGACGCAGGATGG;TLR4:正向AGACATCCAAAGGAATACAGCAA,反向GCCTTCATGTCTATAGGTGATGC;NF-κB p65:正向GAGAGCCCTTGCATCCTTTA,反向CTTCCCTTTGGTCTTTCTGT,由上海生物工程公司設計及合成。
1.2 方法
按隨機數字表法將大鼠分為3組,即假手術組(Sham組)、缺血再灌注模型對照組(IR組)、當歸補血湯預處理組(IR+DG組),每組15只。試驗前5 d,Sham組和IR組以生理鹽水10 mL/(kg·d)每天灌胃1次,IR+DG組以當歸補血湯10 mL/(kg·d)每天灌胃1次。大鼠試驗前12 h禁食,自由飲水。予以3.5%水合氯醛10 mL/kg經腹腔注射麻醉,沿正中線打開腹腔。所有大鼠均切除右腎,其中Sham組僅游離左腎蒂,不夾閉左腎動脈;IR組和IR+DG組均使用無創動脈夾夾閉左腎動脈45 min,松開動脈夾再灌注2 h,若腎臟經紫黑色變為紅色,則提示RIRI模型制作成功[4],造模不成功的實驗大鼠均予以剔除。
1.3 觀察指標
1.3.1 腎功能生化指標
試驗結束后,抽取下腔靜脈血5 mL,采用日本Hitachi7170A型自動化生化分析儀測定血清肌酐(Cr)、尿素氮(BUN)。
1.3.2 腎臟組織形態學及腎小管評分
抽取靜脈血后,切除左腎,縱向剖開,分成2段,一段置-70℃保存備用;另一段置中性福爾馬林液固定24 h,常規石蠟包埋制備病理切片,蘇木精-伊紅(HE)染色,光鏡下觀察腎小球、腎小管、腎間質變化及炎性細胞浸潤情況。采用Paller法[5]進行腎小管評分以評估腎小管損傷程度,×400倍光鏡下在腎臟皮質與髓質交界部位隨機選取10個視野,每個視野再隨機選取10條腎小管進行評分,其中皮質、髓質各取1/2。統計100個腎小管計分,計算平均分值。分值越高腎小管損傷越嚴重。
1.3.3 腎組織TLR4,NF-κB p65 mRNA檢測
取保存的另一側腎組織 80 mg,組織勻漿后采用Trizol法提取腎臟總RNA;依據逆轉錄試劑盒說明書配制反應體系,逆轉錄合成cDNA;以cDNA為模板,按照QRT-PCR試劑盒說明書配制反應體系,采用半定量RT-PCR法擴增TLR4 mRNA,NF-κB mRNA。以目的基因與內參β-actin表達量為參照進行相對定量分析。RT-PCR反應條件:94℃5 min,94℃30 s,TLR4 mRNA 60℃,NF-κB mRNA 55℃30 s,72℃1 min,72℃5 min,36個循環。擴增后產物進行1.5%瓊脂糖凝膠電泳,用凝膠成像分析儀于紫外光下采集圖像。
1.4 統計學處理
采用 SPSS 19.0統計學軟件進行分析,計量資料用均數±標準差(s)表示,正態分布的計量資料兩組間比較采用配對樣本的LSD-t檢驗,檢驗水準為α=0.05。P<0.05為差異有統計學意義。
2 結果
2.1 血清Cr及BUN
各組均按預定方案完成手術,IR組、IR+DG組大鼠均順利完成腎缺血-再灌注模型制備。IR組、IR+DG組Cr和BUN水平均高于Sham組(t=3.72~7.05,P<0.05或 P<0.01),IR+DG組血清Cr和BUN水平均低于IR組(tCr=4.16,tBUN=5.37,P<0.05),見表1。
表1 各組大鼠血清Cr及BUN水平比較(s,例,n=15)

表1 各組大鼠血清Cr及BUN水平比較(s,例,n=15)
注:與 Sham組比較,aP<0.05,bP<0.01;與 IR組比較,cP<0.05。表2同。
組別Sham組IR組IR+DG組Cr( mol/L) 25.92±3.76 45.75±4.90b34.21±3.50acBUN(mmol/L) 6.67±0.45 14.95±0.76b10.27±0.53ac
2.2 腎臟組織形態學及腎小管評分
經HE染色后,光鏡下可見:Sham組腎小球、腎小管呈正常的腎臟組織學結構,間質內未見充血水腫,亦沒有炎性細胞浸潤,見圖1 A;IR組程度不一的腎小球與腎間質呈充血像,腎小管上皮細胞不同程度的腫脹、壞死和脫落,管腔擴張,腎間質水腫、炎性細胞浸潤明顯,見圖1 B;IR+DG組腎小球結構無明顯變化,腎小管上皮細胞腫脹、壞死及腎間質的水腫輕于IR組,有少量炎性細胞浸潤,見圖1 C。Sham組、IR組、IR+DG組腎小管評分分別為(85.27±16.50)分、(381.31± 52.32)分、(215.78±30.37)分,可見IR組、IR+DG組腎小管評分均高于 Sham組(tIR=9.02,tIR+DG=6.21,P<0.01),IR+DG組腎小管評分低于IR組(tIR=5.15,P<0.05)。
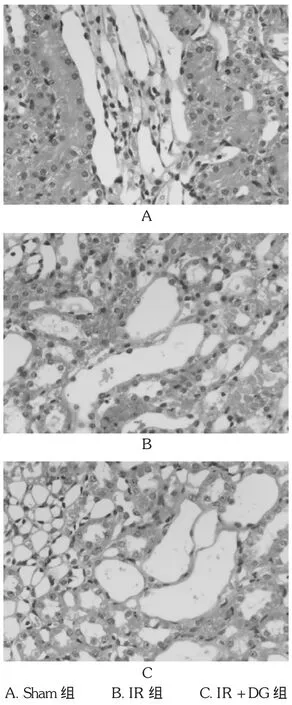
圖1 HE染色(×400)
2.3 腎組織中TLR4和NF- B p65 mRNA表達
以β-actin為內參,檢測各組腎組織中TLR4 mRNA和NF-κB p65 mRNA的表達,IR組、IR+DG組腎組織中TLR4 mRNA和NF-κB p65 mRNA的表達水平均高于 Sham組(t=4.59~8.05,P<0.05或 P<0.01),IR+DG組腎組織中TLR4 mRNA和NF-κB p65 mRNA的表達水平均低于 IR組(tTLR4=4.37,tNF-κBp65=5.36,P<0.05)。詳見表2。
3 討論
缺血-再灌注損傷是一種多因素、多途徑的復雜病理生理過程[6],可能涉及復雜的發生進展機制,但目前仍未完全闡明該發生機制,相關學者和學說試圖闡釋該發生機制,有細胞內Ca2+超載、氧自由基增加、免疫炎癥因子作用、高能磷酸化合物缺乏、細胞凋亡及無復流現象等[1-2],其中免疫炎性反應介導的損傷作用被認為是缺血-再灌注損傷的關鍵環節[2]。
表2 各組大鼠腎組織中TLR4,NF- B p65 mRNA表達水平比較(s,n=15)

表2 各組大鼠腎組織中TLR4,NF- B p65 mRNA表達水平比較(s,n=15)
組別Sham組IR組IR+DG組TLR4(×10-3) 0.51±0.09 2.60±0.17b1.43±0.21acNF- B p65(×10-3) 0.61±0.13 2.81±0.36b1.12±0.23ac
TLR4/NF-κB信號通路在介導下游級聯炎癥免疫反應中具有重要作用。有學者認為缺血-再灌注損傷是以補體成分錯誤攻擊自身抗原(Ag)為特征的先天性免疫應答[7]。TLR4是目前研究較為成熟的一種TLRs,能特異性識別病原體相關分子模式(PAMP)[8],通過跨膜結構將病原相關分子刺激信號轉導入細胞內,誘導NF-κB等轉錄因子活化激活NF-κB,激活下游的信號轉導,引起一系列的炎癥應答,促成炎癥的發生和發展。阻斷TLR4/NF-κB信號傳導通路有望成為干預缺血-再灌注損傷的一個重要的治療靶點[9]。
近年來,在缺血-再灌注損傷的干預研究中,缺血預處理備受關注并彰顯出諸多優勢。缺血預處理[10]是指于可能缺血出現前即對組織器官進行短暫、輕微的缺血-再灌注,從而提高細胞、組織和器官對缺血缺氧的耐受程度,一般認為這是經啟動組織、細胞自身內源性的保護機制而發揮效應的[11]。目前,缺血預處理的保護作用已被不同的動物及不同的器官模型所證實為可降低缺血-再灌注損傷的有效方法。本研究中,IR+DG組于大鼠造模前經腹腔注入當歸補血湯即為缺血預處理,該方選自金元時期李東垣所著《內外傷辨惑論》[12],僅由當歸、黃芪組方,其中重用黃芪以大補脾肺之氣,以資生血之源,與當歸并用,養血和營,則陽生陰長,氣血兩旺。兩藥配伍,共著補氣、生血、活血之功,臨床主要用于勞倦內傷、氣弱血虛之證。
本研究結果表明,IR組、IR+DG組血清Cr和BUN水平,腎小管評分,腎組織中TLR4 mRNA和NF-κB p65 mRNA的表達水平均高于Sham組,腎臟組織形態學也呈現出類似的變化,這提示IR組、IR+DG組腎臟組織形態、功能出現損傷,TLR4及NF-κB轉錄增加,其原因在于造模所致的缺血-再灌注損傷。與IR組比較,IR+DG組血清Cr和BUN水平、腎小管評分、腎組織中TLR4 mRNA和NF-κB p65 mRNA的表達均較低,提示IR+DG組缺血-再灌注損傷較輕,分析其原因在于當歸補血湯預處理減輕了缺血-再灌注損傷的程度,這與文獻[12]研究結果一致,某些中藥成分可以阻斷TLR4/NF-κB信號通路(包括降低其下游關鍵因子表達)[13-14],對機體起保護作用。
綜上所述,大鼠腎RIRI后可能通過TLR4/NF-κB信號通路介導下游級聯炎癥免疫反應,當歸補血湯預處理可能通過抑制 TLR4/NF-κB信號通路而緩解缺血-再灌注損傷過程中的炎性反應,對大鼠腎RIRI具有積極的保護作用。
[1]石 旦,何小舟,徐海燕,等.腎缺血再灌注損傷及其保護的研究進展[J].醫學綜述,2009,15(18):2 802-2 806.
[2]梁永會,文志勇,詹鴻靜,等.腎缺血再灌注損傷后炎癥因子和觸發信號的研究進展[J].海南醫學,2012,23(5):115-118.
[3]陳 超.Toll樣受體4與腎缺血再灌注損傷關系研究進展[J].國際泌尿系統雜志,2014,34(2):295-298.
[4]呂長江,劉福和,王國偉,等.當歸補血顆粒對大鼠腎缺血再灌注損傷的保護機制研究[J].中國現代應用藥學,2014(6): 666-671.
[5]Paller MS.Free radical-mediated postischemic injury in renal transplantation[J].Ren Fail,1992,14(3):257-260.
[6]阮麗君,趙 明,黃清松.參麥對大鼠腎缺血再灌注損傷中TLR4/NF- B信號通路的影響[J].中國現代醫學雜志,2013,23(7):11-14.
[7]楊 楠,唐金榮.Toll樣受體4與腦缺血再灌注損傷的關系研究進展[J].山東醫藥,2015,59(12):103-105.
[8]Rodriguez-Osorio CA,Lima G,Herrera-Caceres JO,et al.Genetic variations in toll-like receptor 4 in Mexican-Mestizo patients with intra-abdominal infection and/or pneumonia[J].Immunol Lett,2013,153(1-2):41-46.
[9]Wang C,Sun H,Song Y,et al.Pterostilbene attenuates inflammation in rat heart subjected to ischemia-reperfusion:role of TLR4/NF- B signaling pathway[J].Int J Clin Exp Med,2015,8(2):1 737-1 746.
[10]繆亦鋒,邱永明,張曉華,等.缺血預處理通過減輕內質網應激保護全腦缺血大鼠[J].國際腦血管病雜志,2013,21(8):618-623.
[11]王紅霞,李世英,李 崢,等.缺血預處理對局灶性腦缺血再灌注大鼠缺血側海馬CA1區低氧誘導因子-1 及存活素表達的影響[J].臨床神經病學雜志,2015,38(2):121-124.
[12]田樹云.補中益氣湯應用舉隅[J].實用中醫內科雜志,2011,25(10):75-76.
[13]路小光,戰麗彬,劉偉光,等.大黃附子湯對重癥急性胰腺炎肺損傷大鼠肺組織Toll樣受體4/核轉錄因子- B的影響[J].中國中西醫結合急救雜志,2009,16(1):14-17.
[14]閆曙光,惠 毅,周永學,等.烏梅丸拆方對潰瘍性結腸炎大鼠結腸TLR4/NF- B信號通路的影響[J].時珍國醫國藥,2013,24(6):1 386-1 388.
Influence of Danggui Buxue Decoction on TLR4/NF-κB Signal Pathway of Rats after Renal Ischemia Reperfusion Injury
Liu Fuhe1,Ni Wenjuan2,Wang Guokang1,Xu Quanyi1
(1.Pharmacy Faculty of Zhejiang Pharmaceutical College,Ningbo,Zhejiang,China 315100;
2.Huadong Ningbo Medicine Co.,Ltd.,Ningbo,Zhejiang,China 315806)
Objective To investigate the influence of Danggui Buxue Decoction on TLR4/NF-κB signal pathway of rats after renal ischemia reperfusion injury(RIRI),to provide reference for interpretation of its mechanism and intervention.M ethods 45 SD rats were randomly divided into the Sham group,IR group,and IR+DG group,15 rats in each group.5 d before experiment,rats in Sham group and IR group were orally once a day with normal saline by 10 mL/(kg·d),and rats in IR+DG group were orally once a day with Danggui Buxue Decoction by 10 mL/(kg·d).All rats were resected right kidney,rats in Sham group were dissociated left renal pedicle,without clamping left renal artery,and rats in IR group and IR+DG group were all given RIRI model preparation.After experiment,serum creatinine(Cr)and urea nitrogen(BUN),renal histology and renal tubule score,TLR4 mRNA and NF-κB p65 mRNA in renal tissue were compared.Results All groups completed operation according to predetermined plan;IR group and IR+DG group successfully completed RIRI model preparation.Serum Cr and BUN level,TLR4 mRNA and NF-κB p65 mRNA in renal tissue of IR group and IR+DG group were both higher than that in sham group(t=3.72-7.05,P<0.05 orP<0.01),and serum Cr and BUN level,TLR4 mRNA and NF-κB p65 mRNA in renal tissue of IR+DG group were lower than that in IR group(t=4.16-5.37, P<0.05).Sham group′s kidney showed normal structure,and there were some inflammatory reactions in IR group and IR+DG group, yet IR+DG group′s inflammatory reaction were slighter than that in IR group.Renal tubules score in IR group and IR+DG group were both higher than that in sham group(tIR=9.02,tIR+DG=6.21,P<0.01),yet IR+DG group′s renal tubules score were lower than that in IR group(tIR=5.15,P< 0.05).Conclusion It may mediate downstream cascade inflammatory immune response by TLR4/NF-κB signal pathway after RIRI in rats.Danggui Buxue Decoction pretreatment may relieve inflammatory response during RIRI process by inhibiting LR4/NF-κB signal pathway,thus has positive protection to RIRI.
ischemia reperfusion injury;signal transduction;inflammatory immune response;Danggui Buxue Decoction;intervention;rat
R285.5;R289.5
A
1006-4931(2016)21-0007-04
2016-07-13)
浙江省教育廳科研項目,項目編號:Y201534611。

