不同強度降血糖對急性腦梗死后高血糖患者預后影響的研究
楊 赟, 王欣榮, 張昆南, 曹文鋒, 吳曉牧
?
不同強度降血糖對急性腦梗死后高血糖患者預后影響的研究
楊 赟1, 王欣榮2, 張昆南1, 曹文鋒1, 吳曉牧1
目的 通過觀察伴有卒中后高血糖的急性腦梗死患者,初步探討強化降血糖與標準降血糖對其預后的影響。方法 納入106例發病72 h內的頸內動脈系統腦梗死患者,隨機分為將末梢血糖控制在6~8 mmol/L的強化降血糖組及將末梢血糖控制在8~10 mmol/L的標準降血糖組,各53例,均予以胰島素控制血糖達72 h。隨訪3 m,主要終點事件為:7 d NIHSS評分,3 m mRS評分;次要終點事件為:3 m死亡率,3 m嚴重殘疾率,低血糖發生率。結果 兩組間7 d NIHSS評分與3 m mRS評分均具有顯著統計學差異(P<0.05)。但兩組間3 m死亡率,3 m嚴重殘疾率,低血糖發生率均無顯著統計學差異(P>0.05)。結論 對急性腦梗死后高血糖患者強化降血糖較標準降血糖能顯著改善神經功能缺損評分,對輕中度患者獲益更明顯,但減少死亡及改善嚴重殘疾不明顯。
急性腦梗死; 高血糖; 預后
Kiers等發現20%~40%的缺血性卒中患者無論其之前是否有糖尿病,均表現為高血糖現象[1],稱為卒中后高血糖(post stroke hyperglycemia,PSH)。PSH是機體處于應激狀態時重要的臨床表現。有人認為PSH是腦卒中正常的生理反應,不需要加以處理。更多大型臨床研究均提示PSH與卒中后不良結局、高死亡率及高致殘率正相關[2~4],而且是卒中后結局的一個獨立預測因子[5,6]。動物實驗證實PSH增加了缺血半暗帶向梗死的轉化,及無血流現象[7]。近期通過頭部核磁共振及經顱多普勒檢查,此現象在人類當中亦得到了證實[8,9]。因此,需要控制好PSH,以改善缺血性卒中的臨床預后。
然而,對于PSH的控制目標,目前尚未達成共識。2009年美國GRASP研究等4項研究認為強化降血糖較標準降血糖更好改善臨床預后,降低死亡率及致殘率[10~13]。2008年美國THIS研究及2012年法國INSULINFARCT研究卻得到了相反的結論,認為強化降血糖不能更好改善預后[14,15]。本研究擬通過觀察中國人群中伴有PSH的急性腦梗死患者,初步探討不同水平的血糖控制目標值對其預后的影響,為PSH的治療提供更多的臨床依據。
1 材料與方法
1.1 研究對象 連續收集2015年1月-2015年12月發病72 h內入住本院神經內科的缺血性腦卒中患者。納入標準:(1)符合中華醫學會神經病學分會腦血管病學組制定的中國急性缺血性腦卒中診治指南的診斷標準[16],經頭部CT和MRI證實的頸內動脈系統腦梗死患者;(2)年齡范圍為16~80歲;(3)入院急查末梢血糖大于8 mmol/L;(4)入院時NIHSS評分>=4分。排除標準:(1)治療前已使用溶栓或抗凝治療;(2)既往腦卒中史;(3)妊娠或哺乳期婦女;(4)合并有心血管、肝、腎和造血系統等嚴重原發性疾病、精神病患者;(5)白細胞<4.0×109/L,血小板<9.0×109/L者。共納入106例符合納入標準的患者,均簽署知情同意書。該研究得到本院醫學倫理委員會批準。
1.2 研究方法 (1) 隨機化分組及治療方案:將106例患者依據隨機數字生成器以1∶1比例分別納入強化降血糖組及標準降血糖組,醫生對患者的治療非盲法。所有入組患者均按中國急性缺血性腦卒中診治指南進行治療。入院后72 h內,使用羅氏ACCU-CHEK血糖儀對兩組患者進行末梢血糖監測,每4 h測定一次,記錄末梢血糖數值。強化降血糖組及標準降血糖組均予以普通胰島素微量泵入,依據監測的末梢血糖水平,調整胰島素泵入量,強化降血糖組目標是達到末梢血糖控制于6~8 mmol/L之間,標準降血糖組目標是達到末梢血糖控制于8~10 mmol/L之間。若末梢血糖<6 mmol/L,則停止靜脈輸注,每15 min觀察一次,能否升至6 mmol/L以上。若升至以上,繼續予以胰島素微量泵入,但胰島素劑量要適量減少。若末梢血糖持續30 min以上不能升至6 mmol/L以上,則予以50%高滲葡萄糖10 ml靜推。若升至以上,繼續予以胰島素微量泵入,但胰島素劑量要減少。(2)資料收集:入院時記錄患者的一般情況,包括年齡、性別、體質指數(BMI),既往糖尿病病史,并記錄患者基線的美國國立衛生院神經功能缺損評分(National Institute of Health stroke scale,NIHSS評分),入院靜脈血糖水平、糖化血紅蛋白(HbA1C)、血壓水平及血脂水平,起病至行頭部MRI的時間,頭部MRI中DWI面積。每4 h監測末梢血糖,并記錄。于入院第7天再次行NIHSS評分,于3 m時行改良Rankin評分(The modified Rankin Scale,mRS評分)。mRS評分0~2分,為臨床結局良好;mRS評分3~5分,為嚴重殘疾,臨床結局不良。
主要終點事件為:7 d NIHSS評分,3 m mRS評分;次要終點事件為:3 m死亡率,3 m嚴重殘疾率,低血糖發生率(將末梢血糖水平低于3.9 mmol/L定義為低血糖)。
2 結 果
2.1 入組時基線資料比較 2015年1月-2015年12月共納入強化降血糖組患者53例,標準降血糖組患者53例。兩組基線資料(見表1),可見強化降血糖組及標準降血糖組在年齡、性別、血壓、血脂等方面無顯著統計學差異(P>0.05);兩組間在既往糖尿病患者比例、HbA1C及入組時靜脈血糖等方面亦無顯著統計學差異(P>0.05);同時,對比兩組起病至行頭部MRI的時間、入組時頭部MRI中DWI面積,均無顯著統計學差異(P>0.05)。但兩組在BMI方面有輕度差異,強化降血糖組為22.47±5.94;標準降血糖組為20.08±5.11,兩組有統計學差異(P=0.028)(見表1)。
2.2 主要終點事件 強化降血糖組及標準降血糖組在7 d NIHSS評分及3 m mRS評分各構成情況(見表2),可見兩組NIHSS評分及mRS評分構成均具有統計學顯著差異(分別為P=0.034,P=0.029)。進一步分析兩組7 d NIHSS評分數值與3 m mRS評分數值(見表3),經t檢驗得出,兩組間均具有顯著統計學差異(分別為P=0.032、P=0.003)(見表2、表3)。

表1 入院時兩組基線資料
注:兩組間基線比較*P<0.05
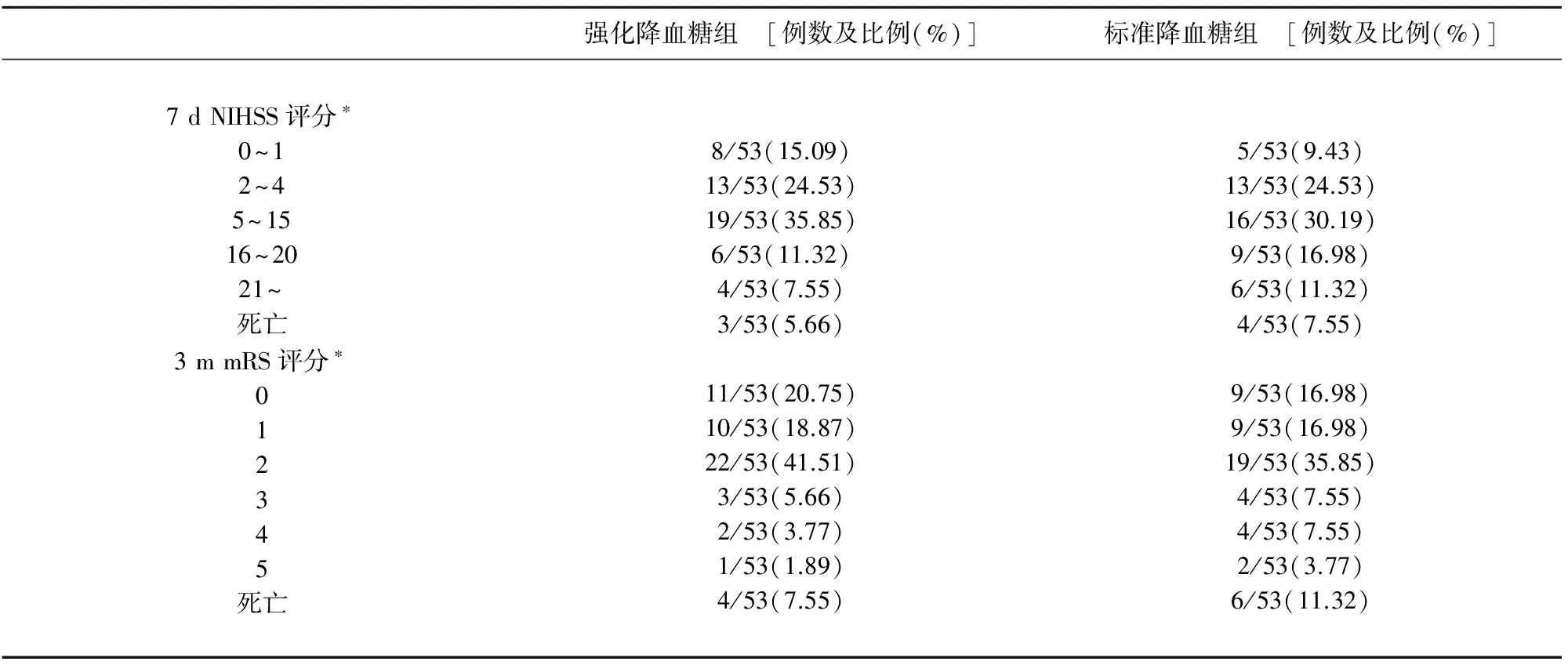
表2 兩組間主要終點事件構成及分布
兩組間7 d NIHSS評分及3 m mRS評分各構成比較*P<0.05

表3 兩組主要終點事件分析
兩組間7 d NIHSS評分、3 m mRS評分比較*P<0.05

表4 兩組次要終點事件分析
兩組間3 m死亡率,3 m嚴重殘疾率及低血糖發生率比較P>0.05
2.3 次要終點事件 強化降血糖組及標準降血糖組在3 m死亡率,3 m嚴重殘疾率及低血糖發生率方面情況(見表4),經χ2檢驗得出,兩組間3 m死亡率,3 m嚴重殘疾率及低血糖發生率均無統計學顯著差異(分別為P=0.502、P=0.217、P=0.773)。3 m死亡率,強化降血糖組較標準降血糖組的OR值為0.64(95%可信區間0.17~2.41);3 m嚴重殘疾率,強化降血糖組較標準降血糖組的OR值為0.55(95%可信區間0.18~1.64);低血糖發生率,強化降血糖組較標準降血糖組的OR值為1(95%可信區間0.33~3.08)(見表4)。
3 討 論
2001年Capes進行的一項Meta分析提示既往非糖尿病的卒中后高血糖,其相對死亡風險增加到3.3倍[4]。2003年Baird 等進行的一項前瞻性研究,發現末梢血糖及動態血糖>=7 mmol/L,與梗死灶面積擴大及不良預后獨立相關[5,6,17]。多種機制參與了急性高血糖的毒性作用[18,19]。高血糖可以通過加重組織酸中毒和乳酸生成,促進神經元的損傷[20]。同時,高血糖能降低灌注,增加缺血半暗帶向梗死的轉化,及無血流現象,能導致進一步的腦損傷[7]。另一方面,高血糖還能損害血管再通,增加再灌注損傷[21]。因此需要控制好PSH來降低卒中終點事件。
然而,對于PSH的控制目標,目前尚未達成共識。2009年美國GRASP研究等4項研究認為強化降血糖較標準降血糖更好改善臨床預后,降低死亡率及致殘率[10~13]。與之截然相反的是,2014年的一項系統綜述分析了11項RCT試驗,最終得出結論:強化降血糖組并不能改善臨床預后。綜合分析上述研究,其強化降血糖組的控制目標大部分均定在4~7 mmol/L之間。而事實上腦內血糖代謝與外周組織有所區別,其更為復雜,而且能量代謝更高,故筆者認為將血糖控制目標設立得偏高似乎更為合理。結合多個研究表明8 mmol/L以上的高血糖與腦卒中預后不良有顯著相關性[2,19],所以本研究擬將強化降血糖組血糖控制目標定為6~8 mmol/L之間,而將標準降血糖組血糖控制目標定為8~10 mmol/L之間。既能考慮到腦內血糖代謝的特點,又能很好地避免低血糖事件對神經系統帶來的影響。
本研究為隨機對照單盲研究,納入發病72 h內的前循環腦梗死患者,強化降血糖組及標準降血糖組各53例。通過基線數據分析,兩組除外BMI有輕度差異,其他均無顯著統計學差異。分析主要終點事件,兩組間7 d NIHSS評分與3 m mRS評分均有顯著統計學差異。但分析次要終點事件,兩組間3 m死亡率、3 m嚴重殘疾率及低血糖發生率均無顯著統計學差異。筆者分析可能原因是對入組時NIHSS評分較高、病情較危重的患者,強化降血糖可能無明顯獲益。這就導致了其較標準降血糖而言,3 m死亡率及嚴重殘疾率無明顯改善。而對入組時NIHSS評分偏低,病情輕中度的這一類患者,強化降血糖可能能夠更好地改善臨床預后,使得總體上而言,強化降血糖組較標準降血糖組7 d NIHSS評分與3 m mRS評分分值均偏低。由此,筆者提出大膽的假設,是否可以依據入組時NIHSS評分,將合并PSH的急性腦梗死患者進行分層劃分,采取不同的血糖控制策略,即NIHSS評分高的患者,PSH控制水平可以偏高;而NIHSS評分低的患者,PSH控制水平可以相應地下降一些。當然,這將需要下一步研究工作來證實。同時,本研究還比較了兩組在低血糖事件方面的差異,最后發現兩組間低血糖事件發生率無顯著統計學差異,這提示著強化降血糖的安全性也是有保障的。但是,值得一提的是,本研究將末梢血糖<6 mmol/L視為低血糖事件的警示點,而非以往研究的<3.9 mmol/L,這一方法很好地減少了低血糖事件的發生。
本研究不足之處首先在于研究的樣本量尚有限,下一步尚需擴大樣本量做進一步研究。其次,本研究納入人群為發病72 h的急性腦梗死患者,設置的發病時限偏長,可能導致發病72 h內血糖水平均未得到有效控制,最終影響分析結果,下一步可考慮將入組患者的發病時間縮短到24 h內。第三,本研究設置的胰島素治療時限為入院后72 h。而2006年的墨爾本卒中后動態血糖研究發現,除外早期高血糖,動態血糖監測儀還記錄到了卒中后晚期高血糖,許多患者在卒中后的至少88 h內都一直為高血糖水平。所以,似乎有必要延長胰島素治療時限。
通過本研究,我們發現強化降血糖較標準降血糖并不能減少死亡及嚴重殘疾,但其在一定程度上能夠改善神經功能缺損評分,特別對輕中度急性腦梗死患者更為獲益。這一結論將為下一步更深入的臨床研究提供依據。
[1]Kiers L,Davis SM,Larkins R,et al.Stroke topography and outcome in relation to hyperglycemia and diabetes[J].J NeurolNeurosurg Psychiatry,1992,55:263-270.
[2]Bruno A,Levine SR,Frankel MR,et al.Admission glucose level and clinical outcomes in the NINDS rtPA stroke trial[J].Neurology,2002,59:669-674.
[3]Kruyt ND,Biessels GJ,Devries JH,et al.Hyperglycemia in acute ischemic stroke:pathophysiology and clinical management[J].Nat Rev Neurol,2010,6:145-155.
[4]Capes SE,Hunt D,Malmberg K,et al.Stress hyperglycemia and prognosis of stroke in nondiabetic and diabetic patients:a systematic overview[J].Stroke,2001,32:2426-2432.
[5]Bruno A,Biller J,Adams HP,et al.Acute blood glucose level and outcome from ischemic stroke:trial of ORG 10172 in acute stroke treatment (TOAST) investigators[J].Neurology,1999,52:280-284.
[6]Weir CJ,Murray GD,Dyker AG,et al.Is hyperglycaemia an independent predictor of poor outcome after acute stroke? Results of a long-term follow up study[J].BMJ,1997,314:1303-1306.
[7]MacDougall NJ,Muir KW.Hyperglycaemia and infarct size in animal models of middle cerebral artery occlusion: systematic review and metaanalysis[J].J Cereb Blood Flow Metab,2011,31:807-818.
[8]Baird TA,Parsons MW,PhanhT,et al.Persistent poststroke hyperglycemia is independently associated with infarct expansion and worse clinical outcome[J].Stroke,2003,34:2208-2214.
[9]Alvarez-Sabin J,Molina CA,Ribo M,et al.Impact of admission hyperglycemia on stroke outcome after thrombolysis: risk stratification in relation to time to reperfusion[J].Stroke,2004,35:2493-2498.
[10]Vinychuk S,Melnyk V,Margitich V.Hyperglycemia after acute ischemic stroke:prediction,significance and immediate control with insulin-potassium-salinemagnesiuminfusions[J].Heart Drug,2005,5:197-204.
[11]Johnston KC,Hall CE,Kissela BM,et al.GRASP Investigators glucose regulation in acute stroke patients (GRASP) trial:a randomized pilot trial[J].Stroke,2009,40:3804-3809.
[12]McCormick M,Hadley D,McLean JR,et al.Randomized controlled trial of insulin for acute poststrokehyperglycemia[J].Annals of Neurology,2010,67:570-578.
[13]Staszewski J,Brodacki B,Kotowicz J,et al.Intravenous insulin therapy in the maintenance of strict glycemic control in nondiabetic acute stroke patients with mild hyperglycemia[J].Journal of Stroke and Cerebrovascular Diseases,2011,20(2):150-154.
[14]Bruno A,Kent TA,Coull BM,et al.Treatment of hyperglycemia in ischemic stroke (THIS):a randomized pilot trial[J].Stroke,2008,39:384-389.
[15]Rosso C,Corvol JC,Pires C,et al.Intensive versus subcutaneous insulin in patients with hyperacutestroke:results from the randomized INSULINFARCT trial[J].Stroke,2012,43:2343-2349.
[16]中華醫學會神經病學分會腦血管病學組急性缺血性腦卒中診治指南撰寫組.中國急性缺血性腦卒中診治指南2010[J].中華神經科雜志,2010,43(2):146-153.
[17]Tracey A,Mark Baird,Parsons W,et al.Persistent poststroke hyperglycemia is independently associated with infarct expansion and worse clinical outcome[J].Stroke,2003,34:2208-2214.
[18]Baird TA,Parsons MW,Barber PA,et al.The influence of diabetes and hyperglycemia on stroke incidence and outcome[J].J Clin Neurosci,2002,9:618-626.
[19]Gray CS,O’Connell JE,Lloyd H.Diabetes,hyperglycaemia and recovery from stroke[J].Geriatr Gerontol Int,2001,1:2-7.
[20]Anderson RE,Tan WK,Martin HS,et al.Effects of glucose and PaO2modulation on cortical intracellular acidosis,nadh redox state,and infarction in the ischemic penumbra[J].Stroke,1999,30:160-170.
[21]Ribo M,Molina C,Montaner J,et al.Acute hyperglycemia state is associated with lower tpa-induced recanalization rates in stroke patients[J].Stroke,2005,36:1705-1709.
The study of intensive insulin versus standard insulin for prognosis in patients with acute cerebral infarction and post stroke hyperglycemia
YANG Yun,WANG Xinrong,ZHANG Kunnan,et al.
(Nanchang University,Department of Neurology,Jiangxi Provincial People’s Hospital;the Institute of Neurology of Jiangxi Province,Nanchang 330006,China)
Objective To explore the effect of intensive insulin versus standard insulin on the prognosis in patients with acute cerebral infarction and post stroke hyperglycemia.Methods 106 cases of anterior circulation ischemic stroke within 72 hours were recruited.They were randomized to receive intensive insulin or standard insulin for 72 hours.The capillary glucose was confined to 6~8 mmol/L in intensive insulin group,while the capillary glucose was confined to 8~10 mmol/L in standard insulin group.We followed up all the patients for 3 months.Primary endpoint:the NIHSS scores at Day 7,the mRS scores at Day 90.Secondary endpoint:the mortality within 3 months,the rate of disability within 3 months,hypoglycemias.Results The NIHSS scores at Day 7 and the mRS scores at Day 90 were statistically different between groups(P<0.05),while the mortality within 3 months,the rate of disability within 3 months,and hypoglycemias were not statistically different between groups(P>0.05).Conclusion Compared to standard insulin group,intensive insulin group weren't better at decreasing the mortality and the rate of disability in patients with acute cerebral infarction and post stroke hyperglycemia,while better at improving neurologically functional sores,especially for mild to moderate cerebral infarction.
Acute cerebral infarction; Hyperglycemia; Prognosis
1003-2754(2016)10-0901-04
2016-08-06;
2016-09-28
江西省衛生計生委科技計劃(No.20155072)
(1.南昌大學,江西省人民醫院神經內科,江西省神經病學研究所,江西 南昌 330006;2.江西省婦幼保健院產前診斷科,江西 南昌 330006)
吳曉牧,E-mail:wuxm79@163.com
R743.3
A

