HBsAg酶聯免疫吸附試驗灰區設置研究*
王 瑞,張 婧,陳 瑜,甄 偉,于 磊,冷 嬋,葛紅衛
(北京市紅十字血液中心檢驗科 100088)
?
·論 著·
HBsAg酶聯免疫吸附試驗灰區設置研究*
王 瑞,張 婧,陳 瑜,甄 偉,于 磊,冷 嬋,葛紅衛△
(北京市紅十字血液中心檢驗科 100088)
目的 評價與驗證該實驗室乙型肝炎表面抗原(HBsAg)試驗設置0.9倍臨界值(CO值)的合理性。方法 參照美國臨床和實驗室標準協會(CLSI)發布的EP12-A2指南,通過試驗確定HBsAg試驗C5~C95區間即灰區。對HBsAg灰區標本進行抗體確認試驗。繪制受試者工作特征曲線(ROC曲線)確定HBsAg試驗最佳CO值。通過實驗室既往數據,分析乙型肝炎病毒DNA(HBV-DNA)單陽性標本酶聯免疫吸附試驗(ELISA)結果分布(S/CO值)與灰區的關系。結果 (C50±20%)水平檢測結果陰性數和陽性數均大于或等于95%,(C50-20%)~(C50+20%)水平范圍包含C5~C95區間,灰區范圍應在0.712~1.103倍CO值區間內。對44例HBsAg灰區標本(S/CO值0.900~0.990)進行中和試驗,結果均為無反應性。繪制HBsAg的ROC曲線,曲線下面積(AUC)為0.981,最適CO值為0.063(現用CO值在0.055~0.060)。2010年11月2日至2013年12月31日檢測標本研究886 291例患者,HBsAg陽性標本包括135例灰區標本,其中7例核酸檢測法(NAT)檢測結果均為反應性;共檢出HBV-DNA單陽性標本421例,其HBsAg檢測結果(S/CO值)分布區間為0.200~0.400,與陰性標本分布區間重疊、距0.9倍CO值較遠。結論 該實驗室現階段HBsAg試驗設置0.900的CO灰區過于嚴苛,試驗結果支持取消灰區設置。報道所提供的4種灰區評價方法為其他實驗室在設置ELISA試驗灰區方面提供了1種思路。
乙型肝炎; 酶聯免疫吸附測定; 核酸試驗; 灰區; 臨界值
乙型肝炎病毒(HBV)主要經血液和血制品傳播,HBV檢測方法有酶聯免疫吸附試驗(ELISA)、化學發光法、核酸檢測法(NAT)等。由于ELISA試驗具有價格低廉、試驗時間短、操作步驟相對簡單等優點,是國內血站篩查實驗室檢測乙型肝炎表面抗原(HBsAg)的主要方法[1-2]。ELISA檢測結果常以陰性和陽性判斷,但實際檢測工作中經常會遇到某些獻血者血液標本光密度值接近臨界值(CO值)的灰區標本。為防止弱陽性標本漏檢,最大限度確保血液安全,很多實驗室設立了“灰區”,將檢測值大于或等于灰區界限值標本判定為陽性,其血液做報廢處理。但大多試劑生產商并未提供灰區界限值,各血站實驗室對灰區的理解及判定規則也未達成共識[3]。隨著核酸檢測的逐步推廣,ELISA設置灰區的效能應重新進行評估。本研究以CO值驗證、灰區標本確認試驗、繪制受試者工作特征曲線(ROC曲線)、ELISA結果與NAT結果比對分析,評價4種方法對HBsAg灰區設置的合理性,現報道如下。
1 資料與方法
1.1 一般資料 來自本中心無償獻血者標本,包括肝素抗凝標本(ELISA檢測用)、乙二胺四乙酸(EDTA)抗凝標本(NAT檢測用)。
1.2 儀器與試劑
1.2.1 試劑 HBsAg診斷試劑盒,購自生物梅里埃中國有限公司,批號20120402、20120605。核酸診斷試劑盒,購自諾華診斷公司,聯檢試劑批號598605,HBV-DNA鑒別試劑批號598605。HBsAg確認試劑盒,購自生物梅里埃中國有限公司,批號B12EA。
1.2.2 質控品 每次進行HBsAg試驗采用外部質控品,質控品購自北京康徹斯坦生物有限公司,0.2 U/mL,批號201108003;每次進行NAT聯檢試驗和HBV-DNA鑒別采用外部質控品,質控品購自北京康徹斯坦生物有限公司,30 U/mL,批號2013010019。
1.2.3 儀器 HBsAg檢測采用全自動標本處理系統STAR 8CH、全自動酶聯免疫分析系統FAME 24/30(哈美爾頓公司);NAT聯檢試驗和HBV-DNA檢測采用全自動核酸檢測分析系統Tigris(諾華診斷公司)。
1.3 方法
1.3.1 依據EP12-A2《定性試驗評價方法用戶協議:提議指南》[4-6],確定HBsAg試驗C5~C95水平(灰區)。(1)確定HBsAg試驗CO值分析物水平(C50):由于試劑盒說明書中未提及C50水平,試劑生產廠商未提供C50標本,故采用EP12-A2文件方案中推薦的層級稀釋方法尋找C50水平標本。收集HBsAg試驗結果S/CO值大于1.000的陽性標本進行梯度稀釋,重復檢測各稀釋度標本8次,得到陰性、陽性結果概率各占50%的稀釋度,以此作為試驗本方法的C50水平,再對該稀釋度標本進行重復檢測(n=40),以驗證選定C50的可靠性。(2)確定HBsAg試驗C5~C95(灰區):為驗證HBsAg的CO值水平血清的穩定性,找出試驗方法的灰區,配置(CO±20%)的水平標本,確定C5和C95水平(灰區)。
1.3.2 灰區標本確證試驗 收集HBsAg灰區標本(S/CO為0.900~0.990)44例,進行中和試驗。以試劑盒診斷標準作為判定標準,結果表達為反應性、無反應性2種。
1.3.3 繪制ROC曲線確定HBsAg試驗最適檢測CO值 (1)陽性標本來源:挑選本實驗室2011年6月至2012年2月常規檢測中HBsAg檢測陽性標本486例,其中含HBsAg弱陽性標本50例(S/CO值0.900~1.500),進行中和試驗。(2)陰性標本來源:HBsAg及NAT檢測均為陰性標本292例。(3)繪制ROC曲線,選擇最適CO值:以中和試驗結果作為“金標準”結果,以檢測光密度值為統計變量,繪制ROC曲線分析。選擇Youdon指數最大的截斷點對應的界值作為試驗最適CO值,與現用CO值進行比較,確定灰區范圍[7-8]。
1.3.4 HBsAg陽性、HBV-DNA陽性標本結果分析 (1)統計2010年11月2日至2013年12月31日HBV-DNA鑒別試驗單陽性即“窗口期”或隱匿性乙型肝炎標本檢測情況。“窗口期”或隱匿性乙型肝炎標本的HBsAg檢測結果分布距離灰區設定值越近,說明灰區設置越合理;“窗口期”或隱匿性乙型肝炎標本的HBsAg檢測結果分布距離陰性標本分布區間越近,說明灰區設置功效越差。(2)統計2010年11月2日至2013年12月31日期間,HBsAg灰區標本核酸檢測情況。灰區標本內HBV-DNA陽性檢出率越高說明灰區設置越合理,反之則說明灰區設置功效越差。
1.4 質量控制 每次試驗外部質控品或內部質控對照,檢測結果與預期一致,確認檢測系統可靠。
1.5 統計學處理 采用SPSS19.0對數據進行處理。
2 結 果
2.1 依據EP12-A2,確定HBsAg C5、C95水平(灰區)
2.1.1 對初次試驗制備C50水平標本進行驗證試驗 見表1。檢測結果合計陽性25例,陰性15例。符合EP12-A2中陽性數量應為14~26例的要求,將此稀釋度標本作為C50水平標本進行后續試驗。
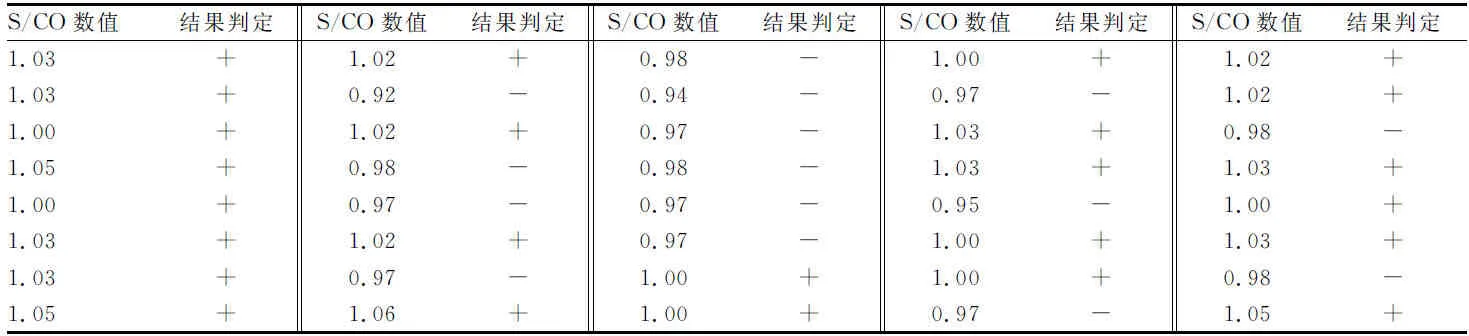
表1 C50水平驗證檢測結果(n=40)
2.1.2 采用C50稀釋度標本 按體積比配制(C50+20%)水平、(C50-20%)水平標本各40例,其檢測結果分別為(C50+20%)水平標本陽性40例,陽性率100%,S/CO均值1.103;(C50-20%)水平標本陰性40例,陰性率100%,S/CO均值0.712。由于檢測結果陰性數和陽性數大于或等于95%,(-20%)~(+20%)水平范圍包含了C5~C95區間,灰區范圍落在0.712~1.103倍CO值區間內。見圖1。
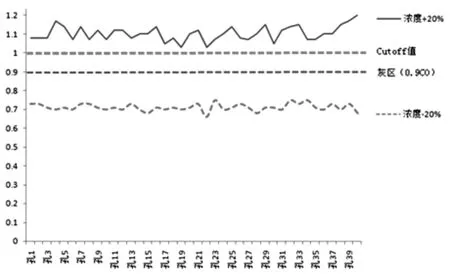
圖1 (C50±20%)水平標本檢測結果分布曲線
2.2 HBsAg灰區標本確證試驗檢測結果 對44例灰區標本(S/CO值0.900~0.990)進行中和試驗,結果均為無反應性。
2.3 繪制ROC曲線確定HBsAg試驗最適檢測CO值 以中和試驗結果作為“金標準”結果,以檢測光密度值為統計變量,繪制ROC曲線。ROC曲線下面積(AUC)為0.981,選擇Youdon指數最大的截斷點對應的界值作為試驗最適CO值為0.063,而試劑廠商建議CO值在0.055~0.060,最適CO值已大于廠商推薦CO值。見圖2。
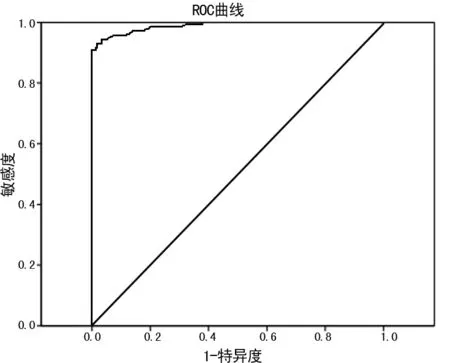
圖2 ROC曲線
2.4 對HBsAg陽性、HBV-DNA陽性標本結果分析
2.4.1 實驗室在2010年11月2日至2013年12月31日檢測標本886 291例,共檢出HBsAg“窗口期”或乙型肝炎隱匿性感染標本共計421例,且421例標本HBsAg檢測結果S/CO值均小于0.900,其中287例(占68.17%)HBsAg檢測結果S/CO值位于0.200~0.400。“窗口期”或乙型肝炎隱匿性感染標本相應HBsAg檢測結果距0.9倍灰區CO值較遠,與陰性標本分布區間重疊,說明灰區設置功效較差。見圖3。
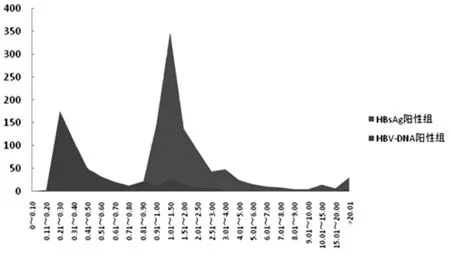
圖3 HBsAg陽性組、HBV-DNA陽性組ELISA結果(S/CO值)分布圖
2.4.2 實驗室在2010年11月2日至2013年12月31日檢測標本886 291例,HBsAg陽性中包括135例灰區標本,其中7例NAT檢測結果均為陽性。
3 討 論
我國是HBV感染的高發區。乙型肝炎是目前流行最廣泛、危害最嚴重的病毒性肝炎之一。HBV可經血液和血液制品傳播,《世界衛生組織血液篩查建議書》將HBV作為血液篩查實驗室必檢項目之一[9]。由于ELISA具有價格低廉、試驗時間短、操作步驟相對簡單等優點,是國內血站篩查實驗室檢測HBsAg的主要方法。不過,ELISA本身具有一定的局限性、試驗過程變異較大。為了防止弱陽性標本漏檢,確保輸血安全,防止HBV感染,很多實驗室設立了“灰區”。血液篩查實驗室是否應該設置灰區、如何設置灰區還存在一定爭議[10-11]。依據ISO15189的要求,各實驗室應對檢測系統的分析性能和(或)診斷性能的重要參數進行驗證。ELISA的醫學決定水平(如改變CO值設置灰區),應有科學依據并經過實驗室檢測系統驗證。
針對方法本身及實驗室設備情況,參考其他實驗室基礎,本實驗室將ELISA檢測HBsAg方法灰區設定為0.9倍CO值。隨著ELISA檢測試劑性能不斷提高、試驗過程管理的精細化及NAT技術的引入,此背景下應重新評估在灰區判定值存在的合理性及有效性。采用4種方法對本實驗室HBsAg灰區判定值進行評價。(1)依據EP12-A2評價方法的精密度:結果表明,本實驗室ELISA檢測HBsAg試驗具有良好的重復性和穩定性,因此將灰區界定在0.712~1.103倍CO值區間可確保檢測結果的穩定性,現有灰區判定值0.9倍CO值符合其要求。(2)對44例灰區標本進行中和試驗未發現有陽性結果,提示應重新審視現用灰區判定值設置的必要性。(3)采用ROC曲線確定HBsAg試驗最適診斷CO值:結果顯示,ROC曲線下面積為0.981,說明本方法準確性較高;選擇Youdon指數最大的截斷點對應的界值作為試驗最適CO值為0.063,而試劑廠商建議CO值在0.055~0.060,最適CO值已大于廠商推薦CO值,無必要再增設灰區。(4)本實驗室自2010年11月起對獻血者標本同時進行ELISA檢測和NAT檢測,經對既往數據分析獲知,421例乙型肝炎窗口期或隱匿性感染標本相應ELISA結果與陰性結果分布區間重疊,灰區判定值設定未起到防止漏檢的功效。由此可見,灰區不可能解決“窗口期”問題,引入更高級檢測技術才是解決問題的關鍵所在。綜上所述,本研究采用4種方法對現用HBsAg灰區設置進行評價,結論為本實驗室現階段HBsAg試驗設置0.9倍CO值灰區過于嚴苛,試驗結果支持取消灰區設置。
盡管灰區設定的初衷是加強血液安全,但由于各實驗室的依據及尺度不同,部分實驗室存在“過度檢驗”現象。在血液短缺的背景下,造成血液資源不合理浪費、損傷獻血者積極性、增加獻血者心理負擔等。隨著實驗室管理規范化、檢測過程控制精細化及核酸檢測技術的引入,檢測方法和策略發生了重大變化,實驗室應重新審視試驗灰區,確保其必要性、科學性和合理性。
[1]陳霞,黃麗麗,姜標.ELISA法檢測HBsAg灰區設置的探討[J].臨床輸血與檢驗,2011,13(1):63-66.
[2]陳顯,朱紹汶,黃成垠,等.ELISA法檢測抗-HCV灰區設置探討[J].臨床輸血與檢驗,2013,15(3):243-244.
[3]周艷萍,倪詩強,黃勇進.酶聯免疫吸附試驗“灰區”結果探討[J].檢驗醫學與臨床,2008,5(14):876-877.
[4]陳瀑.乙型肝炎病毒表面抗原ELISA試驗C50水平的確定及意義[J].現代檢驗醫學雜志,2013,28(1):106-108.
[5]安成,程實,李杰,等.HBeAg化學發光法臨界值驗證和灰區設定的方法探討及意義[J].中華檢驗醫學雜志,2012,35(11):1045-1047.
[6]黃文彩,李柳燕,張少豐,等.應用ROC曲線分析確定ELISA檢測抗-HBe灰區[J].檢驗醫學與臨床,2012,9(19):2426-2429.
[7]唐婧,包建玲,孟存仁,等.ROC曲線對ELISA檢測丙型肝炎抗體陽性判斷值的確定和分析[J].檢驗醫學,2014,29(8):826-830.
[8]伍偉健,郭如華.ELISA試驗灰區設置方法的探討[J].中國生物制品學雜志,2008,21(10):911-912.
[9]李金明.臨床酶免測定技術[M].北京:人民軍醫出版社,2005:100-105.
[10]李秀,王紅麗,馬超,等.ELISA定性檢測HBsAg灰區和相關實驗室結果分析[J].中國試驗診斷學,2014,18(2):290-291.
[11]中國合格評定國家認可委員會.CNAS-CL02醫學實驗室質量和能力認可準則(ISO15189:2012)[M].北京:中國計量出版社,2013:33-34.
The discussion of method for grey area of HBsAg enzyme linked immunosorbent assay*
WANGRui,ZHANGJing,CHENYu,ZHENWei,YULei,LENGChan,GEHongwei△
(DepartmentofClinicalLaboratory,BeijingRedCrossBloodCenter,Beijing100088,China)
Objective To evaluate and verify the rationality of grey area of HBsAg enzyme linked immunosorbent assay(ELISA) in the laboratory.Methods According to CLIS EP12-A2 guide,HBsAg concentration of the range between C5 and C95 concentration were determined as grey area by ELISA test.Samples of HBsAg in grey area were identified by ELISA.Using ROC curve analysis,the optimal CO level of HBsAg test was determined.Combined with previous data,the relationship between disposition of HBV-DNA single positive simple of ELISA results(S/CO value) and grey area were explored.Results Positive and negative results of (C50±20%) concentration were all higher than 95%.(C50-20%) to (C50+20%) concentration range included C5 to C95,gray area of S/CO value was 0.712 to 1.103 times of CO.Forty four cases of HBsAg ELISA grey area samples(S/CO value was 0.900 to 0.990) were confirmed negatively by neutralization confirmatory test.According to ROC curve analysis,AUC was 0.981,the optimal CO level was 0.063(CO level in use was 0.055 to 0.060).And 886 291 samples were tested since November 2,2010 to December 31,2013 in our lab,including 135 grey area samples which were tested out in HBsAg positive samples.Seven samples were reactive by NAT test.A total of 421 cases were HBV-DNA single positive simples,and their distribution interval of ELISA results(S/CO value) were between 0.200 and 0.400,which overlapped the distribution interval of ELISA negative samples and far from 0.9 times of CO level.Conclusion The setting of grey area(0.9 times of CO level) is too strict for the lab,the grey area could be cancelled based on experimental data.In addition,the four evaluation methods of grey area we offered will give other labs idea for setting ELISA grey area.
hepatitis B virus; enzyme linked immunosorbent assay; nucleic acid test; grey area; cut off value
國家衛生和計劃生育委員會衛生行業科研專項資助項目(201002005);北京市紅十字血液中心中心級課題(BRCBC2012-009)。
王瑞,女,主管技師,主要從事血液傳染病篩查、血站實驗室質量管理方面的研究。
△通訊作者,E-mail:hwge88@163.com。
10.3969/j.issn.1673-4130.2016.21.003
A
1673-4130(2016)21-2956-03
2016-01-29
2016-04-19)

