微生物表面活性劑的生產方法及其在食品添加劑中的應用
孫茂成 陳 曦 李懷偉 王 丹 富校軼 王舒然
(1.吉林醫藥學院食品質量與安全教研室,吉林 吉林 132013;2. 貴州省現代農業發展研究所,貴州 貴陽 550006;3. 山東省菏澤市食品藥品檢驗檢測中心,山東 菏澤 274000)
?
微生物表面活性劑的生產方法及其在食品添加劑中的應用
孫茂成1陳 曦2李懷偉3王 丹1富校軼1王舒然1
(1.吉林醫藥學院食品質量與安全教研室,吉林 吉林 132013;2. 貴州省現代農業發展研究所,貴州 貴陽 550006;3. 山東省菏澤市食品藥品檢驗檢測中心,山東 菏澤 274000)
微生物可以合成很多不同種類的表面活性劑,通常將這類表面活性劑稱為微生物表面活性劑,其在減少表面和界面張力方面具有很強的能力。本研究對微生物表面活性劑的種類、來源,生產菌株的篩選方法、廉價底物的利用,發酵工藝的優化,產品的分離純化和微生物表面活性劑在食品添加劑行業中的應用進展進行綜述,并提出目前研究過程中存在的問題,為微生物表面活性劑的食品工業化生產與應用提供理論參考。
微生物表面活性劑;生產與工藝優化;乳化劑;防腐劑;抗氧化劑
表面活性劑可以通過改善疏水化合物的溶解性來形成乳液,在工業中具有重要的地位[1]。化學合成的表面活性劑占商品化表面活性劑的70%~75%[2]。在實際應用中,往往需要使用高濃度的化學合成表面活性劑來保證乳化的完全性和穩定性,卻容易產生毒性和不可再利用物質的殘留。因此,化學合成表面活性劑替代品的開發成了該領域的研究熱點。
微生物表面活性劑是微生物代謝合成的具有雙親性(親水性和親油性)的一類次級代謝產物[3],因有良好的生物降解性、低毒性、高發泡性和穩定性[4],有望替代化學合成表面活性劑。此外,一些微生物表面活性劑還具有抵抗微生物[5]、調節免疫功能[6]、抗腫瘤[7]等性質,預示著其在食品工業、農業和生物醫學等領域大有可為。本研究主要對產微生物表面活性劑菌種的篩選、發酵工藝優化、微生物表面活性劑的分離純化和在食品添加劑中的應用進行綜述。
1 微生物表面活性劑分類和來源
微生物表面活性劑的分類主要是根據其化學結構進行劃分的。其中,根據分子量的不同,微生物表面活性劑可以分為低分子量和高分子量兩大類。低分子量微生物表面活性劑包括磷脂類、糖脂類和脂肽類;高分子量主要包括蛋白質類、脂蛋白類、脂多糖類和生物大分子的復雜混合物。其中高分子量類可以有效提高水包油型乳液的穩定性,然而低分子量類在降低表面和界面張力方面更為有效。表1[8]列舉了生物表面活性劑的主要種類和其微生物來源,其中細菌和酵母是其主要的微生物來源。
2 微生物表面活性劑的生產
2.1 產表面活性劑微生物的篩選方法
對表面活性劑微生物的篩選是微生物表面活性劑工業化的首要任務。篩選方法主要根據表面活性劑的表面和界面特性來選擇。表2[9]列舉了常見的篩選方法,這些方法可以定性或定量檢測微生物表面活性劑,從而指示高產微生物。另外,篩選方法的高通量化是未來發展的主要趨勢,這樣就可以快速、高效和準確地從大量樣本中進行定向篩選。
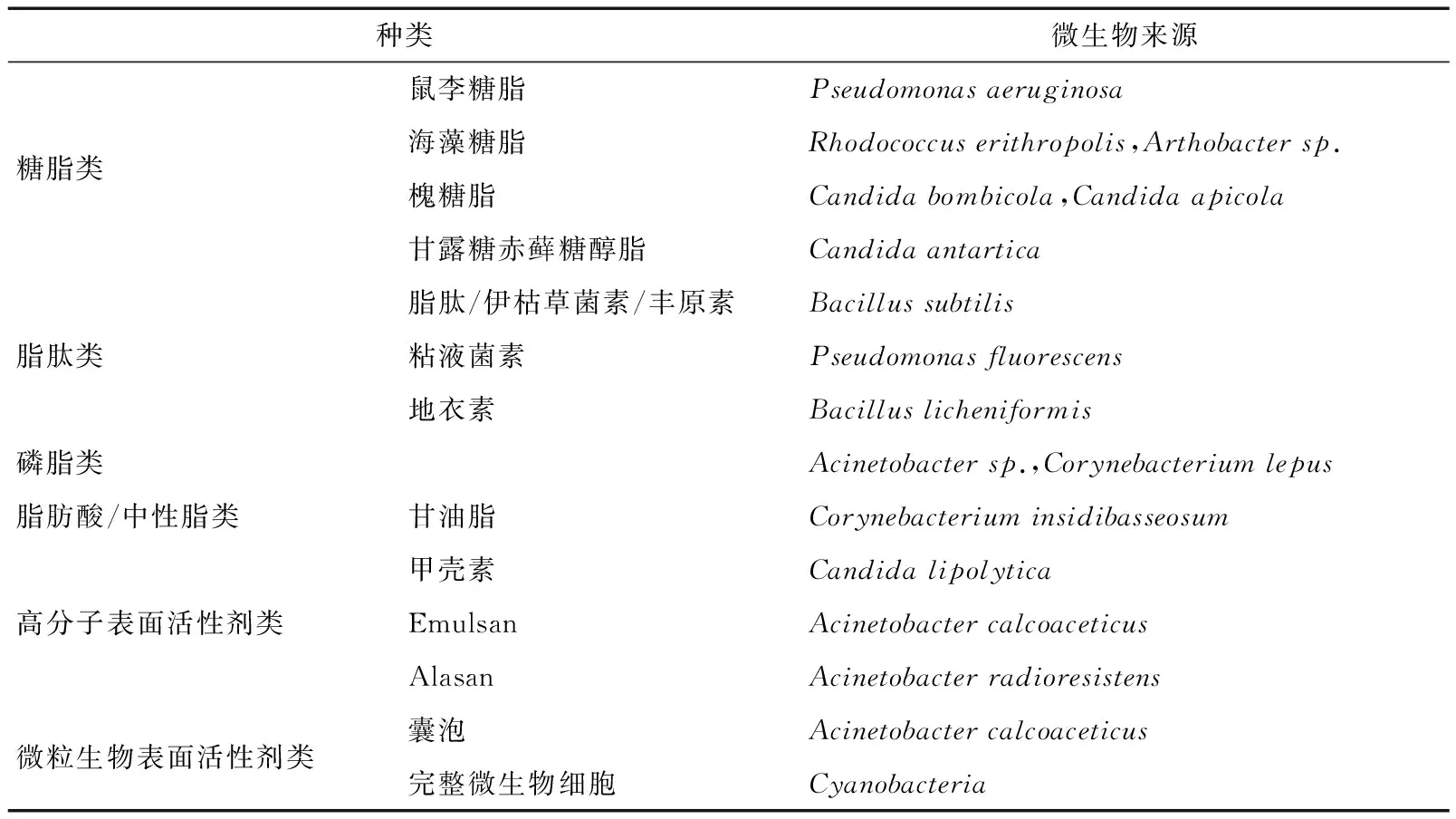
表1 微生物表面活性劑的主要種類和來源
2.2 以工農業副產物為發酵底物
高成本嚴重制約了微生物表面活性劑的大規模生產,因此降低其生產成本成為了當今的研究熱點。以廉價的工農業副產物作為發酵底物有望實現微生物表面活性劑的商品化,如植物油廢料、淀粉、乳清和糖蜜等副產物。
2.2.1 植物油廢料 葵花籽油和大豆油等植物油可以作為微生物表面活性劑的生產底物,尤其是植物油精煉和油炸食品加工過程中產生的大量廢油,這為低成本生產微生物表面活性劑提供了可能。Ruggeri等[10]分離到了能夠在菜籽油中生長的Rhodococcussp. BS32,且具有合成胞外表面活性劑的能力。Luna[11]利用Candidasphaerica(UCP 0995)在含有9%花生油精煉殘渣的發酵底物中生產出了低成本的糖脂類表面活性劑。Partovi等[12]研究了PseudomonasaeruginosaMR01利用酸化油、脫臭蒸餾物和皂腳3種大豆油的精煉廢物進行生產表面活性劑的差別,其中以皂腳作為發酵底物的產品純度和產量是最高的,分別達到了89.6%和(14.55±1.10) g/L,認為皂腳在降低微生物表面活性劑的生產成本方面具有潛在的應用價值。

表2 篩選微生物表面活性劑的常見方法
2.2.2 淀粉類 淀粉類廢料是微生物生產表面活性劑的潛在底物來源。Noah等[13]成功利用馬鈴薯加工中產生的富含淀粉的廢水作為B.subtilis生產表面活性劑的碳源,其產量從48 h 0.9 g/L提高至12~24 h 0.6 g/L。木薯加工產生的廢水中含有大量富含糖類的木薯淀粉,Pseudomonasflourescens可以利用木薯廢水合成具有優良乳化性能的表面活性劑[14]。PseudomonasaeruginosaL2-1以木薯加工廢水為主要發酵底物,生產的鼠李糖脂在生產成本和表面活性上都優于一種鼠李糖表面活性劑產品JBR599[15]。此外,淘米水、玉米漿和谷類食品加工中產生的廢水都有望成為微生物產生表面活性劑的發酵底物[16]。
2.2.3 乳清 乳清是乳品工業產生的副產物,尤其是干酪的生產。乳清含有豐富的乳糖和蛋白質等營養成分,直接排放會導致水體污染,因此乳清回收再利用成為當今乳品科學的熱點問題。乳清有望成為微生物產表面活性劑的廉價、易得的發酵底物。研究[17]發現,BacilluslicheniformisM104可以在干酪乳清中發酵生成脂肽類表面活性劑。Rodrigues等[18]從乳桿菌中篩選產表面活性劑的乳酸菌,發現Lactobacilluscasei、Lactobacillusrhamnosus、Lactobacilluspentosus和Lactobacilluscoryniformistorquens是最有潛力的菌株,而且它們均能以乳清作為發酵底物。Johny[19]從乳清中篩選出一株具有產生表面活性劑能力的酵母,該表面活性劑(2.77 mg)的排油圈直徑是12 mm,其乳化指數為61.42。當以乳清為碳源、硝酸鈉為氮源時,Pseudomonassp產表面活性劑的產量高達9.2 g/L[20]。
2.2.4 糖蜜 糖蜜是制糖工業中的副產物,具有價格較低和營養物質豐富的特點,富含碳水化合物、維生素和礦物質,例如甘蔗糖蜜的組成成分為(75%干物質):總糖48%~56%,糖以外的有機物9%~12%,蛋白質2.5%,鉀1.5%~5.0%,鈣0.4%~0.8%,鎂0.06%,磷0.06%~2.0%,生物素1.0~3.0 mg/kg,泛酸15~55 mg/kg,肌醇2 500~6 000 mg/kg和硫胺素1.8 mg/kg[21]。Onbasli等[22]研究了PseudomonasluteolaB17 和PseudomonasputidaB12在不同甜菜糖蜜濃度下產生鼠李糖脂的情況,發現利用5 g/100 mL糖蜜發酵12 h時鼠李糖脂的產量達到最大值。Al-Bahry等[23]以糖蜜作為BacillussubtilisB20的唯一碳源和能量來源生產表面活性劑,產量可達(2.29±0.38) g/L。
大豆糖蜜是生產大豆濃縮蛋白過程中的副產物,含有蔗糖、棉子糖和水蘇糖等可溶性糖類,以及微生物生長所需的其它營養因子,可能成為生產微生物表面活性劑的廉價發酵底物。Daniel等[24]基于大豆糖蜜配制的培養基,顯著降低了C.bombicola生產槐糖脂的成本。
2.3 微生物表面活性劑的發酵工藝優化
高效、經濟的發酵工藝對于微生物表面活性劑的工業化極其重要。其中,發酵條件和培養基成分都可以影響微生物表面活性劑的生產,例如pH、溫度、攪拌、通氣等發酵條件和碳源、氮源、金屬離子等培養基成分。經典的單因素試驗優化方法是在一項試驗中只有一個因素改變,保持其他的可控因素不變,然而這種優化方法既耗時又不能保證目標代謝物的高產。為了解決上述問題,響應面法已成功的應用于微生物表面活性劑發酵工藝的優化。Mnif等[25]利用響應面法優化BacillussubtilisSPB1生產表面活性劑的發酵條件,結果發現葡萄糖、K2HPO4和尿素的濃度是營養成分中的主要影響因子,當這3個因子濃度分別為15,1,6 g/L時,表面活性劑的最大產量可達(2.93±0.32) g/L,響應面法的結果比單因素試驗更為方便和可靠。此外,采用該法還顯著提高了PseudomonasaeruginosaMA01[26]、Pseudomonasaeruginosa2297[27]等菌株產表面活性劑的能力。
2.4 微生物表面活性劑的分離純化
分離純化占微生物表面活性劑生產成本很大的比重,有些產品的分離純化甚至可以占總成本的60%。表3列舉一些微生物表面活性劑的分離純化方法。其中,沉淀法和色譜法是微生物表面活性劑最常用的分離純化技術。此外,泡沫分餾、超濾和吸附-解吸等技術也可用于微生物表面活性劑的分離純化[33],然而這些技術大多處于實驗室階段。

表3 微生物表面活性劑的常見分離純化方法
理想的分離純化步驟,不僅要保證分離效率和產品純度,還要選用來源廣泛、價格低廉、低毒或無毒和環保性溶劑。例如低毒廉價的甲基叔丁醚(MTBE)已被成功應用于Rhodococcus產表面活性劑的分離純化中[34]。
3 微生物表面活性劑在食品添加劑中的應用
3.1 乳化劑
食品乳狀液和膠體是復雜的、多組分的多相體系,很難處于穩定狀態。乳化劑對于維持飲料和調味品等乳狀液的穩定性至關重要。另外,乳化劑還可以改善食品質地、口感和外觀等性質。由于具有低毒性和生物降解性,微生物表面活性劑作為食品乳化劑具有很大的優勢。研究發現,由酵母和細菌產生的大多數表面活性劑具有良好的耐熱和耐酸堿性,在食品加工過程表現出更好的穩定性,例如Saccharomycescerevisiae,Candidavalida,Candidautilis,Hansenulaanomala,Rrhodotorulagraminis,Rhodospirid-iumdiobovatum,Porphiridiumcruentum,Klebsiellasp和Acinetobactercalcoaceticus產生的表面活性劑不僅具有良好的穩定性,而且乳化性能均優于阿拉伯膠和羧甲基纖維素[35]。鼠李糖脂具有改善食品均勻性、維持脂肪穩定等功能,可以用來提高黃油和冷凍糕點的產品質量[36]。Mnif等[37]發現BacillussubtilisSPB1產生的表面活性劑在提高面包質量的效果上明顯優于商品化乳化劑大豆卵磷脂,例如在保持面包外形、體積、質地和貨架期等方面。
3.2 防腐劑
許多微生物表面活性劑有望作為食品防腐劑來使用,因為它們具有抗微生物的性質,比如抑制細菌、真菌等。從P.aeruginosaAT10獲得的鼠李糖脂在32 μg/mL時,抑制的細菌有Escherichiacoli,Micrococcusluteus,Alcaligenesfaecalis,抑制的真菌有Chaetoniumglobosum,Penicilliumcrysogenum,Aureobasidiumpullulans;在16 μg/mL時,抑制的細菌有Serratiamarcescens,Mycobacteriumphlei,抑制的真菌有AspergillusNiger[38]。Magalh?es等[39]研究了微生物表面活性劑鼠李糖脂的抗Listeriamonocytogenes效果,結果表明鼠李糖脂的抑菌濃度范圍為78.1~2 500.0 μg/mL,且濃度與抑菌活性呈正相關;此外,鼠李糖脂與Nisin具有強烈的協同抑制L.monocytogenes的作用。從Candidaantartica獲得的甘露糖赤蘚糖醇酯(MEL),具有良好的抗微生物作用,尤其是對革蘭氏陽性菌[40]。
3.3 抗氧化劑
食品在儲藏運輸過程中除了由微生物作用發生腐敗變質外,氧化是導致食品品質下降的重要因素。食品抗氧化劑是防止或延緩食品氧化,提高食品穩定性和延長食品儲藏期的食品添加劑。一些微生物表面活性劑具有抗氧化的作用,在食品抗氧化劑的應用方面具有潛力,如Takahashi等[41]發現MEL具有很強的清除超氧化物陰離子自由基的能力;Klebsiella產生的多糖類表面活性劑表現出了抑制大豆油自動氧化的能力,減緩了大豆油變質的進程,其抗氧化機理是包埋作用[42]。
4 問題與展望
盡管微生物表面活性劑在食品添加劑領域表現出了巨大的應用潛力,然而其距離大規模商品化還有一定的距離,這是因為還有許多問題有待解決。第一,很多微生物都可以產生表面活性劑,然而與化學表面活性劑相比,其生產成本仍然較高,開發低成本的微生物表面活性劑勢在必行。生產菌種的遺傳學特性是影響表面活性劑產能的重要因素,因此利用分子生物學方法創造具有高產和利用工農業副產物能力的突變菌株和重組菌株將是未來的研究熱點。第二,缺少大規模工業化生產的下游加工技術。再者,微生物表面活性劑作為食品添加劑的應用研究缺乏毒理學評價資料。相信隨著研究的不斷深入,微生物表面活性劑一定會成為食品添加劑行業的“寵兒”。
[1] 張世仙, 劉焱, 王正武, 等. 表面活性劑及其在食品工業中的應用[J]. 食品與機械, 2012, 28(6): 268-271.
[2] Marketandmarket.com. Surfactants Market by Product type [Anionic, Non-Ionic, Cationic, Amphoteric] Substrates [Synthetic/ Petrochemical based and Natural/Bio-based/Green] and Applications - Global Trends & Forecast to 2019[R/OL]. (2014-08-01)[2015-05-20]. http://www.marketsandmarkets.com/Market-Reports/biosurfactantsmarket-493.htm.
[3] MUKHERJEE S, DAS P, SEN R. Towards commercial production of microbial surfactants[J]. Trends in Biotechnology, 2006, 24(11): 509-515.
[4] MOLDES A B, TORRADO A M, BARRAL M T, et al. Evaluation of biosurfactant production from various agricultural residues byLactobacilluspentosus[J]. J. Agric. Food Chem., 2007, 55(11): 4 481-4 486.
[6] CHERESHNEV VA, GEIN SV, BAEVA TA, et al. Modulation of cytokine secretion and oxidative metabolism of innate immune effectors byRhodococcusBiosurfactant[J]. Bull Exp Biol Med., 2010, 149(6): 734-738.
[7] KUMAR V, KUMARI A, KUMAR D, et al. Biosurfactant stabilized anticancer biomolecule-loaded poly (D,L-lactide) nanoparticles[J]. Colloids and surfaces B: Biointerfaces, 2014, 117(5): 505-511.
[8] NITSCHKE M, COSTA S. Biosurfactants in food industry[J]. Trends in Food Science & Technology, 2007, 18(5): 252-259.
[9] 程斌斌. 產生生物表面活性劑細菌的篩選以及生物表面活性劑結構的解析[D]. 上海: 華東理工大學, 2013: 1-2.
[10] RUGGERI C, FRANZETTI A, BESTETTI G, et al. Isolation and characterisation of surface active compound-producing bacteria from hydrocarbon-contaminated environments[J]. International Biodeterioration & Biodegradation, 2009, 63(7): 936-942.
[11] LUNA J, RUFINO R, CAMPOS G, et al. Properties of the biosurfactant produced byCandidaSphaericacultivated in low-cost substrates[J]. Chemical Eegineering Transactions, 2012, 27(12): 67-72.
[12] PARTOVI M, LOTFABAD T B, ROOSTAAZAD R, et al. Management of soybean oil refinery wastes through recycling them for producing biosurfactant usingPseudomonasaeruginosaMR01[J]. World Journal of Microbiology and Biotechnology, 2013, 29(6): 1 039-1 047.
[13] NOAH K S, BRUHN D F, BALA G A. Surfactin production from potato process effluent byBacillussubtilisin a chemostat[J]. Applied Biochemistry and Biotechnology: Part A, Enzyme Engineering and Biotechnology, 2005, 121(1): 465-473.
[14] SURYANTI V, MARLIYANA S D, HANDAYANI D S, et al. Production and characterization of biosurfactant byPseudomonasfluorescensusing cassava flour wastewater as media[J]. Indonesian Journal of Chemistry, 2013, 13(3): 229-235.
[15] COSTA S G, NITSCHKE M, LEPINE F, et al. Structure, properties and applications of rhamnolipids produced byPseudomonasaeruginosaL2-1 from cassava wastewater[J]. Process Biochemistry, 2010, 45(9): 1 511-1 516.
[16] MAKKAR R S, CAMEOTRA S S, BANAT I M. Advances in utilization of renewable substrates for biosurfactant production[J]. AMB Express, 2011, 1(1): 1-19.
[17] GOMAA E Z. Antimicrobial activity of a biosurfactant produced byBacilluslicheniformisstrain M104 grown on whey[J]. Braz. Arch. Biol. Technol., 2013, 56(20): 4 396-4 403.
[18] RODRIGUES L, MOLDES A, TEIXEIRA J, et al. Kinetic study of fermentative biosurfactant production byLactobacillusstrains[J]. Biochemical Engineering Journal, 2006, 28(2): 109-116.
[19] JOHNY J M. Screening, gene sequencing and biosurfactant production fromPichiafermentans isolated from dairy effluents[J]. IOSR Journal Of Environmental Science, Toxicology And Food Technology(IOSR-JESTFT), 2013, 6(5): 4-13.
[20] PRAVEESH B, SONIYAMBY A, MARIAPPAN C, et al. Biosurfactant production byPseudomonassp from soil using whey as carbon source[J]. New York Science Journal, 2011, 4(4): 99-103.
[21] SAHARAN B S, SAHU R K, SHARMA D. A review on biosurfactants: fermentation, current developments and perspectives[J]. Genetic Engineering & Biotechnology Journal, 2011, 2 011: 1-14.
[22] ONBASLI D, ASLIM B. Determination of rhamnolipid biosurfactant production in molasses by somePseudomonasspp[J]. New Biotechnology, 2009, 25(6) :S255.
[23] AL-BAHRY S N, AL-WAHAIBI Y M, ELSHAFIE A E, et al. Biosurfactant production byBacillussubtilisB20 using date molasses and its possible application in enhanced oil recovery[J]. International Biodeterioration & Biodegradation, 2013, 81: 141-146.
[24] DANIEL H-J, REUSS M, SYLDATK C. Production of sophorolipids in high concentration from deproteinized whey and rapeseed oil in a two stage fed batch process usingCandidabombicolaATCC 22214 andCryptococcuscurvatusATCC 20509[J]. Biotechnol Lett, 1998, 20(12):1 153-1 156.
[25] MNIF I, CHAABOUNI-ELLOUZE S, GHRIBI D. Optimiz-ation of the nutritional parameters for enhanced production ofB.subtilisSPB1 biosurfactant in submerged culture using response surface methodology[J]. Biotechnol Res Int, 2012, 2 012: 1-8.
[26] ABBASI H, SHARAFI H, ALIDOST L, et al. Respone surface optimization of biosurfactant produced byPseudomonasaeruginosaMA01 isolated from spoiled apples[J]. Prep Biochem Biotechnol, 2013, 43(4): 398-414.
[27] KUMAR A P, JANARDHAN A, RADHA S, et al. Statistical approach to optimize production of biosurfactant byPseudomonasaeruginosa2297[J]. 3 Biotech, 2015, 5(1): 71-79.
[28] OLIVEIRA Acdsmd, BEZERRA Mds, PADILHA Ceda, et al. Recovery of rhamnolipids produced byPseudomonasaeruginosausing acidic precipitation, extraction, and adsorption on activated carbon[J]. Separation Science and Technology, 2013, 48(18): 2 852-2 859.
[29] SIVAPATHASEKARAN C, MUKHERJEE S, SAMANTA R, et al. High-performance liquid chromatography purification of biosurfactant isoforms produced by a marine bacterium[J]. Anal Bioanal Chem., 2009, 395(3): 845-854.
[30] DIMITROV K, GANCEL F, MONTASTRUC L, et al. Liquid membrane extraction of bio-active amphiphilic substances:recovery of surfactin[J]. Biochemical Engineering Journal, 2008, 42(3): 248-253.
[31] PATHAK K V, KEHARIA H. Application of extracellular lipopeptide biosurfactant produced by endophyticBacillussubtilisK1 isolated from aerial roots of banyan (Ficusbenghalensis) in microbially enhanced oil recovery (MEOR)[J]. 3 Biotech, 2014, 4(1): 41-48.
[32] PENFOLD J, THOMAS R K, SHEN H-H. Adsorption and self-assembly of biosurfactants studied by neutron reflectivity and small angle neutron scattering: glycolipids, lipopeptides and proteins[J]. Soft Matter, 2011, 8(3): 578-591.
[33] BAKER S C, CHEN C-Y. Enrichment and purification of lipopeptide biosurfactants[J]. Adv Exp Med Biol., 2010, 672: 281-288.
[34] KUYUKINA M S, IVSHINA I B, PHILP J C, et al. Recovery of rhodococcus biosurfactants using methyl tertiary-butyl ether extraction[J]. J. Microbiol Methods, 2001, 46(2): 149-156.
[35] CAMPOS J M, MONTENEGRO STAMFORD T L, SARUBBO L A, et al. Microbial biosurfactants as additives for food industries[J]. Biotechnol Prog, 2013, 29(5): 1 097-1 108.
[36] MUTHUSAMY K, GOPALAKRISHNAN S, RAVI T K, et al. Biosurfactants: properties, commercial production and application[J]. Current Science, 2008, 94(6): 736-747.
[37] MNIF I, BESBES S, ELLOUZE R, et al. Improvement of bread quality and bread shelf-life byBacillussubtilisbiosurfactant addition[J]. Food Science and Biotechnology, 2012, 21(4): 1 105-1 112.
[38] ABALOS A, PINAZO A, INFANTE M R, et al. Physicochemical and antimicrobial properties of new rhamnolipids produced byPseudomonasaeruginosaAT10 from soybean oil refinery wastes[J]. Langmuir, 2001, 17(5):1 367-1 371.
[40] KITAMOTO D, YANAGISHITA H, SHINBO T, et al. Surface active properties and antimicrobial activities of mannosylerythritol lipids as biosurfactants produced byCandidaantarctica[J]. J. Biotechnol, 1993, 29(93): 91-96.
[41] TAKAHASHI M, MORITA T, FUKUOKA T, et al. Glycolipid biosurfactants, mannosylerythritol lipids, show antioxidant and protective effects against H2O2-induced oxidative stress in cultured human skin fibroblasts[J]. Journal of Oleo Science, 2012, 61(8): 457-464.
[42] KAWAGUCHI K, SATOMI K, YOKOYAMA M, et al. Antioxidative properties of an extracellular polysaccharide produced by a bacteriumKlebsiellasp. isolated from river water[J]. Nippon Suisan Gakkaishi, 1996, 62(1): 123-128.
Production process of microbial surfactants and its application in food additives
SUNMao-cheng1CHENXi2LIHuai-wei3WANGDan1FUXiao-yi1WANGShu-ran1
(1.DepartmentofFoodQualityandSafety,JilinMedicalUniversity,Jilin,Jilin132013,China;2.GuizhouInstituteofIntegratedAgricultureDevelopment,Guiyang,Guizhou550006,China;3.HezeCenterforFoodandDrugControl,Heze,Shandong274000,China)
Microorganisms can synthesize a wide range of surface-active compounds with high ability to reduce surface and interfacial surface tension, generally called microbial surfactants. Major types, sources, screening of producing strain, the use of cheap substrates, optimization of fermentation process, separation and purification on microbial surfactants and its application in food additives were reviewed. Finally, present problems during the research were discussed. This study can provide theoretical basis for the industrial production and application of microbial surfactants in food industry.
microbial surfactants; production and optimisation; food emulsifiers; preservative; antioxidant agents

國家自然科學基金面上項目(編號:81472964);吉林省衛生計生自籌經費項目(編號:2014zc064)
孫茂成,男,吉林醫藥學院講師。
王舒然(1968-),男,吉林醫藥學院教授,博士。
E-mail:shuranwang@163.com
2015-07-10
10.13652/j.issn.1003-5788.2016.10.045

