PNPLA3基因I148M多態性對肝癌細胞HepG2細胞周期及Cyclin D1、p53表達的影響
韓利蓉,宋江勤,郭飛波
(天門市第一人民醫院,湖北天門431700)
?
PNPLA3基因I148M多態性對肝癌細胞HepG2細胞周期及Cyclin D1、p53表達的影響
韓利蓉,宋江勤,郭飛波
(天門市第一人民醫院,湖北天門431700)
目的 探討含patatin樣磷脂酶域蛋白3(PNPLA3)基因I148M多態性對肝癌細胞HepG2細胞周期及Cyclin D1、p53表達的影響。方法 構建PNPLA3基因I148M突變型(突變組)、PNPLA3基因I148M野生型(野生組)的肝癌細胞HepG2,以空載體細胞作為對照組,采用流式細胞儀檢測各組細胞周期,Western blotting、熒光定量PCR技術檢測各組細胞Cyclin D1、p53蛋白及mRNA表達。結果 突變組G1期細胞所占比例明顯低于野生組和對照組,S、G2/M期細胞所占比例明顯高于野生組和對照組(P均<0.05);野生組與對照組G1、S、G2/M期細胞所占比例比較差異均無統計學意義(P均>0.05)。三組間Cyclin D1蛋白及mRNA相對表達量比較差異均無統計學意義(P均>0.05),突變組p53蛋白及mRNA相對表達量顯著高于野生組和對照組(P均<0.05),而野生組和對照組比較差異均無統計學意義(P均>0.05)。結論 PNPLA3基因I148M多態性能夠誘導p53過表達,導致肝細胞周期紊亂,最終發展成肝癌細胞。
肝癌;含patatin樣磷脂酶域蛋白3;基因多態性;細胞周期;細胞周期蛋白D1;p53
國內外研究均證實,細胞周期阻滯與腫瘤的發生、發展密切相關[1,2]。含patatin樣磷脂酶域蛋白3(PNPLA3)屬于PNPLA家族成員之一,與傳統激素敏感性脂肪酶相比,PNPLA家族成員N末端均有一個patatin區域,使得其在體內外均具有脂肪合成和分解功能,被認為是調節肝臟脂肪代謝的主要基因之一[3~6]。Rametta等[7]對人類染色體上PNPLA3基因分析發現,I148M多態性位點與肝臟脂肪含量升高有關。Hoekstra等[8]研究亦證實,PNPLA3基因I148M多態性與肝纖維化有關,且是肝癌發生的獨立危險因素。由于脂肪代謝紊亂是多種肝病甚至肝癌的發病基礎,推測PNPLA3基因I148M多態性可能與肝癌的發生、發展有關。2014年7月~2015年4月,我們觀察了PNPLA3基因I148M多態性對人肝癌細胞HepG2細胞周期及Cyclin D1、p53表達的影響。現分析結果并報告如下。
1 材料與方法
1.1 材料 人肝癌細胞株HepG2和PNPLA3基因I148M突變型、PNPLA3基因I148M野生型、空載質粒轉染的腺病毒,均購自上海士鋒生物科技有限公司;RNA提取試劑盒、熒光定量PCR試劑盒,購自美國賽默飛世爾科技公司;蛋白裂解液、苯甲基磺酰氟(PMSF)、聚偏二氟乙烯(PVDF)膜、SDS-PAGE電泳分離蛋白均購自武漢博士德生物工程有限公司;β-actin抗體、辣根過氧化酶標記的二抗(羊抗鼠IgG抗體)、Cyclin D1單克隆抗體、p53單克隆抗體均購自美國圣克魯斯生物技術公司;Cyclin D1、p53、β-actin引物由美國金斯瑞生物科技有限公司設計。ABI GeneAmp 9700 PCR儀、Odyssey成像系統及圖像分析軟件購自美國LI-COR公司。
1.2 細胞培養及腺病毒轉染 取人肝癌細胞株HepG2置于DMEM培養液中,37 ℃、5% CO2細胞培養箱內培養。培養3天,待細胞融合≥80%時,加入0.25%胰蛋白酶0.5 mL消化,吸棄舊培養液,PBS洗滌3次,輕拍培養瓶使細胞自瓶壁脫落,混勻后加入新鮮培養基傳代培養。取第4代對數生長期HepG2細胞,接種于6孔板中,每孔約2×105個,每孔設3個復孔。胰蛋白酶-EDTA消化后,加入RPMI 1640培養液,CO2培養箱中孵育12 h,分別加入含有PNPLA3基因I148M突變型腺病毒(突變組)、PNPLA3基因I148M野生型腺病毒(野生組)和空載質粒轉染的腺病毒(對照組)3×107IU。轉染24 h,加入聚凝胺使培養體系終濃度為6 mg/L,繼續培養48 h,倒置熒光顯微鏡下觀察并計算細胞轉染效率。以倒置熒光顯微鏡下發現綠色熒光作為轉染成功的標志。
1.3 細胞周期檢測 取對數生長期HepG2細胞,PBS沖洗2次,移液槍吹打成細胞懸液并置于離心管中,室溫下1 000 r/min離心10 min,PBS沖洗5 min×3次;滴加中性乙醇1 mL,4 ℃固定過夜。24 h后,室溫下1 000 r/min離心10 min,PBS沖洗5 min×3次,吹打或細胞成懸液,加入適量碘化丙啶(PI,預先用PBS配制成1 mg/mL)和RNase,使其終濃度為50 mg/L,置于水浴鍋上37 ℃溫浴45 min。采用流式細胞儀檢測細胞周期,每次5×104個細胞。重復檢測3次,取平均值。
1.4 PNPLA3、Cyclin D1、p53蛋白檢測 采用Western blotting技術。取對數生長期HepG2細胞,接種于6孔板,每孔加入含1% PMSF的細胞裂解液100 μL,待細胞完全裂解后,15 000 r/min離心5 min,留取上清液。將上清液移至EP管中,加入等量上樣液,100 ℃煮沸5 min,使蛋白完全變性。SDS-PAGE電泳分離蛋白,并轉移至PVDF膜上,100 mA、40 min電轉后將PVDF膜取出。5%脫脂牛奶封閉2 h,加入1∶2 000稀釋的PNPLA3單克隆抗體、1∶1 000稀釋的Cyclin D1單克隆抗體和1∶500稀釋的p53單克隆抗體,4 ℃孵育過夜;PBS沖洗3次,加入1∶10 000稀釋的二抗,室溫下震蕩3 h,PBS沖洗3次;熒光圖像掃描及條帶灰度值分析。PNPLA3、Cyclin D1、p53蛋白相對表對量為樣本條帶與β-actin條帶灰度值之比。
1.5 PNPLA3、Cyclin D1、p53 mRNA檢測 采用熒光定量PCR技術。取對數生長期HepG2細胞,按照RNA提取試劑盒說明書提取細胞總RNA,并逆轉錄成cDNA。PCR擴增:PNPLA3上游引物:5′-CGGAAGACTGTGTCGAGCAA-3′,下游引物:5′-GGATCAAGCGCACTGTGGA-3′;Cyclin D1上游引物:5′-CCGTGTGCTAGCATAGCGC-3′,下游引物:5′-TGCTGGTCAATGTGGCTA-3′;p53上游引物: 5′-GACGTT-
CGGTGTCAGTCTGCC-3′,下游引物:5′-TGGCTGCGACTACATTAGGAC-3′;β-actin上游引物:5′-GTGCATGCTCGGCTGCGTCT-3′,下游引物:5′-GGTCTGAGGTTCAGCGTTGC-3′。PNPLA3擴增條件:96 ℃預變性1 min,95 ℃變性60 s,60 ℃退火30 s,72 ℃延伸60 s,35個循環后72 ℃延伸10 min;Cyclin D1擴增條件:95 ℃預變性5 min,95 ℃變性30 s,65 ℃退火45 s,72 ℃延伸1 min,40個循環后72 ℃延伸5 min。p53擴增條件:95 ℃預變性5 min,95 ℃變性15 s,65 ℃退火30 s,72 ℃延伸30 s,45個循環后72 ℃延伸5 min。記錄各檢測指標的CT值,重復檢測3次,取平均值。以β-actin為內參,采用2-ΔΔCT法計算PNPLA3、Cyclin D1、p53 mRNA相對表達量。
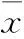
2 結果
2.1 腺病毒轉染HepG2細胞情況 攜帶不同基因型的腺病毒轉染HepG2細胞48 h,倒置熒光顯微鏡下觀察綠色熒光蛋白陽性表達率均高達90%,說明表達目的基因的細胞株構建成功。見插頁Ⅲ圖9。
2.2 各組細胞周期分布比較 見表1。
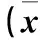
表1 各組細胞周期分布比較±s)
注:與對照組比較,*P<0.05;與野生組比較,#P<0.05。
2.3 各組PNPLA3、Cyclin D1、p53蛋白及mRNA表達比較 見表2。

表2 各組PNPLA3、Cyclin D1、p53蛋白及mRNA相對表達量比較
注:與對照組比較,*P<0.05;與野生組比較,#P<0.05。
3 討論
PNPLA3基因屬于patatin樣磷脂酶家族成員,具有非特異性水解酶的活性。PNPLA3基因多態性與人類非酒精性脂肪肝的遺傳易感性密切相關。近年研究顯示,PNPLA3基因多態性與多種肝臟疾病密切相關,其中I148M位點的多態性與肝臟脂肪含量顯著升高有關[9]。由于這種脂肪升高不受遺傳、體質量、原發病和乙醇攝入的影響,故有學者認為PNPLA3基因I148M多態性可能是導致肝臟病變的主要原因[10]。國外研究證實,PNPLA3基因I148M多態性不僅會增加肝臟脂肪含量,而且與肝臟組織學病變有關[11]。Pirazzi等[12]研究發現,PNPLA3基因I148M多態性與肝纖維化有關,并可能參與了肝細胞癌的發生。關于PNPLA3基因I148M多態性誘導肝臟病變的機制目前尚不清楚,但可以肯定的是與脂肪代謝有關。Burza等[13]研究發現,PNPLA3蛋白能夠水解TG,其I148M位點多態性會導致水解酶的活性喪失,證實I148M多態性可能通過抑制PNPLA3的活性而導致TG分解受阻,而TG蓄積極易導致肝臟脂肪含量增加。對PNPLA3蛋白三維結構解析發現,其148位點氨基酸更換并未改變活性中心和空間結構,而是蛋氨酸的側臂遮蓋了活性中心與底物的結構,從而導致酶對TG水解活性降低[14]。但Valenti等[15]對小鼠PNPLA3基因敲除后并未獲得小鼠脂肪肝模型,也未對小鼠體內TG的代謝造成影響。上述研究結果均提示PNPLA3基因I148M多態性對肝臟病變的影響作用機制較為復雜,需要深入研究。
細胞周期紊亂會導致細胞能量和物質代謝異常,最終引起細胞惡變[16,17]。Romeo等[18]認為,肝癌細胞周期明顯異常,鉑類等抗腫瘤藥物的主要作用機制就是改變腫瘤細胞周期,誘導細胞發生凋亡。細胞周期主要有G1、S、G2、M期,其中G1/S期和G2/M期在維持細胞周期運轉方面最為重要。當細胞通過G1/S期和G2/M期后,則無需依賴外界的分裂信號,能獨立完成細胞周期[19]。因此G1/S期和G2/M期被認為是調控細胞周期的關鍵時期。Cyclin D1、p53均屬于細胞周期調節蛋白,Cyclin D1是由人類CCND1基因所編碼的一類蛋白質,其可通過結合并激活G1期特有的周期蛋白依賴性激酶CDK4,磷酸化G1期周期抑制蛋白(Rb),而磷酸化的Rb從其所結合的E2F轉錄因子上解離,從而推動細胞周期由G1期進入到S期。p53基因是細胞生長周期中的負調節因子,與細胞周期的調控、DNA修復、細胞分化、細胞凋亡等生物學功能有關。Cyclin D1、p53是參與調節G1/S期、G2/M期最主要的蛋白,Cyclin D1、p53表達失調與惡性腫瘤的發生、發展密切相關。Valenti等[20]研究證實,肝癌組織Cyclin D1、p53蛋白表達顯著高于癌旁正常組織,隨著治療的好轉,肝癌組織Cyclin D1、p53蛋白表達量逐漸降低。本研究結果顯示,突變組p53 mRNA及蛋白表達量均高于野生組和對照組,提示PNPLA3基因多態性可能通過影響肝癌細胞p53表達,達到調節細胞周期的作用。本研究還發現,突變組G1期細胞所占比例低于野生組和對照組,S、G2/M期細胞所占比例高于野生組和對照組,提示I148M多態性可能與細胞周期紊亂有關。Sookoian等[21]研究證實,肝細胞周期加速后會導致細胞內能量代謝異常,并促進肝癌細胞的生長,且細胞周期的加速與肝癌細胞的惡性程度密切相關。本研究發現,突變組p53 mRNA蛋白相對表達量高于野生組和對照組,而三組細胞Cyclin D1蛋白和mRNA相對表達量比較差異均無統計學意義,提示PNPLA3基因I148M多態性可能通過上調p53表達而導致細胞周期紊亂,并促使其向肝癌發展。
綜上所述,PNPLA3基因I148M多態性能夠誘導p53過表達,導致肝細胞周期紊亂,最終發展為肝癌細胞。
[1] 詹啟敏,陳杰.細胞周期與腫瘤轉化醫學[J].中國腫瘤臨床,2014,41(1):1-7.
[2] Kitagawa M, Niisato N, Shiozaki A, et al. A regulatory role of K(+)-Cl(-) cotransporter in the cell cycle progression of breast cancer MDA-MB-231 cells[J]. Arch Biochem Biophys, 2013,539(1):92-98.
[3] Huang Y, He S, Li JZ, et al. A feed-forward loop amplifies nutritional regulation of PNPLA3[J]. Proc Natl Acad Sci U S A, 2010,107(17):7892-7897.
[4] He S, McPhaul C, Li JZ, et al. A sequence variation (I148M) in PNPLA3 associated with nonalcoholic fatty liver disease disrupts triglyceride hydrolysis[J]. J Biol Chem, 2010,285(9):6706-6715.
[5] Valenti L, Alisi A, Nobili V. Unraveling the genetics of fatty liver in obese children: additive effect of P446L GCKR and I148M PNPLA3 polymorphisms[J]. Hepatology, 2012,55(3):661-663.
[6] Zampino R, Coppola N, Cirillo G, et al. Abdominal fat interacts with PNPLA3 I148M, but not with the APOC3 variant in the pathogenesis of liver steatosis in chronic hepatitis C[J]. J Viral Hepat, 2013,20(8):517-523.
[7] Rametta R, Ruscica M, Dongiovanni P, et al. Hepatic steatosis and PNPLA3 I148M variant are associated with serum Fetuin-A independently of insulin resistance[J]. Eur J Clin Invest, 2014,44(7):627-633.
[8] Hoekstra M, Li Z, Kruijt JK, et al. The expression level of non-alcoholic fatty liver disease-related gene PNPLA3 in hepatocytes is highly influenced by hepatic lipid status[J]. J Hepatol, 2010,52(2):244-251.
[9] Pingitore P, Pirazzi C, Mancina RM, et al. Recombinant PNPLA3 protein shows triglyceride hydrolase activity and its I148M mutation results in loss of function[J]. Biochim Biophys Acta, 2014,1841(4):574-580.
[10] Larrieta-Carrasco E, Acua-Alonzo V, Velázquez-Cruz R, et al. PNPLA3 I148M polymorphism is associated with elevated alanine transaminase levels in Mexican Indigenous and Mestizo populations[J]. Mol Biol Rep, 2014,41(7):4705-4711.
[11] Zampino R, Florio A, Coppola N, et al. PNPLA3 I148M variant as a risk factor for carotid atherosclerosis in chronic hepatitis C[J]. Int J Cardiol, 2014,172(1):291-292.
[12] Pirazzi C, Adiels M, Burza MA, et al. Patatin-like phospholipase domain-containing 3 (PNPLA3) I148M (rs738409) affects hepatic VLDL secretion in humans and in vitro[J]. J Hepatol, 2012,57(6):1276-1282.
[13] Burza MA, Pirazzi C, Maglio C, et al. PNPLA3 I148M (rs738409) genetic variant is associated with hepatocellular carcinoma in obese individuals[J]. Dig Liver Dis, 2012,44(12):1037-1041.
[14] Nobili V, Bedogni G, Donati B, et al. The I148M variant of PNPLA3 reduces the response to docosahexaenoic acid in children with non-Alcoholic fatty liver disease[J]. J Med Food, 2013,16(10):957-960.
[15] Valenti L, Dongiovanni P, Ginanni Corradini S, et al. PNPLA3 I148M variant and hepatocellular carcinoma: a common genetic variant for a rare disease[J]. Dig Liver Dis, 2013,45(8):619-624.
[16] 周玨宇,石嶸,鄭文嶺,等.microRNA與腫瘤細胞周期的關系及其研究方法進展[J].基礎醫學與臨床,2013,33(1):9-14.
[17] 李維妙,夏靖華,馮征,等.腫瘤高表達細胞周期相關蛋白在非小細胞肺癌中的表達及臨床意義[J].細胞與分子免疫學雜志,2015,31(5):668-671.
[18] Romeo S, Sentinelli F, Dash S, et al. Morbid obesity exposes the association between PNPLA3 I148M (rs738409) and indices of hepatic injury in individuals of European descent[J]. Int J Obes (Lond), 2010,34(1):190-194.
[19] Valenti L, Nobili V, Al-Serri A, et al. The APOC3 T-455C and C-482T promoter region polymorphisms are not associated with the severity of liver damage independently of PNPLA3 I148M genotype in patients with nonalcoholic fatty liver[J]. J Hepatol, 2011,55(6):1409-1414.
[20] Valenti L, Colombo M, Fargion S. Modulation of the effect of PNPLA3 I148M mutation on steatosis and liver damage by alcohol intake in patients with chronic hepatitis C[J]. J Hepatol, 2011,55(6):1471-1472.
[21] Sookoian S, Pirola CJ. Meta-analysis of the influence of I148M variant of patatin-like phospholipase domain containing 3 gene (PNPLA3) on the susceptibility and histological severity of nonalcoholic fatty liver disease[J]. Hepatology, 2011,53(6):1883-1894.
10.3969/j.issn.1002-266X.2016.40.019
R735.7
B
1002-266X(2016)40-0058-04
2016-05-26)

