RNAi沉默Rac1基因對結腸癌細胞增殖及裸鼠成瘤的影響
解娜,黃幼生,羅志飛,薛逢貴
(1 海南醫學院附屬醫院,海口571101;2 海南醫學院)
?
·論著·
RNAi沉默Rac1基因對結腸癌細胞增殖及裸鼠成瘤的影響
解娜1,2,黃幼生1,2,羅志飛1,2,薛逢貴1
(1 海南醫學院附屬醫院,海口571101;2 海南醫學院)
目的 探討RNAi沉默Rac1基因對結腸癌細胞增殖及裸鼠成瘤的影響。方法 ①細胞實驗:體外培養結腸癌細胞SW480,隨機分為空白對照組、陰性對照組、shRNA-Rac1組,陰性對照組、shRNA-Rac1組分別轉染空載質粒慢病毒、shRNA-Rac1慢病毒。采用RT-PCR技術、Western blotting法檢測各組Rac1 mRNA及其蛋白表達;采用MTT法檢測各組轉染24、48、72、96 h的細胞增殖情況。②動物實驗:取shRNA-Rac1組、陰性對照組轉染后細胞分別接種于裸鼠皮下,建立結腸癌裸鼠移植瘤模型(分別記為觀察組、對照組),觀察裸鼠成瘤及移植瘤生長情況,喂養35天脫臼處死,完整剝離腫瘤組織,稱取瘤體質量并測量腫瘤體積。同時檢測瘤體Rac1蛋白表達情況。結果 ①細胞實驗:與陰性對照組比較,shRNA-Rac1組Rac1 mRNA及其蛋白表達明顯降低(P均<0.05);與陰性對照組比較,shRNA-Rac1組各時間點細胞增殖速度明顯降低(P均<0.05)。②動物實驗:對照組癌細胞接種4~8天均可見瘤體形成,觀察組接種35天僅2只成瘤,且瘤體形成時間較對照組晚10天。接種35天,觀察組、對照組瘤體體積分別為(32.54±43.13)、(948.13±523.50)mm3,瘤體質量分別為(0.023±0.031)、(0.873±0.372)g,兩組比較P均<0.01。與對照組比較,觀察組瘤體組織Rac1蛋白陽性表達率明顯降低(P<0.05)。結論 抑制Rac1表達能降低結腸癌細胞增殖速度,抑制裸鼠移植瘤生長。
結腸癌;Rac1;RNA干擾;裸鼠成瘤;細胞增殖
結腸癌是臨床常見的惡性腫瘤之一,在我國其病死率居所有惡性腫瘤的第五位,復發和轉移是患者死亡的主要原因[1,2]。Rac1是Rac亞家族的一個重要成員,是細胞內重要的信號轉導分子。近年研究發現,Rac1在人類大部分侵襲性腫瘤中高表達,如胃癌、乳腺癌、肺癌等[3~8],并與腫瘤的侵襲和轉移可能有關[4,9]。本課題組前期研究發現,抑癌劑二烯丙基二硫(DADS)處理結腸癌細胞HT-29后,Rac1 mRNA轉錄水平下調[10,11],但在動物實驗中未發現Rac1表達與結腸癌細胞增殖有關。2014年6月~2015年2月,本研究應用RNAi技術沉默Rac1基因,觀察Rac1基因沉默對人結腸癌細胞增殖及裸鼠成瘤的影響,旨在探究結腸癌發生、發展的分子機制。
1 材料與方法
1.1 材料 人結腸癌細胞株SW480購自中國科學院上海細胞研究所;GV148-Rac1-shRNA慢病毒質粒連接及慢病毒包裝由上海吉凱基因化學技術有限公司完成,shRNA-Rac1干擾序列為5′-CCTTCTTAACATCACTGTCTT-3′。雌性BALB/c裸鼠20只,5周齡,體質量(20±2)g,購自上海斯萊克實驗動物有限責任公司。DMEM、FBS購自美國Gibco公司。TRIzol購自美國Invitrogen公司。逆轉錄試劑盒FastQuant RT Kit (With gDNase)、熒光定量PCR試劑盒Quant qRT-PCR kit(SYBR Green)購自北京天根生化科技有限公司。Rac1、GAPDH引物由上海生工生物工程股份有限公司合成;RIPA蛋白裂解液、ECL Plus、PMSF及BCA蛋白定量試劑盒購自上海碧云天生物技術有限公司。兔抗人Rac1、GAPDH單克隆抗體、羊抗兔二抗購自美國Abcam公司;SPV-9000通用型二步法免疫組化檢測試劑盒購自福州邁新生物技術開發有限公司。
1.2 細胞實驗
1.2.1 慢病毒轉染 37 ℃、50 mL/L CO2飽和濕度培養箱中培養結腸癌細胞SW480,培養基為含雙抗及10%小牛血清的DMEM,待細胞融合度達80%且處于對數生長期時胰酶消化、吹打,制成2.5×104個/mL的細胞懸液并接種于6孔板,每孔2 mL。隨機將細胞分為shRNA-Rac1組、陰性對照組及空白對照組。待細胞處于對數生長期、融合度達30%時,shRNA-Rac1組、陰性對照組分別轉染shRNA-Rac1慢病毒、空載質粒慢病毒。在1 mL無血清及抗菌藥物的培養基中加入2×106TU目標或陰性控制病毒、5 ng Polybrene,混勻后分別轉染shRNA-Rac1組及陰性對照組,2~3天于倒置熒光顯微鏡下觀察細胞轉染情況。轉染48 h,每孔加入1 μg/mL的嘌呤霉素篩選穩定轉染細胞,繼續培養48 h,更換常規培養基培養。當細胞處于對數生長期且融合度達80%時收集細胞,進行下一步干擾抑制效率檢測及裸鼠成瘤實驗。
1.2.2 Rac1 mRNA干擾效率檢測 采用RT-PCR技術。按TRIzol試劑盒說明提取各組細胞總RNA[12],瓊脂糖凝膠電泳及分光光度計分別檢測RNA純度及濃度。取各組細胞總RNA 0.5 μg,按FastQuant RT Kit說明書進行逆轉錄。Rac1及內參GAPDH引物由Primerprimer6.0軟件進行設計。Rac1上游引物5′-ATGTCCGTGCAAAGTGGTATC-3′,下游引物5′-CTCGGATCGCTTCGTCAAACA-3′;GAPDH上游引物5′-GCCAAAAGGGTCATCATCTC-3′,下游引物5′-GTAGAGGCAGGGATGATGTTC-3′。根據Quant qRT-PCR kit (SYBR Green)說明書設置反應體系及反應條件,反應體系共20 μL:SYBR 10 μL,上下游引物各0.4 U、cDNA 2 μL、ddH2O 7.2 μL。反應條件:95 ℃預變性2 min,95 ℃變性20 s,60 ℃退火30 s,共40個循環。每組設計3個重復孔,采用2-ΔΔCt法計算Rac1 mRNA相對表達量。ΔCt=目的基因Ct平均值-內參照Ct平均值,ΔΔCt=ΔCtshRNA-Rac1組-ΔCt陰性對照組。所有反應程序、參數及Ct值均由ABI AVIIL熒光定量PCR儀完成。
1.2.3 Rac1蛋白抑制效率檢測 采用Western blotting法。RIPA(含1 mmol/L)提取各組細胞總蛋白,BCA法定量后,加上樣緩沖液100 ℃變性,-20 ℃保存。蛋白變性后每孔上樣30 μg,經12% SDS-PAGE膠電泳,100 mA電流條件下60 min轉至PVDF膜,5%脫脂牛奶常溫封閉2 h,Rac1(1∶200)和GAPDH(1∶1 000)一抗4 ℃孵育過夜;次日TBST洗膜3遍,加入羊抗兔二抗(1∶5 000)常溫孵育1.5 h,TBST洗滌3遍,ECL底物顯色,獲取圖像,并對條帶灰度值進行分析。
1.2.4 細胞增殖情況觀察 采用MTT法。具體操作按文獻[11]進行。將各組結腸癌細胞接種于96孔板,每組設3個復孔,每孔初始接種細胞2×103個,置37 ℃、50 mL/L CO2恒溫箱中孵育。分別于貼壁后24、48、72、96 h加入200 μL MTT溶液(5 mg/mL),繼續培養4 h,去上清液,每孔加入100 μL二甲基亞砜,置搖床上低速振蕩15 min,使結晶物充分溶解。用Tecan Infinite M1000 PRO多功能酶標儀于480 nm處檢測各孔的光密度(OD)值。以時間為橫坐標,OD值為縱坐標,繪制細胞增殖曲線。
1.3 動物實驗
1.3.1 裸鼠移植瘤模型構建 將20只裸鼠隨機分為觀察組、對照組,每組10只。待shRNA-Rac1組及陰性對照組細胞融合達80%且處于對數生長期時,胰酶消化、吹打,1 500 r/min離心3 min,移除上清液,PBS清洗2遍,生理鹽水重懸細胞,臺盼藍計數后稀釋成2×107個/mL的細胞懸液,分別接種于兩組裸鼠右腋下0.5 cm處,每只裸鼠接種0.2 mL。接種后的裸鼠在SPF級動物房中飼養,每隔1天觀察并記錄瘤體大小,包括瘤體長短徑,稱量裸鼠體質量,建立生長曲線。喂養35天脫臼處死,完整剝離腫瘤組織,稱取瘤體質量并測量腫瘤體積。
1.3.2 裸鼠瘤體Rac1表達檢測 各組瘤體于10%中性甲醛固定,常規石蠟包埋,4 μm厚連續切片。切片經二甲苯脫蠟、逐步水化、30% H2O2封閉,枸櫞酸(pH 6.0)高壓修復10 min,一抗37 ℃ 1 h,PBS洗滌3遍,二抗37 ℃孵育20 min,DAB顯色至陽性對照片清晰著色,蘇木素襯染1 min。結果判定參照文獻[13]:陽性染色定位于細胞質,呈棕褐色顆粒狀;以細胞質無著色為-,微弱著色為+,中等強度著色為++,棕黃色為+++;以-、+為低表達,++、+++為高表達。連續計數3個高倍鏡視野(×400),每個視野連續計數200個癌細胞,觀察Rac1蛋白陽性表達情況。
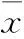
2 結果
2.1 細胞實驗結果
2.1.1 RNAi沉默Rac1基因表達效率 轉染48 h,倒置熒光顯微鏡下可見,shRNA-Rac1組及陰性對照組90%以上細胞表面出現綠色熒光。空白對照組Rac1 mRNA及其蛋白的相對表達量分別為1.13±0.13、0.92±0.05,陰性對照組分別為1.01±0.12、0.84±0.04,shRNA-Rac1組分別為0.33±0.01、0.29±0.06。與陰性對照組比較,shRNA-Rac1組Rac1 mRNA及其蛋白表達明顯受到抑制(P均<0.05),其mRNA抑制率達67.3%,蛋白抑制率為65.5%,可進行下一步實驗。
2.1.2 Rac1基因表達沉默對SW480細胞增殖的影響 驗證LV-shRNA-Rac1具有顯著抑制Rac1表達效率后,應用MTT法檢測轉染不同時間SW480細胞增殖情況。結果見表1。
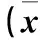
表1 各組轉染不同時間SW480細胞增殖比較±s)
注:與空白對照組、陰性對照組比較,*P<0.05。
2.2 動物實驗結果
2.2.1 裸鼠移植瘤生長情況 對照組接種第4~8天肉眼均可見瘤體形成,而觀察組接種35天內僅2只裸鼠成瘤,且瘤體形成時間較對照組晚10天。瘤體表現為接種部位出現皮下小結節,初始為橢圓形,逐漸長大,最終呈現不規則、凹凸分葉狀。接種5周后,觀察組、對照組瘤體體積分別為(32.54±43.13)、(948.13±523.50)mm3,瘤體質量分別為(0.023±0.031)、(0.873±0.372)g,兩組比較P均<0.01。
2.2.2 兩組瘤體組織Rac1蛋白陽性表達比較 見插頁Ⅰ圖1。觀察組瘤體組織Rac1蛋白陽性表達率為12.1%,對照組為90.2%,兩組比較P<0.05。
3 討論
腫瘤血管生成是惡性腫瘤發生轉移的重要機制之一,血管生成的基礎過程涉及細胞移動、基因表達活性改變及復雜的信號網絡調節。Rac1是GTPases Rho家族的重要成員之一,基因全長29 kb,包含7個外顯子,位于人染色體7p22。Rac1基因的轉錄產物有1.2、2.5 kb兩種,是細胞內重要的信號轉導分子。Rac1過表達能促進腫瘤細胞血管生成及遷移能力,從而促進腫瘤細胞的侵襲、轉移[3,4]。目前對Rac1調節腫瘤轉移的機制尚不完全清楚,可能與以下機制有關:①刺激新的肌動蛋白聚合,通過活化靶蛋白Scar/Wave激活Arp2/3復合體,該復合體是一種肌動蛋白相關蛋白,能刺激肌動蛋白單體的成核作用,從而導致新的肌動蛋白絲形成,加快細胞移動[3,13]。②通過調節CDC42、干擾素、VEGF等因子的表達促進腫瘤血管的形成,繼而導致腫瘤細胞轉移[3];③通過下游分子Pak1激活Limk1,調節Cofilin活動。Rac1和Cdc42可間接活化Limk1,上調尿激酶型纖維蛋白酶原激活劑(uPA),增強uPA啟動子活性,誘導uPA和uPA受體表達及uPA的分泌,降解細胞外基質,促進癌細胞的侵襲和轉移[14,15]。④Rac1能抑制TGF-β誘導的p38 MAPK磷酸化,通過NOXs-ROS通路激活NF-κB,調節uPA和基質金屬蛋白酶9,活化核轉錄因子Snail誘導上皮間質轉化,促腫瘤侵襲的轉移[3,16]。
有研究報道,結腸癌細胞中Rac1陽性表達明顯升高,并與結腸癌的浸潤和轉移有一定相關性。其促進結腸癌浸潤和轉移的機制可能與CDC42、smad4、ERK/JNK等信號的激活,繼而促進上皮間質轉化有關[17,18]。本課題組前期研究發現,抗癌劑DADS能抑制結腸癌細胞Rac1的表達,可能涉及細胞周期及凋亡調控[11,12]。但沉默Rac1表達對結腸癌細胞增殖及腫瘤形成能力的影響目前尚不清楚。
有研究顯示,Rac1抑制劑NSC23766、EHT 1864等處理腫瘤細胞后,腫瘤細胞增殖速度降低[3,4]。本研究結果顯示,慢病毒介導shRNA-Rac1轉染結腸癌細胞后,能抑制Rac1基因mRNA及其蛋白表達,且其細胞增殖速度明顯降低,與以往研究[3,4,11,18]結果基本一致。表明Rac1過表達可能參與結腸癌細胞惡性演進的生物學過程。本研究還發現,對照組均于接種第4~8天出現肉眼可見的瘤體,而觀察組僅2只于接種2周后有瘤體形成;觀察組移植瘤生長速度、腫瘤體積和質量均明顯低于對照組,移植瘤組織中Rac1 mRNA及其蛋白表達均低于對照組,與其在細胞水平上的表達一致。證實在裸鼠瘤體內shRNA-Rac1對Rac1 mRNA及其蛋白表達均有抑制作用。提示沉默Rac1基因表達能抑制結腸癌細胞增殖,遏制結腸癌細胞裸鼠移植瘤形成。
綜上所述,以慢病毒介導的Rac1基因沉默能抑制結腸癌細胞增殖及裸鼠移植瘤的生長;Rac1表達變化可能與結腸癌的發生、發展有關,有可能作為結腸癌潛在的治療靶點。
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] 李德銯,吳春曉,鄭瑩,等.上海市2003~2007年大腸癌發病率和死亡率分析[J].中國腫瘤, 2011,20(6):413-418.
[3] Bid HK, Roberts RD, Manchanda PK, et al. RAC1: an emerging therapeutic option for targeting cancer angiogenesis and metastasis[J]. Mol Cancer Ther, 2013,12(10):1925-1934.
[4] Kagawa Y, Matsumoto S, Kamioka Y, et al. Cell cycle-dependent Rho GTPase activity dynamically regulates cancer cell motility and invasion in vivo[J]. PLoS One, 2013,8(12):e83629.
[5] Ji J, Feng X, Shi M, et al. Rac1 is correlated with aggressiveness and a potential therapeutic target for gastric cancer[J]. Int J Oncol, 2015,46(3):1343-1353.
[6] Rozenchan PB, Pasini FS, Roela RA, et al. Specific upregulation of RHOA and RAC1 in cancer-associated fibroblasts found at primary tumor and lymph node metastatic sites in breast cancer[J]. Tumour Biol, 2015,36(12):9589-9597.
[7] Gastonguay A, Berg T, Hauser AD, et al. The role of Rac1 in the regulation of NF-κB activity, cell proliferation, and cell migration in non-small cell lung carcinoma[J]. Cancer Biol Ther, 2012,13(8):647-656.
[8] Silva AL, Carmo F, Bugalho MJ. RAC1b overexpression in papillary thyroid carcinoma: a role to unravel[J]. Eur J Endocrinol, 2013,168(6):795-804.
[9] Lawson CD, Burridge K. The on-off relationship of Rho and Rac during integrin-mediated adhesion and cell migration[J]. Small GTPases, 2014(5):e27958.
[10] Huang YS, Xie N, Su Q, et al. Diallyl disulfide inhibits the proliferation of HT-29 human colon cancer cells by inducing differentially expressed genes[J]. Mol Med Rep, 2011,4(3):553-559.
[11] Zhou Y, Su J, Shi L, et al. DADS downregulates the Rac1-ROCK1/PAK1-LIMK1-ADF/cofilin signaling pathway, inhibiting cell migration and invasion[J]. Oncol Rep, 2013,29(2):605-612.
[12] Abou-Kheir W, Isaac B, Yamaguchi H, et al. Membrane targeting of WAVE2 is not sufficient for WAVE2-dependent actin polymerization: a role for IRSp53 in mediating the interaction between Rac and WAVE2[J]. J Cell Sci, 2008,121(Pt 3):379-390.
[13] 解娜,黃幼生,羅志飛,等.YWHAE對結腸癌細胞增殖的影響及表達意義[J].世界華人消化雜志,2015,23(29):4643-4651.
[14] Oleinik NV, Helke KL, Kistner-Griffin E, et al. Rho GTPases RhoA and Rac1 mediate effects of dietary folate on metastatic potential of A549 cancer cells through the control of cofilin phosphorylation[J]. J Biol Chem, 2014,289(38):26383-26394.
[15] Pratt SJ, Epple H, Ward M, et al. The LIM protein Ajuba influences p130Cas localization and Rac1 activity during cell migration[J]. J Cell Biol, 2005,168(5):813-824.
[16] Santibanez JF, Kocic J, Fabra A, et al. Rac1 modulates TGF β1-mediated epithelial cell plasticity and MMP9 production in transformed keratinocytes[J]. FEBS Lett, 2010,584(11):2305-2310.
[17] Andre S, Singh T, Lacal JC, et al. Rho GTPase Rac1: molecular switch within the galectin network and for N-glycan alpha2, 6-sialylation/O-glycan core 1 sialylation in colon cancer in vitro[J]. Folia Biol (Praha), 2014,60(3):95-107.
[18] Chahdi A, Raufman JP. The Cdc42/Rac nucleotide exchange factor protein β1Pix (Pak-interacting exchange factor) modulates β-catenin transcriptional activity in colon cancer cells: evidence for direct interaction of β1PIX with β-catenin[J]. J Biol Chem, 2013,288(47):34019-34029.
Effects of RNAi-mediated knockdown of Rac1 gene on growth and transplanted tumors of colon cancer SW480 cells in nude mice
XIENa1,HUANGYousheng,LUOZhifei,XUEFenggui
(1TheAffiliatedHospitalofHainanMedicalUniversity,Haikou571101,China)
Objective To investigate the effects of Rac1 gene silenced by RNA interference (RNAi) on cell proliferation and growth of subcutaneous tumor of colon cancer SW480 cells in nude mice. Methods ① Cell experiment: colon cancer SW480 cells cultured in vitro were randomly divided into the blank control group, negative control group, and shRNA-Rac1 group. Recombinant lentivirus virus vector (NC-shRNA and Rac1-shRNA) were constructed and were respectively transfected into negative control group and shRNA-Rac1 group. The expression levels of Rac1 mRNA and protein were measured by quantitative real-time polymerase chain reaction (qRT-PCR), and Western blotting, respectively. Cell proliferation at 24, 48, 72, and 96 h after transfection was determined by MTT. ② Animal experiment: cells from shRNA-Rac1 group and negative control group were planted into nude mice to establish mice models of colon cancer (observation group and control group). Formulation and growth of the tumor was observed. After the mice were sacrificed by cervical dislocation, tumor tissues were removed completely and we measured its weight and size. Meanwhile, Rac1expression was also detected by immunohistocytochemistry. Results ① cell experiment: Compared with the blank control group and negative control group, the expression of Rac1 mRNA and protein in the shRNA-Rac1 group decreased significantly (allP<0.05). The proliferation ability of colon cancer cells was significantly inhibited in the shRNA-Rac1 group at all detecting time points as compared with that of the control group (allP<0.05). ② Animal experiment: tumor was observed in all cases of the control group 4-8 days after the transplantation. While in the observation group, tumor was only observed in 2 cases 35 days after the transplantation, and it took 10 days longer to form a tumor than that in the control group. On the 35th day of transplantation, average volume of the tumor in the observation group and control group was (948.13±523.50) and (32.54±43.13) mm3, and the tumor average weight was respectively (0.873±0.372) and (0.023±0.031) g, and significant difference was found between the two groups (allP<0.01). Besides, compared with the control group, the expression rate of Rac1 in the observation group was significantly lower than that in the control group (P<0.01). Conclusion Silencing the expression of Rac1 decreases the proliferation of colon cancer cells SW480 and inhibits the tumor formation in nude mice.
colon cancer; Rac1; RNA interference; tumor growth in nude mice; cell proliferation
國家自然科學基金資助項目(81260321)。
解娜(1979-),女,講師,研究方向為腫瘤病因及發病機制。E-mail: xiena2005@163.com
簡介:黃幼生(1976-),男,副教授,研究方向為消化系統惡性腫瘤浸潤轉移機制。E-mail: hys768811@163.com
10.3969/j.issn.1002-266X.2016.40.001
R735.3
A
1002-266X(2016)40-0001-04
2016-01-22)

