熱生物學:測量細胞溫度
李升偉/編譯
熱生物學:測量細胞溫度
李升偉/編譯

●熒光技術和納米技術的發展,使得測量細胞的溫度成為可能,它被稱為“熱生物學(Thermal Biology)”,本文介紹了最近這方面的進展。
即使是最早的科學家們也知道,溫度是一種重要的生命體征,指示著人體的健康與疾病狀況。17世紀,意大利生理學家桑克托利沃·桑克托利烏斯(Sanctorio Sanctorius)發明了口腔溫度計來測量病人的體溫。現在,21世紀的科學家們面臨著一項新的、更具挑戰性的任務:測量單個細胞的溫度。
“溫度是一種調節生命的基本物理參數,它決定著發生在生命系統內部所有種類的過程的速度。”米哈伊爾·盧金(Mikhail Lukin)說,他是哈佛大學的物理學家,并且已經研發了一種用金剛石作材料的細胞內溫度傳感器。
然而,盡管溫度是一種基本的生命體征,科學家們對于細胞之間和細胞之內溫度的變化范圍還是知之甚少的。盧金說:“很顯然,要可靠地測量細胞內的溫度不是一件容易的事,你不可能既把一支尺寸與細胞相比十分龐大的溫度計放進細胞內部,又保持細胞的存活。”
但是,在過去五年中,研究人員們已經運用納米技術制造出了微型化的溫度計,可以揭示出不同細胞之間和同種細胞內不同部位間的溫度差別。“這個領域的研發到目前為止,我已經(用微型化溫度計)鑒定大約2 010個細胞。”葡萄牙阿維羅大學的物理學家路易斯·卡洛斯(Luís Carlos)說道。他正在試驗用“相對過熱”來殺死癌癥細胞。
盡管人體內的溫度差異很小,僅在幾攝氏度范圍內變動,但是研究人員們開始懷疑微小的差異可以改變細胞的化學組成與相關功能,或者可以幫助醫生們發現癌細胞生長。于是我們集中介紹一下:溫度是如何影響細胞內部的存在狀態和相關的幾種檢測方法。
關注溫度變化熱點
熱源材料:由內山誠一實驗室研發的微型熒光溫度計設計圖。當溫度計受涼的時候,它的聚合物主干保持一種開放的結構,水分子可以急速冷卻熒光單元并停止其發光(這里為一個星形基團)。當溫度上升時,溫度計折疊并保護熒光單元遠離水,使其可以發光。溫度計揭示:培養的猴子細胞的細胞核平均溫度比細胞質平均溫度高1℃。
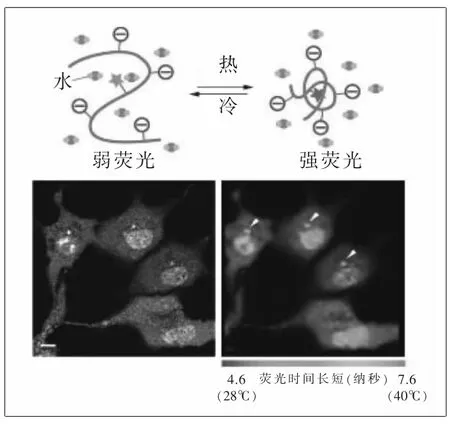
研究者:東京大學內山誠一;早稻田大學鈴木圓。
目標:溫度影響著細胞內部大量的過程,從基因表達到蛋白質之間的交聯方式。鈴木、內山和他們的同事們著眼于測量細胞不同部位之間溫度的細微變化。這樣的研究有可能發現熱是如何在人體內產生的,也有可能發現溫度的局部變化是如何改變細胞的化學結構和屬性的。
方法:包含有熒光染料及量子光點或其他發光發熱材料的傳感器,其光亮度可以由溫度的變化而變化。在過去幾年中,研究人員們已經發明了細胞可以攝入的微小熒光溫度計。借用顯微鏡,研究人員們可以檢測到溫度計的發光,從而判斷細胞內的溫度情況。
內山首次開始對單個細胞內部的溫度分布進行作圖,在2012年的《自然-通訊》雜志上發表了他設計的熒光聚合物溫度計。該溫度計由一個粘附在一條聚丙烯酰胺鏈上的熒光分子組成,其結構隨溫度的變化而發生改變,從而關閉或打開熒光。它們在猴子腎衍生細胞株中的實驗證明:細胞核比細胞質溫度高并且線粒體釋放出大量的熱量。
內山還發表了其他的熒光傳感器設計,距今最近的2015年研發了一種更快的熒光聚合體溫度計,其作用機理取決于溫敏性熒光體與抗溫敏熒光體的組成比例。他們使用這種傳感器來測量人體胚胎腎細胞內的溫度,發現細胞核的溫度大約比細胞質的溫度高1℃。
當鈴木第一次開始設計溫度計時,他將一個頂部粘附有熒光染料的玻璃微針輕柔地壓迫在細胞膜上,觀察熒光是否隨溫度升高而有所改變。最后,他和他的同事們開始做實驗來制作可以導入細胞內部的熒光納米粒子。因為溫度可以改變熒光分子的亮度,所以熒光分子不能暴露在細胞的化學環境中。“納米溫度計應該能夠讀出溫度的變化,而對于(其他的)環境改變則不做出反應。”鈴木說。
為了保護熒光探針分子,研究人員們把這些熒光分子植入到一個疏水聚合物內,然后把這個疏水核包埋在一個殼形的親水聚合物內,制作成平均直徑為140納米的顆粒。為了防止錯誤的反饋,鈴木使用了兩種類型的熒光體:一種對熱敏感,另一種則不。通過測量兩種熒光體亮度的比值,該團隊發現:用一種化學品刺激培養中的人類癌癥細胞后,細胞會產生熱,并且不同部位放熱量各不相同。
鈴木團隊于2015年建立了一種單分子溫度計,它由一種黃色熒光的且明確靶向線粒體的染料組成。此線粒體是細胞內的產熱引擎。另一種小分子溫度計靶向內質網。這種內質網是一種能幫助細胞產熱的細胞器。相關論文發表于2014年。
鈴木希望有朝一日能夠研發出有如下性能的細胞內溫度計:能夠有更快的應答時間和更強的溫度敏感性。這樣,他們可以確定細胞內產熱的其他熱點部位。最近他說,他正在努力改進傳感器,使之能夠捕捉到熱的微小爆炸及知曉它的擴散速率。“線粒體和內質網被認為是熱源,”鈴木說,“肌肉細胞內的肌動球蛋白也是熱源,應該還有其他的、我們還沒有想象得到的熱源。”

用金剛石做發光材料
珠光寶氣的細胞:米哈伊爾·盧金和他的同事們用激光照射已導入到細胞內的納米金粒子來加熱細胞,通過檢測納米金剛石內缺陷的自旋態來測量細胞的內部溫度。
研究者:哈佛大學米哈伊爾·盧金。
目標:盧金和他的合作者們夢想使用細胞內溫度來將健康細胞從疾病細胞中分選出來,并且通過加熱它們或者冷卻它們來控制細胞。“這為研究開辟了許多的可能性。”他說。
方法:盧金是一位物理學家,他另辟蹊徑,不用熒光染料或聚合物,而是用金剛石納米晶體來制作溫度計。他解釋說:“我們的基本思路是使用金剛石內的量子缺陷即所謂的氮空位中心機理在制作溫度計。這種氮空位是一種用氮替代碳的缺陷。”
氮空位中心擁有原子旋轉狀態,當用光、磁場或溫度干擾時會改變方向。“如果納米晶體的溫度改變,會發生的是納米晶體內碳原子之間的距離有少許改變,從而改變了電子的旋轉狀態。”盧金說。當研究人員們向金剛石納米晶體上照射一束激光時,氮替代碳的缺陷會發光,同時因它們的旋轉狀態和溫度不同而發射出不同的熒光。
為了檢驗他們方法的有效性,研究人員還將黃金納米粒子導入到細胞內,并用激光加熱粒子。經過這樣的改進,盧金和他的團隊不僅可以控制細胞的溫度,還可以監測細胞溫度控制是如何進行的。2013年,這些研究者發現他們可以檢測到小到0.001 8℃的溫度變化。
盧金和合作者們目前正在使用溫度來探索蠕蟲的發育機理并試圖影響其發育機理。
“它使得你可以選擇性地調節細胞內的各種過程,”他說,“它可以使得你加速一些過程的發育同時減速其他過程的發育,或者當你不需要這種特殊細胞再具有某種生理功能時殺死該細胞。”
癌癥殺手
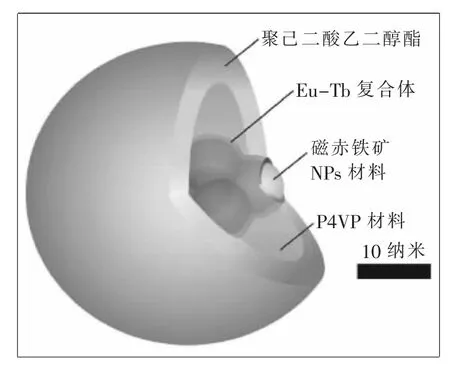
多用途微珠體:米蘭和卡洛斯已經設計了一顆微小的珠子,它既可以加熱細胞又可以測出它們的溫度來。熒光離子顯示溫度的變化。它們包裹磁性納米粒子,在暴露于磁場時可以為納米粒子提供熱能。為了起到保護作用,一個聚合物外殼把連接在一起的加熱器和溫度計包裹在內部。
研究者:葡萄牙阿維羅大學路易斯·卡洛斯(Luís Carlos);西班牙薩拉戈薩大學阿拉貢材料科學研究所安吉爾·米蘭(Angel Millán)。
目標:卡洛斯和米蘭正在試著殺死腫瘤,通過選擇性地向癌癥細胞施加能致死的高熱,制造溫度梯度以破壞生物分子和觸發細胞死亡。但是,使用過熱來殺死癌細胞越來越難以把握,因為缺乏一種良好的方法來保證癌細胞得到足夠的熱而周圍組織則保持相對的冷卻。
方法:卡洛斯和米蘭最近設計了一種納米粒子,既是一種加熱器又是一個溫度計。研究人員們希望既加熱細胞又測量它的溫度,方法是功能化不同部分顆粒使其完成兩種不同的任務。卡洛斯和米蘭想要保證他們在精確地測量熱源部位的溫度時,熱量可以在細胞內狹小的空間快速消散掉。“如果我們沒有真正與加熱器相連接的溫度計,我們就不可能測量到有效的局部溫度。”卡洛斯說。
加熱器由一個磁珠構成,當其暴露在磁場中時就會熱起來。溫度計由兩個熒光離子構成,其中之一隨溫度變化亮度也隨之變化。這些都被封閉在一個聚合物殼內。
目前已經有臨床試驗檢測使用磁珠誘導加熱來殺死癌細胞。但是,研究人員們認為,有了他們的組合型的加熱器-溫度計,他們可以更加精準地加熱細胞,在減少可用納米粒子的數量的同時,又能有效地殺死腫瘤。
“如果你將納米粒子特殊處理后嵌入到癌細胞內部,可能只需要少量就足以誘導癌細胞死亡。”米蘭說。研究人員們目前正在培養物中加熱其細胞并監測它們的溫度和反應。

深入到皮膚內部
深入皮下:杰克和他的同事們已經制作了一種可以感受皮膚下溫度的納米溫度計(上圖左上部)。溫度計是由溫度敏感性量子點和溫度不敏感性熒光納米粒子組成的,全部嵌入在一種具有兼容性的生物聚合物中。納米溫度計的透射電子顯微鏡圖像(上圖左下和右部)。
研究者:馬德里自治大學丹尼爾·杰克(Daniel Jaque)。
目標:杰克小組希望建立方法來測量動物的皮下溫度,最終實現人體組織在體溫度測量,而使用的溫度傳感器發出穿越肉體的熒光信號。
方法:大多數納米溫度計有一個重大的局限性:它們只發出可見光范圍的光波。這項工作的細致化實現了在培養物中觀察細胞,甚至于在相對透明的生物體模型如蠕蟲體內觀察細胞。但是,可見光不能告知研究人員更多關于完整的、不透明生物體內的皮膚下面的細胞所發生的故事。其間,大多數的紅外光譜可以被充滿在組織內的水所吸收。
但是,有些波長范圍的光波可以滲透入組織并且克服水吸收的難題。波長在650至950納米之間的光波是接近紅外線的紅光,它被認為是一扇供科學家們行之有效地開展對生物學研究的窗戶。波長在1 000至1 350納米之間的紅外光則為科學家們打開了第二扇“生物學之窗”。
杰克和他的同事們正在研發的一種使用熒光技術的溫度計,它們可以被這些“特定波長的光”激發并得出溫度的數值。最近,杰克帶領博士后埃瑪·馬丁·羅德里格斯(Emma Martín Rodríguez)和其他同事設計了一種溫度計,在第一波長段被激發并發射出第二波長段內的信號。
這種溫度計的組成一部分是量子點群,其熒光發光性隨溫度的上升而被淬滅,第二部分是對溫度不敏感的熒光納米粒子群,二者都被包裹在一種被稱為FDA的聚合物之內。
有了目前的這些技術,就可能感受到動物皮膚下大約1厘米深淺處的溫度。但是為了能夠將這些成果轉化為相關人體的醫學應用,研究人員們將需要檢測到更深處的溫度。“我們還剛剛處在歷史的開始階段。”杰克說。
最后,杰克希望使用納米溫度計來幫助對癌癥的熱治療。“你導入納米粒子到你的體內后,它會給出機體溫度的實時測量值。”他說,然后在你加熱腫瘤時,“你可以調節治療裝置溫度從而不至于灼傷機體。”

溫度的困惑
對2012年《自然-通訊》雜志內山誠一論文載圖中描述的高水平產熱問題,巴富表示反對。圖像顯示在活猴細胞內線粒體附近的大型局部溫度峰值(白色箭頭)。字母N指示細胞核。
包括鈴木圓和內山誠一在內的研究人員最近測量到了活細胞內實質性的溫度增加。在這些案例中,盡管缺乏任何對細胞的外來加熱,溫差仍然達到了幾個攝氏度。2014年9月,一組法國的研究人員對此發現提出了疑問,他們從2014年到2015年發表了時間跨度長達一年的觀察研究。法國小組進行了統計學計算,似乎證明了單個細胞不可能有足夠的能量來如此快速地對其自身產生這樣巨大的溫度變化。“葡萄糖是一種細胞內分子也是能量的來源,”來自艾克斯·馬賽大學菲涅耳研究所的共同作者吉列姆·巴富(Guillaume Baffou)說,“如果你用葡萄糖填滿細胞的整個體積,然而這顯然是不太可能的。同時如果你將葡萄糖燃燒掉,你也不會使得溫度增加1℃。”
“如果我們應用傳統的熱力學法則,我們會得出這樣的結論,細胞內部反應不會產生大約1℃的細胞內溫度變化,”葡萄牙阿維羅大學的路易斯·卡洛斯表達了自己的認同,“但是,從實驗結果來說,有幾項來自世界各地的研究者完成的工作表明存在超過1℃的溫度差異。”
一種可能性是:研究人員觀察到細胞內巨大的溫度增加簡單地說只是在制造實驗誤差。“另外一種假設是微米和納米級尺度的熱傳遞問題,并不能用傳統熱力學進行良好的描述。”卡洛斯說。
鈴木同意這樣的說法:在沒有外來熱輸入的情況下,不可能有整個細胞變熱達1℃。但是,“計算應該不考慮像水球一樣的整個細胞的溫度,而是考慮細胞內部一個微小的體積產生熱量即在此基礎上的測量溫度。”鈴木說,下一步將是測量活細胞的熱傳導性,并保證它們的細胞器和蛋白質遍及其內部。這可能有助于解釋局部細胞是否可以加熱及如何來加熱,而整個細胞并沒有經歷根本性的溫度變化。
“熱生物學(Thermal biology)仍然處于其嬰兒期,”巴富說,“我們希望得到一張整個細胞的可靠的溫度分布圖。”
[資料來源:The Scientist][責任編輯:遙醒]

