基于OMP18的B細(xì)胞抗原表位的空腸彎曲菌ELISA檢測(cè)方法的建立
樓宏強(qiáng),高素華,李旭升,陳浩浩,胡 野
?
基于OMP18的B細(xì)胞抗原表位的空腸彎曲菌ELISA檢測(cè)方法的建立
樓宏強(qiáng),高素華,李旭升,陳浩浩,胡 野
目的 以O(shè)MP18的B細(xì)胞抗原表位多肽為包被抗原,建立檢測(cè)空腸彎曲菌感染的ELISA方法。方法 以不同濃度梯度(0.1,1,10 μg/mL)OMP18的B細(xì)胞抗原表位多肽進(jìn)行包被,以空腸彎曲菌全菌兔抗IgG為一抗,HRP標(biāo)記的羊抗兔抗體IgG為二抗,檢測(cè)對(duì)原濃度1 mg/mL的不同稀釋度(1∶10,1∶100,1∶1 000)抗體IgG水平。分別以空腸彎曲菌感染兔血清、健康兔血清及沙門菌感染兔血清為一抗,1∶3 000稀釋的HRP標(biāo)記的羊抗兔IgG為二抗,比較各抗原表位多肽的免疫特異性。結(jié)果 OMP18的B細(xì)胞抗原3個(gè)表位多肽在稀釋度在1∶1 000、1∶4 000、1∶16 000、1∶64 000時(shí)免疫反應(yīng)性均有明顯增高。其中稀釋度在1∶1 000時(shí)增高最明顯。OMP18的B細(xì)胞抗原表位多肽具有免疫特異性。結(jié)論 用OMP18的B細(xì)胞抗原表位多肽作為包被抗原對(duì)空腸彎曲菌感染的血清進(jìn)行ELISA檢測(cè),免疫反應(yīng)性高,具有免疫特異性。
空腸彎曲菌;外膜蛋白OMP18;抗原表位;酶聯(lián)免疫吸附實(shí)驗(yàn)
空腸彎曲菌(Campylobacterjejuni)是常見的人畜共患病病原菌,也是一種食物源性病原菌,可在人和動(dòng)物引起多種疾病,被認(rèn)為是人類細(xì)菌性腹瀉的主要致病菌。空腸彎曲菌為革蘭氏陰性桿菌,嗜熱,微需氧,培養(yǎng)條件苛刻,在富營養(yǎng)、微需氧的環(huán)境下才能生長。其主要傳染源為動(dòng)物或動(dòng)物產(chǎn)品,廣泛分布于各種動(dòng)物體內(nèi),以禽畜、寵物為常見宿主,因此研究快速而特異的分離和檢測(cè)方法具有重要的現(xiàn)實(shí)意義。我們前期從生物信息學(xué)角度了解空腸彎曲菌主要外膜蛋白OMP18的跨膜結(jié)構(gòu)、B細(xì)胞抗原表位及其抗原性、基因序列保守性等特征[1]。本研究以O(shè)MP18優(yōu)勢(shì)B細(xì)胞抗原表位多肽序列為依據(jù),合成多肽進(jìn)行抗原表位的免疫學(xué)檢測(cè),并建立相關(guān)的ELLISA檢測(cè)方法,為空腸彎曲菌的檢測(cè)和疫苗研究提供實(shí)驗(yàn)依據(jù)。
1 材料與方法
1.1 材料 OMP18的B細(xì)胞抗原表位多肽由上海紫域生物科技有限公司合成。采用固相多肽合成技術(shù),以N-α-Fmoc保護(hù)的氨基酸為原料,F(xiàn)moc-AA-Wang樹脂為載體,HBTU方法偶聯(lián)。經(jīng)HPLC鑒定純度在95%以上,相關(guān)檢測(cè)方法已申請(qǐng)專利[2]。空腸彎曲菌OMP18的B細(xì)胞抗原具有3個(gè)表位,A抗原表位肽序列為STKSTSVSGDSSVDSNRGSGGSDGWDID,B抗原表位肽序列為EGNCDEWGTDEYN,C抗原表位肽序列為SYGETNPVCTEKTKACDAQNRR。包被液為0.05 mol/L碳酸鹽緩沖液,pH 9.6;洗滌液為0.02 mol/LTrisHCl-Tween20,pH7.4;抗體稀釋液為0.05 mol/LPBS-Tween20,pH 7.4;封閉液為10 g/L牛血清白蛋白(BSA);終止液為2 mol/L H2SO4;HRP標(biāo)記的羊抗人IgG。均購自杭州澤衡生物科技有限公司。
1.2 抗原包被 用包被液將包被抗原稀釋成2.5、5、10、15、20 μg/mL,包被ELISA板每孔加入100 μL,于4 ℃過夜;洗滌4次并空干后,每孔加入封閉液300 μL,4℃封閉過夜;共洗滌4次,密封后4℃保存?zhèn)溆谩?/p>
1.3 免疫反應(yīng)性測(cè)定 96孔酶標(biāo)板階梯濃度(1∶1 000,1∶4 000,1∶16 000,1∶64 000)每孔加入各抗原表位肽各50 μL,4 ℃包被過夜,各抗原表位肽樣本均重復(fù)3孔。次日用含0.05%Tween20的PBS洗滌3次,然后用5%小牛血清4 ℃封閉過夜。以1∶3 000稀釋的兔抗CJ為一抗、1∶10 000稀釋的HRP標(biāo)記的羊抗兔IgG為二抗,TMB為底物,采用ELISA檢測(cè)各抗原表位肽的免疫反應(yīng)性。實(shí)驗(yàn)中分別設(shè)置等量BSA為包被抗原的陰性對(duì)照,以O(shè)MP18蛋白為包被抗原的陽性對(duì)照,以陰性對(duì)照樣本OD值+3SD作為陽性判斷標(biāo)準(zhǔn)。
1.5 重復(fù)性實(shí)驗(yàn) 3個(gè)表位均采用上述同樣方法進(jìn)行重復(fù)測(cè)定,以檢測(cè)PN值。
2 結(jié) 果
2.1 OMP18的B細(xì)胞抗原表位多肽血清最佳稀釋度 ELISA檢測(cè)結(jié)果顯示,OMP18的B細(xì)胞抗原3個(gè)表位多肽在稀釋度在1∶1 000、1∶4 000、1∶16 000、1∶64 000時(shí)免疫反應(yīng)性均有明顯增高。其中稀釋度在1∶1 000時(shí)增高最明顯,A抗原表位肽OD值為2.791,B抗原表位肽OD值為2.601,C抗原表位肽OD值為2.876。見圖1。
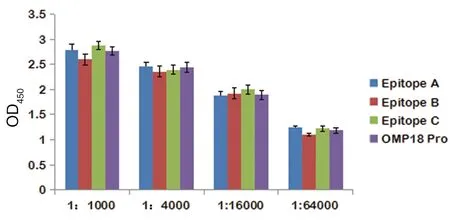
圖1 3個(gè)表位梯度濃度ELISA檢測(cè)兔空腸彎曲菌全血抗體的結(jié)果Fig.1 Detection of rabbit’s blood antibody against Campylobacter jejuni of 3 epitopes with gradient concentrations by ELISA
2.2 OMP18的B細(xì)胞抗原表位多肽免疫特異性
采用ELISA檢測(cè)各抗原表位肽的免疫特異性結(jié)果提示,空腸彎曲菌感染兔血清免疫反應(yīng)性高,A抗原表位肽OD值為1.076,B抗原表位肽OD值為0.921,C抗原表位肽OD值為0.998。健康兔血清,大腸埃希菌、痢疾志賀菌及傷寒沙門菌感染兔血清免疫反應(yīng)性低,與空腸彎曲菌感染兔血清相比,均有統(tǒng)計(jì)學(xué)意義(P<0.05)。見圖2。
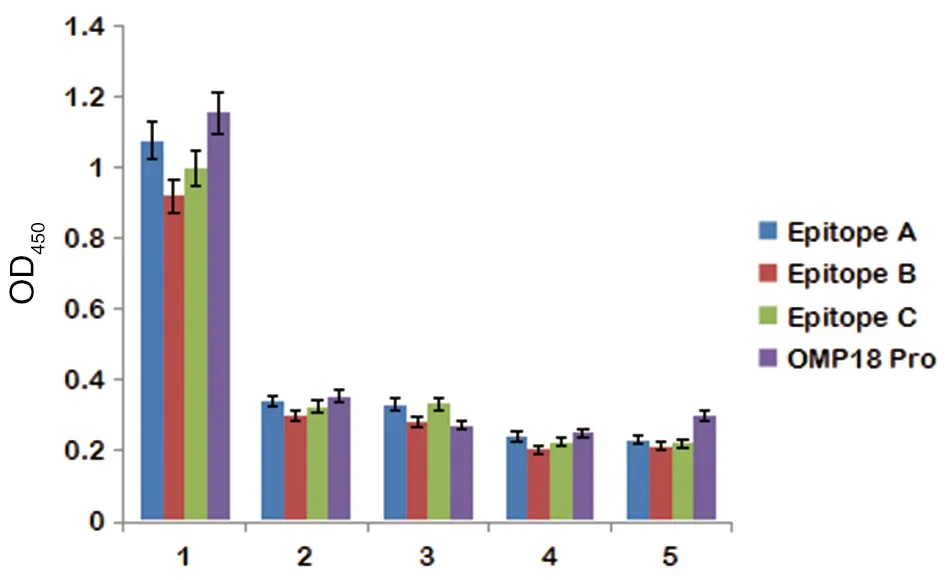
1.Serum from a rabbit infected with Campylobacter jejuni; 2.Serum from a healthy rabbit;3.Serum from a rabbit infected with Escherichia coli;4.Serum from a rabbit infected with Shigella dysenteriae; 5.Serum from a rabbit infected with Salmonella typhi.圖2 3個(gè)表位免疫特異性ELISA檢測(cè)結(jié)果Fig.2 Detection of immunological of 3 epitopes by ELISA
2.3 重復(fù)性實(shí)驗(yàn) 根據(jù)重復(fù)性實(shí)驗(yàn)測(cè)定的PN值,進(jìn)行統(tǒng)計(jì)學(xué)處理,t值為1.70,P>0.05,表明差異無統(tǒng)計(jì)學(xué)意義,說明此實(shí)驗(yàn)有較好的重復(fù)性。
3 討 論
空腸彎曲菌是重要的食源性致病菌,也是引起人類腹瀉的主要致病菌之一,可通過食物鏈傳染給人,引起人的急性腸胃炎和發(fā)熱,進(jìn)而可引發(fā)心內(nèi)膜炎、骨髓炎、關(guān)節(jié)炎等全身性疾病。在病原體致病過程中,外膜蛋白在免疫反應(yīng)中表現(xiàn)出重要作用,其通過增強(qiáng)巨噬細(xì)胞攝取抗原能力,促進(jìn)了淋巴細(xì)胞活化,并廣泛作為病原體感染的檢測(cè)及保護(hù)性疫苗抗原篩選[3]。OMP18是空腸彎曲菌主要外膜蛋白,分子質(zhì)量為18 kD,由OMPl8基因編碼。由于在彎曲菌屬中普遍存在,因此OMP18是血清學(xué)檢測(cè)空腸彎曲菌感染的重要候選抗原[4]。前期我們使用TMHMM Server V2.0, DNA Star,NCBI/Blast等生物信息分析軟件分析了空腸彎曲菌主要外膜蛋白OMP18的結(jié)構(gòu)和分子特征,并對(duì)運(yùn)用ELISA鑒定了其中可能存在的線性B細(xì)胞表位[1]。空腸彎曲菌OMP18無跨膜結(jié)構(gòu)存在,全部定位于細(xì)菌表面。域預(yù)測(cè)蛋白功能結(jié)構(gòu)表明OMP18中存在OMP A結(jié)構(gòu)域,并與空腸彎曲菌的粘附能力密切相關(guān)。二級(jí)結(jié)構(gòu)分析結(jié)果顯示,在OMP18蛋白中有3個(gè)線性B細(xì)胞表位,其具有良好的抗原性和親水性。應(yīng)用空腸彎曲菌全菌抗體對(duì)預(yù)測(cè)表位進(jìn)行ELISA鑒定結(jié)果顯示3個(gè)表位多肽均能與全菌抗體有效結(jié)合,但結(jié)合力并不一致。
空腸彎曲菌體外培養(yǎng)困難,生長條件要求苛刻,常規(guī)培養(yǎng)方法對(duì)于快速準(zhǔn)確的檢測(cè)與鑒定有一定的難度[5]。高長航等[6]采用增菌法從180例腹瀉患者糞便中檢出空腸彎曲菌20株,較直接法陽性率高。增菌法的優(yōu)點(diǎn)是:空腸彎曲菌有較好的生長能力;有較強(qiáng)的抑制雜菌能力,一般細(xì)菌不易生長。許旭萍[7]等用Skirrow為基礎(chǔ)培養(yǎng)基,加入適量維生素B12、FeSO2和活性炭,以50%卵黃鹽水替代凍溶羊血,制成改良的Skirrow培養(yǎng)基,容易配制,經(jīng)濟(jì)方便,用于空腸彎曲菌的分離和選擇性增菌培養(yǎng)切實(shí)可行。王曉英等[8]建立了疏水柵濾膜-酶免疫方法,其對(duì)嗜熱性空腸彎曲桿菌具有特異性和簡(jiǎn)單方便,目前已被用于雞肉沖洗水和牛奶樣品中空腸彎曲桿菌的檢測(cè)和計(jì)數(shù)。疏水柵濾膜就是將疏水線印在膜上,從而使微生物的生長被限制在膜上的1600個(gè)方格內(nèi),增加檢測(cè)和自動(dòng)計(jì)數(shù)細(xì)菌的敏感性。應(yīng)用特異性抗體在疏水柵濾膜上載樣,進(jìn)行酶免疫試驗(yàn)。主要步驟都在室溫下進(jìn)行,操作時(shí)長不足3 h,具有簡(jiǎn)單、快速、特異特點(diǎn)。侯建軍等[9]采用VSl基因保守序列為模板,自行設(shè)計(jì)引物,擴(kuò)增產(chǎn)物為516 bp片段。該方法只出現(xiàn)空腸彎曲菌擴(kuò)增產(chǎn)物,而不出現(xiàn)其他彎曲菌和其他屬細(xì)菌的特異性片段,檢測(cè)靈敏度高達(dá)6 CFU/mL。該方法提供了一種鑒別空腸彎血菌和結(jié)腸彎曲菌的簡(jiǎn)便方法。劉光明[10]針對(duì)空腸彎曲菌馬尿酸酶(hipO)基因和鞭毛蛋白A(flaA)基因設(shè)計(jì)了2組引物與熒光標(biāo)記探針,初步建立了空腸彎桿曲菌的磁捕獲-熒光PCR的鑒定和快速檢測(cè)方法,能提高農(nóng)產(chǎn)品及食品中空腸彎曲菌的檢出率。可見,對(duì)空腸彎曲菌的檢測(cè)方法已經(jīng)有了初步的研究,進(jìn)一步研究其毒力因子的功能、合成及致病機(jī)理,篩選具有免疫保護(hù)作用的表面抗原成分并建立快速特異的檢測(cè)方法等有待進(jìn)一步深入和研究。
本研究在前期采用懸浮芯片技術(shù),篩選出3個(gè)空腸彎曲菌主要外膜蛋白OMP18優(yōu)勢(shì)B細(xì)胞線性抗原表位基礎(chǔ)上,建立了基于空腸彎曲菌主要外膜蛋白OMP18優(yōu)勢(shì)B細(xì)胞線性抗原表位的ELISA方法,具有良好的重復(fù)性、特異性、敏感性特點(diǎn),能應(yīng)用于實(shí)驗(yàn)室對(duì)空腸彎曲菌的鑒別分析,對(duì)于空腸彎曲菌的檢測(cè)具有一定的意義。
[1] Lou HQ, Hu Y, Wang L, et al. Analysis and identification of B cell epitopes of the OMP18 fromCampylobacterjejuni[J]. Chin J Zoonoses, 2014, 30(7): 739-742. (in Chinese)
樓宏強(qiáng), 胡野, 王嵐, 等. 空腸彎曲菌主要外膜蛋白OMP18的B細(xì)胞抗原表位分析及功能鑒定[J]. 中國人獸共患病學(xué)報(bào), 2014, 30(7): 739-742.
[2] Lou HQ, Shan XY, Song CH, et al. Screening and identification of B cell epitopes method of the OMP18 fromCampylobacterjejuni[P]. Chinese patent: CN103941018A, 2014.03.27 (in Chinese)
樓宏強(qiáng), 單小云, 宋春涵, 等. 一種空腸彎曲菌主要外膜蛋白OMP18的B細(xì)胞抗原表位篩選及功能鑒定方法[P]. 中國專利:CN103941018A, 2014.03.27
[3] Sizemore DR, Warner B, Lawrence J, et al. Live, attenuatedSalmonellatyphimuriumvectoring Campylobacter antigens[J]. Vaccine, 2006, 24(18): 3793-3803. DOI: 10.1016/j.vaccine.2005.07.026
[4] Qu HH, Wang J, Wang JW, et al. Research progress of pathogenic and pathogenic mechanism ofCampylobacterjejuni[J]. Prog Veter Med, 2013, 34(12): 164-169. (in Chinese)
翟海華, 王娟, 王君偉,等.空腸彎曲菌的致病性及致病機(jī)制研究進(jìn)展[J].動(dòng)物醫(yī)學(xué)進(jìn)展, 2013, 34(12): 164-169.
[5] Sandberg M, Nygard K, Meldal H, et al. Incidence trend and risk factors forCampylobacterinfections in humans in Norway[J]. BMC Pub Heal, 2006, 6(13): 1-8. DOI: 10.1186/1471-2458-6-179
[6] Gao CH, Li RB, Huang Y. Application of selective enrichment method for detection ofCampylobacterjejunifrom feces of diarrhea patients[J]. J Huaihai Med, 1997, 15(2): 28. (in Chinese)
高長航,李瑞斌,黃永.應(yīng)用選擇增菌法從腹瀉病人糞便中檢出空腸彎曲菌[J].淮海醫(yī)藥,1997,15(2):28.
[7] Xu XP, Li HZ. Study on the culture of theCampylobacterjejuniusing Egg Yolk Salt instead of frozen blood solution[J]. J Fujian Norm Univ, 1996, 12(4): 86-90. (in Chinese).
許旭萍, 李惠珍. 用卵黃鹽水代替凍溶羊血培養(yǎng)空腸彎曲菌的研究[J]. 福建師范大學(xué)學(xué)報(bào), 1996, 12(4): 86-90.
[8] Wang XY. Rapid detection and counting method ofBacilluscoliin food[J]. Fore Med Sci (Hyg), 2003, 30(3): 180-182. (in Chinese)
王曉英. 食品中空腸彎曲桿菌快速檢測(cè)及計(jì)數(shù)方法[J]. 國外醫(yī)學(xué)衛(wèi)生學(xué)分冊(cè), 2003, 30(3): 180-182.
[9] Hou JJ, Zhu JG, Hua XG, et al. Establishment of PCR detection method forCampylobacterjejuniin animals and their products[J]. Chin J Zoonoses, 2008, 24(2): 128-131. (in Chinese)
侯建軍, 朱建國, 華修國, 等. 動(dòng)物及其產(chǎn)品中空腸彎曲菌PCR檢測(cè)方法的建立[J]. 中國人獸共患病學(xué)報(bào), 2008, 24(2): 128-131.
[10] Liu GM, Cai HN, Cao MJ, et al. A new method for detecting viable non-cultured state ofCampylobacterjejuni[J]. J Chin Insti Food Sci Tech, 2006, 6(4): 122-126. (in Chinese)
劉光明,蔡慧農(nóng),曹敏杰,等.一種檢測(cè)活的非可培養(yǎng)狀態(tài)空腸彎曲菌的新方法[J].中國食品學(xué)報(bào), 2006, 6(4): 122-126.
Establishment of ELISA method for detectingCampylobacterjejunibased on the B-cell antigen epitope of OMP18
LOU Hong-qiang, GAO Su-hua, LI Xu-sheng, CHEN Hao-hao, HU Ye
(MedicalSchool,JinhuaPolytechnic,Jinhua321007,China)
This study aims to establish an ELISA method for detection ofCampylobacterjejuniinfection by using the B-cell antigen epitope polypeptide of OMP18 as the coating antigen. Using the B-cell epitope peptides with different concentrations (0.1,1 and 10 μg/mL) as the coating antigens, the rabbit anti-CampylobacterjejuniIgG antibody as the primary antibody and the HRP-labeled goat anti-rabbit IgG antibody as the secondary antibody, the researchers detect the levels of IgG antibody after different dilutions (1∶10, 1∶10 and 1∶1 000) based on its original concentration of 1 mg/mL. The researchers also compare different immunological specificities of epitope peptides via using the serum from a healthy rabbit, the serums respectively from the rabbits infected withCampylobacterjejuniandSalmonellaas the primary antibody as well as the HRP-labeled goat anti-rabbit IgG antibody(1∶3 000) as the secondary antibody. The immunoreactivity of three B cell antigen epitope polypeptides of OMP18 significantly increase in the dilutions of 1∶1 000,1∶4 000 and 1∶16 000 and 1∶64 000,while it finds the most significant increase in a 1∶1 000 dilution.Therefore, the B-cell epitope peptides of OMP18 indeed features an immunological specificity. And the study indicates that the ELISA is a desirable method capable of detectingCampylobacterjejuniinfection by using OMP18 B cell antigen epitope polypeptide as the coating antigen with a high immune response and a specific immunity.
Campylobacterjejuni; OMP18; antigenic epitope; enzyme linked immunosorbent assay
Hu Ye, Email: huye8254@vip.sina.com
10.3969/j.issn.1002-2694.2016.010.008
浙江省公益性技術(shù)應(yīng)用研究計(jì)劃資助項(xiàng)目(No.2013C33215);金華市科技研究計(jì)劃資助項(xiàng)目(No.2013-3-017);浙江省醫(yī)藥衛(wèi)生計(jì)劃資助項(xiàng)目(No.2013KYA214)
胡野,Email:huye8254@vip.sina.com
金華職業(yè)技術(shù)學(xué)院醫(yī)學(xué)院,金華 321007
R378.2
A
1002-2694(2016)10-0889-04
2016-04-11;
2016-08-16
Supported by the Zhejiang Province Public Welfare Technology Application Research Project (No.2013C33215) and the Jinhua Science and Technology Research Project (No.2013-3-017),and the Zhejiang Medical and Health Project (No. 2013KYA 214)

