弓形蟲表面抗原SAG1基因自殺性DNA疫苗的構建及免疫原性檢測
鄭麗娜,譚 峰,潘長旺
?
弓形蟲表面抗原SAG1基因自殺性DNA疫苗的構建及免疫原性檢測
鄭麗娜1,2,譚 峰1,潘長旺1
目的 構建表達弓形蟲表面抗原SAG1的自殺性DNA疫苗pDREP-SAG1并檢測其免疫原性。方法 以弓形蟲RH株基因組DNA為模板,PCR擴增SAG1基因(GenBank No.HM776940.1),克隆至甲病毒復制子載體pDREP-eGFP中替換原有的eGFP基因,菌液PCR、雙酶切及測序鑒定重組質粒。重組的自殺性DNA疫苗pDREP-SAG1經股四頭肌注射并聯合瞬時電穿孔免疫BALB/c小鼠,同時以原質粒pDREP-eGFP作為對照組,間隔3周后以相同條件再免疫1次,收集小鼠血清,以弓形蟲裂解抗原Western blotting檢測其誘導產生的特異性抗體。結果 從弓形蟲基因組中PCR擴增得到1 011 bp長度的SAG1基因,成功構建重組質粒pDREP-SAG1。Western blotting結果顯示,重組質粒免疫的小鼠血清能特異性地識別蟲體抗原中的SAG1抗原。結論 成功構建了弓形蟲自殺性DNA疫苗pDREP-SAG1,能誘導小鼠產生特異性的抗體,具有免疫原性。
弓形蟲;SAG1;自殺性DNA疫苗
剛地弓形蟲(Toxoplasmagondii)是一種重要的機會性致病原蟲,廣泛寄生于人和多種動物的有核細胞內,可引起人獸共患弓形蟲病,是免疫功能受損或免疫抑制者(如器官移植、艾滋病及惡性腫瘤患者)發生致死的主要病因之一。然而,由于弓形蟲生活史復雜、傳播途徑多樣、宿主廣泛,臨床上尚無理想的抗弓形蟲藥物[1]。研制安全、高效、廉價的疫苗被認為是弓形蟲防治的重要措施[2,3]。
DNA疫苗是近年來發展起來的,堪稱疫苗史上的一次巨大革命。DNA疫苗的諸多優勢成為當前疫苗研究的熱點,如制備簡單、表達抗原以天然構象存在、能刺激機體產生免疫反應、易于制備多價疫苗、易于大規模生產、保存和運輸[4]。盡管DNA疫苗具有良好的開發應用前景,但也存在轉化宿主細胞基因組和引起免疫耐受的潛在風險[5],對于它的臨床應用無疑是一大障礙。基于甲病毒復制子的自殺性DNA疫苗,不僅具有傳統DNA疫苗的諸多優勢,而且克服了基因組整合和免疫耐受的弊端,因其甲病毒復制子的自我復制特性,使外源基因大量轉錄和翻譯,同時產生的中間體雙鏈RNA又可以誘導宿主細胞凋亡[6]。
SAG1是位于弓形蟲速殖子表膜的重要抗原之一,具有較強的免疫原性,被認為是最有希望的弓形蟲疫苗候選靶標[7]。本研究擬構建基于Semliki Forest(SFV)甲病毒復制子的弓形蟲自殺性DNA疫苗載體pDREP-SAG1,并鑒定其在小鼠模型中的免疫原性,為弓形蟲自殺性DNA疫苗的開發應用研究打下基礎。
1 材料與方法
1.1 材 料
1.1.1 蟲株和細胞 弓形蟲RH株由溫州醫科大學寄生蟲學教研室保存;人包皮成纖維細胞hTERT由美國印第安納大學醫學院的William J. Sullivan教授惠贈。
1.1.2 質粒和菌株 SFV甲病毒復制子載體pDREP-eGFP[8]由瑞典卡羅林斯卡研究所的Peter Liljestr?m教授惠贈;大腸桿菌DH5α為溫州醫科大學寄生蟲學教研室保存。
1.1.3 實驗動物 BALB/c小鼠(6~8周齡,雌性,清潔級)由溫州醫科大學實驗動物中心提供。
1.1.4 主要試劑 KAPA HiFi HotStart ReadyMix高保真酶購自美國KapaBiosystems公司;胎牛血清,DMEM購自美國Gibco公司;QIAamp○RDNA Mini Kit基因組提取試劑盒、QIAGEN Plasmid Maxi Kit質粒大提試劑盒購自德國QIAGEN公司;PCR產物回收試劑盒E.Z.N.A.○RCycle-Pure Kit和膠回收試劑盒E.Z.N.A. Gel Extraction Kit購自美國Omega bio-tek公司;限制性內切酶XmaI、SpeI和T4 DNA連接酶購自美國NEB公司;PBS緩沖液干粉(pH 7.2~7.4)購自北京索萊寶科技有限公司。
1.2 方 法
1.2.1 弓形蟲基因組DNA的提取 將弓形蟲速殖子感染人包皮成纖維細胞hTERT,培養于含1%胎牛血清的DMEM培養基中。待速殖子完全出胞后,用3 μm濾器過濾掉細胞碎片收集弓形蟲。收集的蟲體按照QIAamp○RDNA Mini Kit基因組提取試劑盒說明提取弓形蟲基因組DNA,紫外分光光度法測度DNA濃度。
1.2.2 PCR擴增SAG1基因 根據GenBank中弓形蟲SAG1基因編碼序列(No.HM776940.1),用Primer Premier 5.0軟件設計1對引物。在上、下游引物5′端分別引入XmaI和SpeI酶切位點。上游引物: 5′-GGCCCGGG ATGTCGGTTTCGCTGCACCAC-3′ (下劃線部分為Xma I酶切位點);下游引物: 5′-GGACTAGTTCACGCGACACAAGCTGCGAT-3′ (下劃線部分為SpeI酶切位點)。引物由上海立菲生物技術有限公司合成。PCR反應參數為:95 ℃預變性2 min;98 ℃變性20 s,72 ℃退火延伸40 s,共32個循環;72 ℃終延伸2 min。取5 μL PCR擴增產物經1%瓊脂糖凝膠電泳鑒定,剩余的20 μL PCR產物按PCR產物回收試劑盒進行純化。
1.2.3 重組載體pDREP-SAG1的構建及鑒定 將上述SAG1片段和甲病毒復制子載體pDREP-eGFP分別用XmaI和SpeI雙酶切。膠回收純化片段,并將獲得的SAG1基因片段與pDREP骨架大片段按3∶1摩爾比,用T4 DNA連接酶16 ℃連接過夜。連接產物轉化大腸桿菌DH5α,涂布在卡那霉素LB平板上,挑取單克隆,經菌液PCR和雙酶切初步鑒定后,送上海立菲生物技術有限公司測序驗證。
1.2.4 動物分組及免疫 6只BALB/c小鼠隨機分成2組,每組3只。第1組注射重組質粒pDREP-SAG1,第2組注射原質粒pDREP-eGFP設為對照組。質粒用QIAGEN Plasmid Maxi Kit質粒大提試劑盒提取后,用無菌PBS稀釋到0.5 μg/μL,每只小鼠接種質粒100 μL,于兩側股四頭肌下端進行肌肉注射,并立即用電轉儀(ECM 830, 美國BTX公司)對免疫部位進行瞬時電擊,電擊參數為:75 V/cm 電擊20 ms,間隔200 ms,脈沖6次。間隔3周以相同條件免疫1次,共免疫2次。
1.2.5 Western blotting檢測免疫小鼠血清中特異性抗體 末次免疫后2周,采用眼內眥毛細管法取小鼠血清,用Western blotting鑒定小鼠血清中的特異性抗體。將弓形蟲RH株弓形蟲裂解抗原(TLA)[9]進行12% SDS-PAGE電泳,一抗分別為pDREP-SAG1免疫組混合血清和pDREP-eGFP免疫對照組混合血清,稀釋比為1∶500;二抗為HRP標記的山羊抗小鼠IgG 稀釋比為1∶5 000。同時,以兔源β-tubulin抗體[10]為內參抗體,稀釋比為1∶1 000;二抗為HRP山羊抗兔IgG。
2 結 果
2.1 SAG1基因的PCR擴增 以合成的1對引物,從弓形蟲RH株基因組中擴增到SAG1基因片段,PCR產物經1%瓊脂糖凝膠電泳鑒定,在1 011 bp處有1條特異的明亮的條帶,與預期大小一致(圖1)。
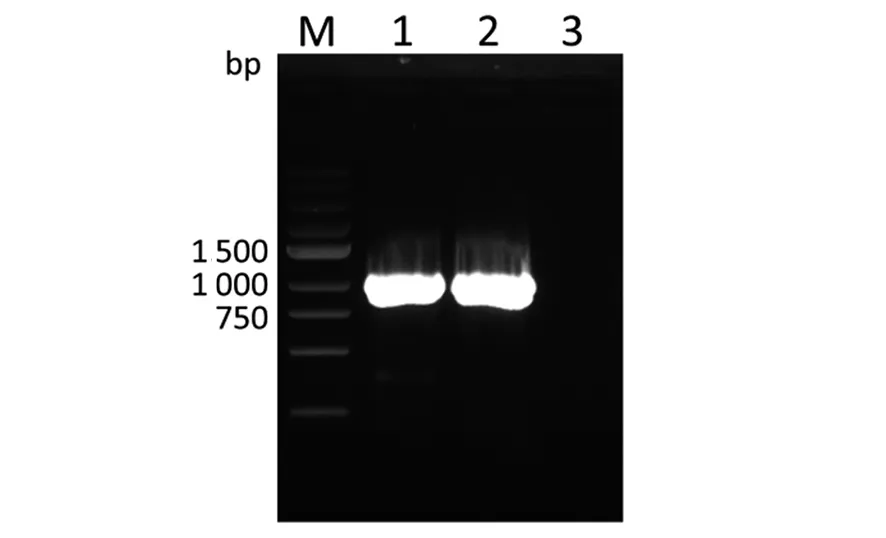
M: DNA標志物,1,2:SAG1基因,3:陰性對照M: DNA marker,1,2:SAG1 gene,3:Negative control圖1 弓形蟲SAG1基因PCR擴增Fig.1 PCR amplification of SAG1 gene
2.2 重組質粒pDREP-SAG1的構建與PCR、雙酶切鑒定 質粒pDREP-eGFP用XmaI和SpeI酶切產生約11 000 bp的pDREP骨架大片段和720 bp的eGFP基因小片段。將SAG1基因的雙酶切產物與pDREP骨架大片段連接,替換掉原質粒pDREP-eGFP上的720 bp長度的eGFP報告基因,產生重組質粒pDREP-SAG1。挑取平板上的陽性克隆用載體pDREP的通用引物進行PCR擴增可得到1 132 bp長度的單一條帶,而原質粒pDREP-eGFP可擴增得到841 bp長度的單一條帶,與預期大小一致。重組質粒經XmaI和SpeI雙酶切鑒定,獲得兩條條帶,分別是約11 000 bp的pDREP骨架大片段和1 011 bp的SAG1基因小片段,大小與理論值相符,并進一步送測序鑒定,重組質粒pDREP-SAG1構建正確(圖2)。

M1,M2:DNA marker; 1: PCR amplification of pDREP-eGFP; 2,3: PCR amplification of pDREP-SAG1; 4: PCR amplification of SAG1 gene; 5: pDREP-eGFPdigested with Xma I and Spe I; 6: pDREP-SAG1 digested with Xma I and Spe I圖2 重組質粒pDREP-SAG1的PCR(通用引物)和雙酶切鑒定Fig.2 Identification of recombinant plasmid pDREP-SAG1 with PCR (universal primers) and restrictive enzymes digestion
2.3 Western blotting檢測免疫小鼠血清中特異性抗體 重組質粒末次免疫小鼠后2周,收集小鼠血清。用弓形蟲RH株蟲體蛋白作為樣品進行Western blotting檢測。結果表明,重組質粒pDREP-SAG1免疫組血清能夠特異性地識別弓形蟲蟲體蛋白中約30 kDa大小的SAG1蛋白,而原質粒pDREP-eGFP免疫組血清在30 kDa處未顯示有特異性條帶,同時兩個泳道中的蟲體蛋白在55 kDa處均能被弓形蟲內參抗體β-tubulin識別到特異性條帶,表明重組質粒pDREP-SAG1免疫小鼠后誘導小鼠產生了抗SAG1的抗體,具有較好的免疫原性。

1: Sera from plasmid pDREP-eGFP immunized mice; 2: Sera from recombinant plasmid pDREP-SAG1 immunized mice圖3 免疫小鼠血清特異性抗體Western blotting檢測Fig.3 Western blotting analysis of specific antibody in sera from immunized mice
3 討 論
DNA疫苗是將編碼病原體的抗原基因重組到真核表達載體中,通過皮膚、肌肉等免疫方式接種動物,使其在細胞內表達其編碼的抗原蛋白。其中,自殺性DNA疫苗載體是近年來發展起來的基于甲病毒復制子一種新型DNA疫苗設計,具有自主復制、高效表達和誘導宿主細胞凋亡等特性,相比較常規DNA疫苗更為安全、高效,是近年來DNA疫苗領域的重大突破[6]。自殺性DNA疫苗在抗豬瘟病毒、流感病毒、人單純皰疹病毒等病毒和腫瘤疫苗方面取得了令人鼓舞的結果[11],但在弓形蟲疫苗方面卻很少有報道。
本研究選用的自殺性DNA疫苗載體pDREP[12],是由Berglund等基于SFV甲病毒復制子改造的。pDREP載體除了常規DNA疫苗載體所含有CMV真核啟動子、SV40轉錄終止信號和多聚腺苷酸尾外,其主要的特征結構是SFV復制子。SFV復制子由非結構蛋白(nSPs)和26S亞基因組啟動子及結構蛋白組成。用外源的抗原基因取代SFV的結構基因構建自殺性DNA疫苗,疫苗進入細胞后轉錄表達出甲病毒的nSPs,nSPs介導RNA正負鏈的自我復制,從而使插入的外源抗原基因也得到大量的表達。Berglund等[12]發現自殺性DNA疫苗能夠誘導比常規DNA疫苗更強的體液免疫和細胞免疫反應水平,這有利于解決大型動物免疫效果差、免疫劑量高等問題。同時,在自我復制過程中產生的大量的雙鏈RNA(dsRNA)中間體,最終可誘導轉染的細胞凋亡[8],避免了常規DNA疫苗因整合宿主基因引發的隱患。
SAG1是目前研究較多的弓形蟲抗原靶點,被證明具有良好的免疫原性和免疫保護性,據Henrik等報道用編碼SAG1的DNA疫苗免疫小鼠后對強毒株RH株可提供80%~100%免疫保護力[13]。SAG1基因編碼的蛋白,N端含有信號肽,有助于蛋白從胞漿運輸到胞外;C端含有疏水區,被加工切去后,在C端加上一個糖脂錨使蛋白可以定位于膜上[14]。本研究擴增了SAG1基因全長編碼區序列,包含N端信號肽和C端疏水區,表達的SAG1蛋白將以天然構象定位于細胞膜上,有利于APC細胞的攝取并誘導B細胞產生抗體,將比去除信號肽的細胞內型SAG1蛋白能更早地誘導抗體的產生[14]。
肌肉接種是DNA疫苗常用的免疫方式。相比較常規DNA疫苗通常需要100 μg的質粒,本研究只用5 μg的劑量,將自殺性DNA疫苗pDREP-SAG1,采用肌肉接種并聯合瞬時電穿孔[8]這種高效的質粒免疫方式免疫小鼠,結果誘導小鼠產生了抗弓形蟲的特異性抗體,表明弓形蟲自殺性DNA疫苗pDREP-SAG1具有免疫原性。
[1] Pu YH, Wang YH, Wang M, et al. Progress in anti-Toxoplasmagondiidrug and its mechanism[J]. Chin J Zoonoses, 2012, 28(4): 389-392. (in Chinese)
蒲元華, 王艷華, 王萌, 等. 抗弓形蟲藥物及機理研究進展[J]. 中國人獸共患病學報, 2012, 28(4):389-392.
[2] Guo LL, Zhang XL, Zhang JS. Advances in the study of the proteins ofToxoplasmagondiiand nucleic acid vaccines against toxoplasmosis[J]. J Pathog Biol, 2015, 10(10): 961-966. (in Chinese)
郭玲玲, 張曉磊, 張進順. 剛地弓形蟲棒狀體蛋白及其核酸疫苗研究進展[J]. 中國病原生物學雜志, 2015, 10(10):961-966.
[3] Jongert E, Roberts CW, Gargano N, et al. Vaccines againstToxoplasmagondii: challenges and opportunities[J]. Mem Inst Oswaldo Cruz, 2009, 104(2): 252-266.
[4] Wang PY, Li J, Zhu XQ, et al. New development in genetic engineering vaccines againstToxoplasmagondii[J]. Chin J Prevent Vet Med, 2013, 35(3): 251-254. (in Chinese)
王培園, 李結, 朱興全, 等. 弓形蟲基因工程疫苗研究的新進展[J]. 中國預防獸醫學報, 2013, 35(3):251-254.
[5] Qiu CH, Chen KT, Wang YT, et al. The research on safety of DNA vaccine and its optimization[J]. Chin Bullet Life Sci, 2013, 25(9): 858-864. (in Chinese)
邱春紅, 陳開廷, 王永堂, 等. 核酸疫苗的安全性及其優化策略研究[J]. 生命科學, 2013, 25(9):858-864.
[6] Gong WZ, Liu C, Zhang DD, et al. Review on alphavirus-based vectors[J]. Chin J Vet Drug, 2015, 49(4): 65-69. (in Chinese)
龔文芝, 劉燦, 張東東, 等. 甲病毒載體的研究進展[J]. 中國獸藥雜志, 2015, 49(4):65-69.
[7] Wang Y, Yin H. Research progress on surface antigen 1 (SAG1) ofToxoplasmagondii[J]. Parasit Vectors, 2014, 7: 180. DOI: 10.1186/1756-3305-7-180
[8] Johansson DX, Ljungberg K, Kakoulidou M, et al. Intradermal electroporation of naked replicon RNA elicits strong immune responses[J]. PLoS One, 2012, 7(1): e29732-e29738. DOI: 10.1371/journal.pone.0029732
[9] Sonaimuthu P, Ching XT, Fong MY, et al. Induction of protective immunity against toxoplasmosis in BALB/c mice vaccinated withToxoplasmagondiirhoptry-1[J]. Front Microbiol, 2016, 7: 808. DOI: 10.3389/fmicb.2016.00808
[10] Mao XY, Hua QQ, Li XZ, et al. Preparation and identification of polyclonal antibody against small peptides of β-tubulin ofToxoplasmagondii[J]. Chin J Parasitol Parasit Dis, 2014, 32(4): 322-323. (in Chinese)
毛小勇, 華倩倩, 李相志, 等. 抗弓形蟲β微管蛋白小分子抗原肽多克隆抗體的制備及鑒定[J]. 中國寄生蟲學與寄生蟲病雜志, 2014, 32(4):322-323.[11] Qiu Z, Xiang WH. Research progress in Semliki Forest Virus replicon based DNA vaccine[J]. Chin J Vet Sci, 2013, 33(1): 146-149. (in Chinese)
仇錚, 相文華. 塞姆利基森林病毒復制子DNA疫苗研究進展[J]. 中國獸醫學報, 2013, 33(1):146-149.
[12] Berglund P, Smerdou C, Fleeton MN, et al. Enhancing immune responses using suicidal DNA vaccines[J]. Nat Biotechnol, 1998, 16(6): 562-565. DOI: 10.1038/nbt0698-562
[13] Nielsen HV, Lauemoller SL, Christiansen L, et al. Complete protection against lethalToxoplasmagondiiinfection in mice immunized with a plasmid encoding the SAG1 gene[J]. Infect Immun, 1999, 67(12): 6358-6363.
[14] Gong Y, Chen XG, Feng MZ. The construction of recombinant plasmids ofToxoplasmagondiiP30 and the immunoprotective activity of the P30 constructs[J]. Chin J Parasitol Parasit Dis, 2001, 19(5): 26-30. (in Chinese)
龔婭, 陳曉光, 馮明釗. 弓形蟲P30基因重組質粒的構建及其免疫效果[J]. 中國寄生蟲學與寄生蟲病雜志, 2001, 19(5):26-30.
Construction and immunogenicity of a suicidal DNA vaccine with surface antigen SAG1 gene ofToxoplasmagondii
ZHENG Li-na1,2, TAN Feng1, PAN Chang-wang1
(1.DepartmentofParasitology,SchoolofBasicMedicalSciences,WenzhouMedicalUniversity,Wenzhou325035,China;2.SchoolandHospitalofStomatology,WenzhouMedicalUniversity,Wenzhou325035,China)
We constructed a suicidal DNA vaccine pDREP-SAG1 encoding the major surface antigen SAG1 gene ofToxoplasmagondiiand identify its immunogenicity. SAG1 gene (GenBank accession number: HM776940.1) fragment was amplified with PCR from genomic DNA ofT.gondiiRH strain. The PCR product was cloned into an alphavirus replicon-based vector pDREP-eGFP to replace the coding sequence of eGFP. Recombinant plasmid pDREP-SAG1 was confirmed by PCR, restriction enzymes digestion and sequencing. BALB/c mice were injected with the recombinant suicidal DNA vaccine pDREP-SAG1 intramuscularly into quadricep followed by immediate electroporation and boosted with the same condition once at 3-week intervals. Mice received injection with plasmid pDREP-eGFP were used as control. Sera collected from immunized mice were verified by Western blotting withToxoplasmalysate antigen (TLA). Results showed that SAG1 gene of 1 011 bp was amplified from genomic DNA ofT.gondii, and recombinant plasmid pDREP-SAG1 was successfully constructed. Sera collected from plasmid pDREP-SAG1 immunized mice could specifically recognize SAG1 antigen from TLA. The suicidal DNA vaccine pDREP-SAG1 was successfully constructed and showed its immunogenicity to induce specific antibody response in mice.
Toxoplasmagondii; SAG1; suicidal DNA vaccine
Pan Chang-wang, Email: wzpcw@sohu.com
10.3969/j.issn.1002-2694.2016.010.007
潘長旺,Email:wzpcw@sohu.com
1. 溫州醫科大學基礎醫學院寄生蟲學教研室,溫州 325035;
2. 溫州醫科大學口腔醫學院/附屬口腔醫院,溫州 325035
R382.5
A
1002-2694(2016)10-0885-04
2016-07-25;
2016-09-19
浙江省科技廳公益技術研究社會發展項目(No.2014C33161)、溫州市科技局公益項目(No.Y20140665)和浙江省大學生科技創新活動計劃暨新苗人才計劃項目(No.2015R413061)聯合資助
Supported by the Commonweal Project of Science and Technology Department of Zhejiang Province (No. 2014C33161) and the Commonweal Project of Science and Technology Department of Wenzhou City (No. Y20140665), as well as College Students Science and Technology Project and Xinmiao Talents Program of Zhejiang Province (No. 2015R413061)

