淺談國外“Suzuki-Miyaura金屬偶聯(lián)反應”的教學設計思路
李 田 馬鍇果 高 珍 李維紅
(北京大學化學與分子工程學院,基礎實驗教學中心,北京100871)
·國外化學教育·
淺談國外“Suzuki-Miyaura金屬偶聯(lián)反應”的教學設計思路
李田馬鍇果高珍李維紅*
(北京大學化學與分子工程學院,基礎實驗教學中心,北京100871)
Suzuki-Miyaura金屬偶聯(lián)反應是在零價鈀配合物的催化下,芳基硼酸或硼酸酯與鹵代芳烴發(fā)生交叉偶聯(lián)的過程。該反應具有很強的底物適應性和官能團容忍性,廣泛應用于眾多天然產物與有機材料的合成。鑒于反應的重要性,近年來國外高校逐漸嘗試將Suzuki-Miyaura反應引入到本科生的有機實驗教學中。本文針對2000年后Journal of Chemical Education期刊中涉及的Suzuki-Miyaura反應,分別從反應條件、后處理和表征方法、實驗拓展等多個方面進行了比較和歸納,并對其設計理念和教學特色進行了綜述。
Suzuki-Miyaura金屬偶聯(lián)反應;教學實驗設計
www.dxhx.pku.edu.cn
1 Suzuki-Miyaura金屬偶聯(lián)反應的背景介紹
有機化學的魅力在于科學家可以扮演“上帝之手”,獨具匠心地創(chuàng)造分子世界。有機大分子由于其復雜的結構和獨特的功能,一直是有機合成領域的熱點和難點。大分子的合成依賴于大量C―C鍵的構筑,然而碳鍵的穩(wěn)定性為此帶來很大的困難,如何有效地激活碳原子是重構C―C鍵的關鍵。1912年格氏反應的發(fā)現是該領域的第一個里程碑,金屬的插入為研究者提供了全新的思路。然而此反應條件劇烈、需要等物質的量的金屬試劑,同時官能團容忍性較差。隨后出現的鈀催化的交叉偶聯(lián)反應解決了這一問題。通過極少量的鈀催化劑的使用形成碳鈀鍵,使原本惰性的碳原子變得活潑,使反應更容易發(fā)生,并且反應條件更溫和、底物官能團容忍性更好,甚至可以將原本合成中的多步反應簡化為一步反應。該研究為化學家們提供了一款精巧的工具來合成復雜的有機分子,并廣泛應用于制藥、電子工業(yè)和先進材料等領域[1-3]。2010年10月6日,瑞典皇家科學院宣布將2010年諾貝爾化學獎授予美國科學家Richard F.Heck,以及日本科學家Ei-ichi Negishi和Akira Suzuki,以表彰三位科學家在鈀催化交叉偶聯(lián)反應方面的卓越研究[4-6]。圖1是獲獎的三位科學家。

圖1 2010年諾貝爾化學獎獲獎者
在一系列鈀催化的偶聯(lián)反應中,以Suzuki-Miyaura反應條件最溫和,反應最低毒,且應用最廣泛。Suzuki-Miyaura反應最初于1979年由日本北海道大學的Suzuki教授[7]發(fā)現并提出。反應是在零價鈀配合物的催化下,芳基(烯基)硼試劑與鹵代芳烴(烯烴)發(fā)生交叉偶聯(lián)反應,從而實現C(sp2)―C(sp2)單鍵的連接。反應依次經歷氧化加成、轉移金屬化、還原消除三個過程。首先Pd(0)插入到鹵代芳烴中生成Pd(II)絡合物,使原本碳鹵鍵中較為親電的碳原子通過碳鈀鍵的形成而具有親核性,從而大大提高反應活性;隨后在堿的作用下,氧化加成得到的碳鈀鍵與另一分子中的碳硼鍵進行轉金屬反應,將硼上的基團轉移到金屬鈀上;最后通過還原消除的方式形成新的碳碳鍵,獲得的Pd(0)催化劑可繼續(xù)啟動下一次循環(huán)。圖2為反應的示例圖和機理圖。
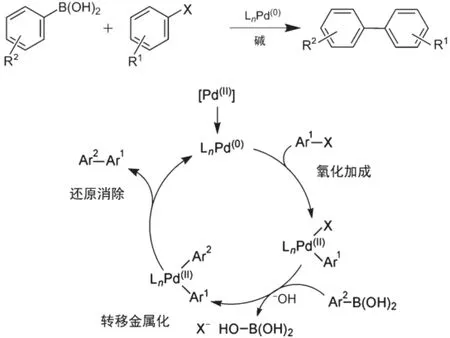
圖2 Suzuki-Miyaura反應的示意圖和機理圖
鑒于金屬催化偶聯(lián)反應在科研中日益發(fā)揮重要的作用,把相關內容引入本科生的有機實驗教學,將有助于豐富學生的知識體系,幫助其了解最前沿的科學研究,并為學生后續(xù)開展科研工作打下扎實的基礎。目前實驗教學中金屬參與的實驗通常只涉及傳統(tǒng)的格氏反應,如何將最新的鈀催化的金屬偶聯(lián)反應,尤其是適合為本科生開設的Suzuki-Miyaura反應引入實驗教學,值得我們認真思考。本文對2000年后發(fā)表在美國化學會Journal of Chemical Education雜志上的9篇相關文獻進行了綜述,以期拋磚引玉,對今后的實驗設計有所指導。
2 國外Suzuki-Miyaura金屬偶聯(lián)反應的教學設計思路
觀察9篇文獻的發(fā)表年份我們發(fā)現,2000年后,關于Suzuki-Miyaura反應的教學設計逐年增多,已引起大家的足夠重視。實驗內容在設計上體現出以下特點:(1)注重知識的整合和傳遞。實驗不僅著眼于訓練學生在金屬催化偶聯(lián)反應方面的操作技能,更著力于拓寬學生的知識視野,授課中以點帶面,讓學生對金屬有機化學形成較為全面的認識和體會。(2)緊隨科研進展,加強教學與科研的銜接。自1979年Suzuki-Miyaura反應被發(fā)現以來,研究者已從多個方面對反應進行了優(yōu)化,包括嘗試以氯代芳烴作為反應底物[8];開發(fā)含氮配體或無配體類催化劑[9];開發(fā)金屬鎳催化劑[10];采用水或離子液體作為反應介質[11];采用現代的微波法提供熱源[12]等。文獻表明,教學設計已不斷地將以上進展融入其中,實現了該領域教學實驗與科學研究的與時俱進。(3)強調環(huán)保理念,重視綠色化學。以下我們將從反應條件、后處理和表征方法、實驗拓展三個方面對9篇教學實驗進行更加詳細的分析和總結,相關的條件與數據列于表1中(為便于說明,我們采用字母對文獻進行了編號)。

表1 Suzuki-Miyaura金屬偶聯(lián)反應在實驗教學中的應用舉例

表1 Suzuki-Miyaura金屬偶聯(lián)反應在實驗教學中的應用舉例(續(xù))
2.1反應條件的選擇
反應條件包括底物、溶劑、催化劑、溫度、反應時間和實驗裝置幾個方面。教學實驗需要確保安全低毒,并在限定的學時內完成。因此,實驗中底物通常選取結構典型、活性較高的化合物,以此保證實驗在較低的溫度和較短的時間內完成。觀察表1的實驗數據我們發(fā)現,教學學時基本都控制在3 h/周,反應溫度除文獻c、h和i外,其余均不高于80°C。此外,為了突出教學重點,實驗中盡量選擇結構簡單、取代較少的反應物,以避免后處理和討論中出現過度復雜、難以分析的情況。9篇文獻中,碘苯、溴苯和苯硼酸作為高頻出現的反應底物,僅取代少量穩(wěn)定的甲基和甲氧基官能團即是例證。在反應溶劑的選取上,一方面?zhèn)鹘y(tǒng)的Suzuki-Miyaura反應通常以THF/DMF等極性有機溶劑作為反應介質,因其對底物具有很好的溶解度和一定的活化度,對提高反應產率有所裨益。而另一方面,有機溶劑的高毒、高污染性也促使大家以水和離子液體作為反應介質,從而使反應邁向綠色化和清潔化。縱觀表1的溶劑類型,兩種思路均有體現。文獻b和i選用傳統(tǒng)的THF和DMF作溶劑,而文獻c、d、e和h中,作者則選擇了水和離子液體,其余文獻則多數選擇介于二者之間的醇為溶劑,兼顧反應活性和綠色特性。
催化劑的選擇結合最新的科研進展,從經典的含膦配體,到最新的含氮配體、無配體類鈀催化劑,以及鎳催化劑均有涉及。文獻a和b選擇科研中最為常用的Pd(PPh3)4,或Pd(OAc)2外加PPh3配體,有利于學生學習經典的反應條件。文獻c、d、f和h選擇無配體類催化劑,目的在于避免膦配體有毒且對空氣不穩(wěn)定的缺點,并簡化反應裝置。文獻e和i采用含氮配體,在降低配體毒性的同時,可提高催化劑的溶解度和催化活性;文獻g則從結構穩(wěn)定、價格低廉的角度出發(fā),以金屬鎳催化劑代替金屬鈀催化劑。
基于不同的催化劑類型,相應有不同的反應裝置。對于無配體、含氮配體類鈀催化劑和鎳催化劑,其在空氣中較穩(wěn)定,因此反應裝置較常規(guī),通常在圓底瓶中進行即可;而對于含膦配體的鈀催化劑,由于膦配體對空氣敏感,因此對反應裝置有一定要求。文獻a采用圓底瓶外加氮氣球的方法將體系與空氣隔離,該方法實驗裝置簡單,常規(guī)的教學實驗室均可滿足條件,但僅適用于高活性高產率的快速反應。文獻b則引入了科研中通用的Schleck技術,采用Schleck瓶,并配合雙排管、油泵和氮氣鋼瓶,可以嚴格地創(chuàng)造體系的惰性氣氛。該方法雖然操作流程較為復雜,但對于嚴格的無氧反應十分適用。比Schleck瓶更為高級和昂貴的裝置,文獻b也予以采用,文獻中,主講教師引入了先進的全自動工作站,該工作站可以同步進行16個對照實驗,反應結果直接進入工作站自備的氣相色譜(GC)進行分析,在確保無氧條件的同時,可以短時間實現對最優(yōu)實驗條件的篩選。具體的裝置如圖3所示。與其他教師希望簡化裝置、盡量適應于基礎實驗室的資源配置不同,文獻b中,作者希望將學術界和工業(yè)界中最先進的儀器予以介紹,以幫助學生更好地融入今后的科研工作。與上述傳統(tǒng)的加熱方式不同,文獻h另辟蹊徑,將近年來新興的微波法引入實驗教學,以幫助學生了解區(qū)別于傳統(tǒng)的電熱套和電磁攪拌器的全新能量供給來源。

圖3 Suzuki-Miyaura教學實驗的反應裝置[14]
2.2后處理和表征方法的選擇
區(qū)別于9篇文獻在反應條件方面的各具特色,后處理過程基本大同小異,均采用了基礎有機實驗中的常規(guī)方法。例如文獻a、d和f配合以常規(guī)的有機溶劑,以萃取、濃縮和柱色譜的方法對產物進行了分離。文獻c和e在經典操作的基礎上,引入綠色化學的理念,以重結晶作為純化手段,并以無毒或低毒的水和醇代替有機溶劑,為學生提供更加安全的實驗環(huán)境。文獻b和i相對較為特殊,沒有經過后處理過程而直接將產物的粗品進行GC分析,直接對反應產率進行了核算。
產物的結構表征同樣采用基礎有機實驗中的常用方法。以薄層色譜法對反應進程和產物純度進行監(jiān)測,配合熔點儀、紅外光譜、核磁氫譜和碳譜對產物的結構和純度做進一步分析。個別反應以GC作為表征手段。采用常規(guī)方法進行表征的優(yōu)勢在于方便在兄弟高校中推廣和應用。
2.3實驗內容的拓展
在學時允許的條件下,教師也盡可能地豐富實驗內容,以幫助學生串聯(lián)更多的知識點,對相關領域有更加全面深入的理解。本文中,有4篇文獻將“有機方法學”引入了實驗教學,例如文獻b選用了8種不同的溶劑和不同的反應時間,并比較了它們的產率;文獻d中,作者通過改變溶劑體系,讓學生比較水、丙酮和離子液體對產率的影響;文獻i則對催化劑和反應時間進行了變化,引導學生分析dupont′s配體相較于膦配體的優(yōu)勢,并了解反應時間對產率的影響,具體條件如圖4所示。類似的設計有助于引導學生理解反應的發(fā)展歷程,對于培養(yǎng)學生的科研思維大有裨益。需要指出的是,考慮到教學學時的限制,在實際教學中,每位學生只負責其中一組實驗條件的摸索,實驗結束后學生將所有結果和數據匯總,并在討論環(huán)節(jié)集體分析。該設計思路不僅保證了學生實驗的獨立性和探索性,而且提高了整體的實驗效率,值得借鑒和推廣。
在結構表征的環(huán)節(jié),區(qū)別于其他文獻僅采用薄層色譜和核磁共振等傳統(tǒng)方法,文獻b增加了熒光表征技術(圖5(1))。底物設計上,作者引入了稠環(huán)芳香化合物溴代芴,隨著反應的進行,體系中逐漸生成芳香大π共軛產物,當用紫外燈對反應瓶進行照射時,即可觀察到藍色熒光從無到有,且亮度不斷增強。該設計不僅增加了實驗的豐富性和趣味性,而且可以在后續(xù)的討論中延伸出光譜的相關知識,有利于完善學生的知識體系。
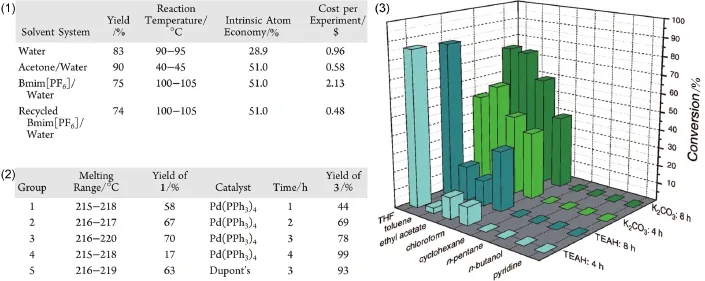
圖4 Suzuki-Miyaura反應教學實驗中的條件優(yōu)化[14,16,21]

圖5 Suzuki-Miyaura反應的熒光表征和理論計算[14,18]
如果說大部分文獻著重于實驗設計和開展的階段,那么文獻f則走得更遠。作者將Gaussian計算引入到實驗教學(圖5(2)),理論計算與實驗論證巧妙結合,在拓展學生技能的同時,加深了學生對于實驗現象的理解,并對理論化學的進展有所了解。教師指導學生采用密度泛函理論(DFT)對不同鹵素取代的碳鹵鍵的鍵能進行了計算,并引導學生分析了Suzuki-Miyaura反應中鹵素取代基反應活性差別的根源所在;而對于學生“聯(lián)苯是平的”這一錯誤的思維定勢,教師同樣引導學生進行了理論計算,通過結構優(yōu)化得到了聯(lián)苯的扭曲構象,給予了學生強烈直觀的認知沖擊。實驗結果與理論計算相互結合,是目前科研中常用的研究思路,然而在教學實驗中并不多見。文獻f進行的設計是很好的嘗試,值得我們借鑒。
3 總結與展望
Suzuki-Miyaura反應作為構筑C(sp2)―C(sp2)單鍵的精巧手段,自1979年發(fā)現以來,以其良好的底物兼容性、溫和的反應條件和高效的反應性能,在藥物和材料合成等領域發(fā)揮著重要的作用。為了更好地銜接實驗教學與學生今后的科研工作,在基礎有機實驗室引入Suzuki-Miyaura反應具有一定的現實意義。本文綜述了2000年后發(fā)表在Journal of Chemical Education雜志上的9篇相關文獻,從反應條件、后處理和表征方法、實驗拓展三個方面對其實驗內容和設計思路進行了詳細的討論和總結。實驗設計以經典的Suzuki-Miyaura反應為核心,以點帶面,使學生緊隨科學研究的前沿,形成了完整的知識脈絡,深入理解了過渡金屬催化的交叉偶聯(lián)反應的背景、機理和應用,掌握了無氧反應的一系列操作流程,并具備了一定的綠色化學的理念和科學研究的思路。以上經驗和思路對于我們今后的實驗設計具有一定的參考和指導意義。
[1]Nicolaou,K.C.;Ramanjulu,J.M.;Natarajan,S.;Br?se,S.;Rübsam,F.Chem.Commun.1997,No.20,1899.
[2]Huo,L.;Hou,J.;Zhang,S.;Chen,H.;Yang,Y.Angew.Chem.Int.Edit.2010,49,1542.
[3]黃春輝,李富友,黃維.有機電致發(fā)光材料與器件導論.上海:復旦大學出版社,2005.
[4]陳垚,賴文勇,解令海,黃維.科學通報,2011,56(13),995.
[5]張韶光,張文雄.大學化學,2010,25(6),1.
[6]肖唐鑫,劉立,強琚莉,王樂勇.自然雜志,2010,32(6),332.
[7]Miyaura,N.;Yamada,K.;Suzuki,A.Tetrahedron Lett.1979,20(36),3437.
[8]Saito,S.;Sakai,M.;Miyaura,N.Tetrahedron Lett.1996,37(17),2993.
[9]Littke,A.F.;Fu,G.C.Angew.Chem.Int.Edit.2002,41,4176.
[10]楊柳波,王利民,劉煉,潘笑娟.化工進展,2007,26(5),615.
[11]劉寧,劉春,金子林.有機化學,2012,32,860.
[12]Larhed,M.;Hallberg,A.J.J.Org.Chem.1996,61,9582.
[13]Callam,C.S.;Lowary,T.L.J.Chem.Educ.2001,78,947.
[14]Hoogenboom,R.;Meier,M.A.;Schubert,U.S.J.Chem.Educ.2005,82,1693.
[15]Aktoudianakis,E.;Chan,E.;Edward,A.R.;Jarosz,I.;Lee,V.;Mui,L.;Thatipamala,S.;Dicks,A.P.J.Chem.Educ.2008,85,555.
[16]Costa,N.E.;Pelotte,A.L.;Simard,J.M.;Syvinski,C.A.;Deveau,A.M.J.Chem.Educ.2012,89,1064.
[17]Hamilton,A.E.;Buxton,A.M.;Peeples,C.J.;Chalker,J.M.J.Chem.Educ.2013,90,1509.
[18]Hill,N.J.;Bowman,M.D.;Esselman,B.J.;Byron,S.D.;Kreitinger,J.;Leadbeater,N.E.J.Chem.Educ.2014,91,1054.
[19]Hie,L.;Chang,J.J.;Garg,N.K.J.Chem.Educ.2015,92,571.
[20]Soares,P.;Fernandes,C.;Chavarria,D.;Borges,F.J.Chem.Educ.2015,92,575.
[21]Oliveira,D.G.M.;Rosa,C.H.;Vargas,B.P.;Rosa,D.S.;Silveira,M.V.;Moura,N.F.D.;Rosa,G.R.J.Chem.Educ.2015,92,1217.
A Brief lntroduction to Suzuki-Miyaura Coupling Reaction in Organic Lab Abroad
LI TianMAKai-GuoGAO ZhenLI Wei-Hong*
(Experimental Chemistry Center,College of Chemistry and Molecular Engineering,Peking University,Beijing 100871,P.R.China)
Suzuki-Miyaura reaction is a coupling process of aryl boric acid(boron ester)and aryl halide that catalyzed by palladium(0).The reaction shows well tolerance for various functional groups and is wildly applied in syntheses of natural products and organic materials.Recently,colleges abroad tried to introduce this reaction into the undergraduate organic lab.This paper collected the literatures in Journal of Chemical Education about the Suzuki-Miyaura reaction since 2000 and gave an overview.
Suzuki-Miyaura coupling reaction;Experimental design
G64;O6-3
10.3866/PKU.DXHX201602011
,Email:litian@pku.edu.cn

