貴州遵義地區蝙蝠腦組織博爾納病病毒磷蛋白的檢測
楊利玲 雷以會 徐 平
(遵義醫學院第一附屬醫院,遵義,563000)
貴州遵義地區蝙蝠腦組織博爾納病病毒磷蛋白的檢測
楊利玲 雷以會 徐 平
(遵義醫學院第一附屬醫院,遵義,563000)
修回日期:2015-12-05
發表日期:2016-05-10
蝙蝠;
博爾納病病毒(Borna disease virus,BDV)最早發現于19世紀德國的Borna鎮,是一種新型的傳染病病毒。該病毒曾引起當地戰馬中爆發一類致死性的腦炎,主要臨床癥狀為精神行為異常(姿勢步態異常,動作減少或多動,震顫、四肢抽動等)。BDV為嚴格嗜神經性的RNA病毒,其主要自然感染宿主為馬和羊,隨著對BDV研究的深入,發現BDV有著更廣泛的自然感染宿主,也能感染人類發生神經精神類疾病。BDV基因組中包含6個開放閱讀框,其中ORFⅠ、ORFⅡ包含的序列相對保守,變異性更小,成為檢測病毒感染的特異性指標。目前發現在感染脊椎動物的16個RNA病毒科中,至少有9個與蝙蝠相關[1]。最近肆虐西非的埃博拉病毒、上世紀末馬來西亞的尼帕病毒、澳大利亞的亨德拉病毒以及SARS病毒都已經被證實其真正的自然宿主為蝙蝠[2]。蝙蝠是哺乳動物中唯一能飛行的動物,并且有些種類蝙蝠的壽命可以超40 a,為病毒的傳播創造了有利條件。隨著城市的擴張以及部分蝙蝠在城市中定居,使人和蝙蝠之間接觸機會不斷增加。故本實驗選取BDV ORFⅡ編碼的磷蛋白為檢測對象,應用蛋白免疫印跡法(western blotting,WB)檢測貴州省遵義地區蝙蝠腦組織BDV磷蛋白(Borna disease virus phosphoprotein,BDV-P),旨在了解蝙蝠是否為BDV的自然感染宿主,結合前期工作分析BDV的分子流行病學特征,為了解和預測潛在的博爾納病爆發和流行的可能性奠定基礎。
1 實驗材料與方法
1.1 實驗材料
2014年5~9月之間,收集貴州省遵義市綏陽地區野生蝙蝠82只,取蝙蝠額顳葉腦組織放入去酶的1.5 mL EP管,依次編號。并立即放于-80℃的超低溫冰箱保存。采集過程中嚴格按照無菌操作收集標本,避免樣品間交叉污染。
1.2 主要儀器和試劑
兔源BDV-P24多克隆抗體,堿性磷酸酯酶(Alkaline phosphatase,AP)標記的羊抗兔多克隆抗體(由重慶醫科大學神經學實驗室提供)。
1.3 實驗方法
1.3.1 提取蛋白
每份腦組織標本稱取100 mg于EP管中,按每100 mg腦組織加入500 mL蛋白提取液,每1 mL Lysis Buffer加入1μL蛋白酶抑制劑、10 μL磷酸酶抑制劑、10 μL苯甲基磺酰氟(Phenylmethanesulfonyl fluoride,PMSF),充分振蕩混勻后冰上保存、分裝。待標本與蛋白裂解液充分接觸后在超聲細胞裂解儀上充分裂解,此步驟在冰上操作,直至為均勻的混合液為止。高速低溫離心機140 000 bpm 15 min,上清液即為所得的蛋白質。
1.3.2 二喹啉甲酸(Bicinchoninic acid,BCA)法測蛋白濃度及蛋白定性
抽取5份蛋白質樣品,按BCA法進行蛋白定量,根據標準曲線計算樣品的蛋白濃度。每份樣品取50 μL,按1∶3的比例加入1×Loading Buffer,充分振蕩混勻后放在恒溫器上變性,100℃ 10 min,變性后-20℃冰箱保存。
1.3.3 確定最佳抗體稀釋濃度
將OL/BDV細胞裂解抗原分別與不同稀釋濃度的BDV-P24兔多克隆抗體(一抗)(1∶500、1∶1 000、1∶1 500、1∶2 000)和AP標記的羊抗兔IgG(二抗)(1∶2 500、1∶5 000、1∶10 000)交叉反應,根據發光結果,確定最佳稀釋濃度。
1.3.4 WB檢測BDV磷蛋白
將提取的樣品蛋白經12% SAS-PAGE電泳,同時加入陽性蛋白標本(由重慶醫科大學神經病學實驗室惠贈)作為陽性參照物。采用“三明治”形式進行半干轉,將蛋白轉移至固相載體(PVDF膜)上,轉膜完全后將PVDF膜放入5%的脫脂牛奶中進行封閉。與BDV-P24兔多克隆抗體按最佳稀釋濃度進行一抗孵育,4℃過夜(孵育時間大于15 h)。PBST快速洗滌3次,每次15 min,將AP標記羊抗兔IgG按最佳稀釋濃度行二抗孵育,室溫下孵育2 h。PBST充分洗滌3次,每次15 min。最后按從弱到強滴加發光劑,反應5 min。曝光,掃描保存。
2 結果
2.1 按BCA法根據標準曲線確定樣品蛋白濃度,其相關系數為0.999,樣品蛋白的濃度約為1 μg/μL。
2.2 將BDV感染的OL裂解細胞抗原與不同濃度BDV-P24兔多克隆抗體(一抗)和AP標記羊抗兔IgG(二抗)進行交叉反應的WB方法確定最佳稀釋濃度,一抗和二抗的最佳稀釋濃度分別為1∶1 000和1∶5 000。
2.3 82只野生蝙蝠腦組織中BDV磷蛋白陽性9例(陽性率為11%),發光結果見圖1。
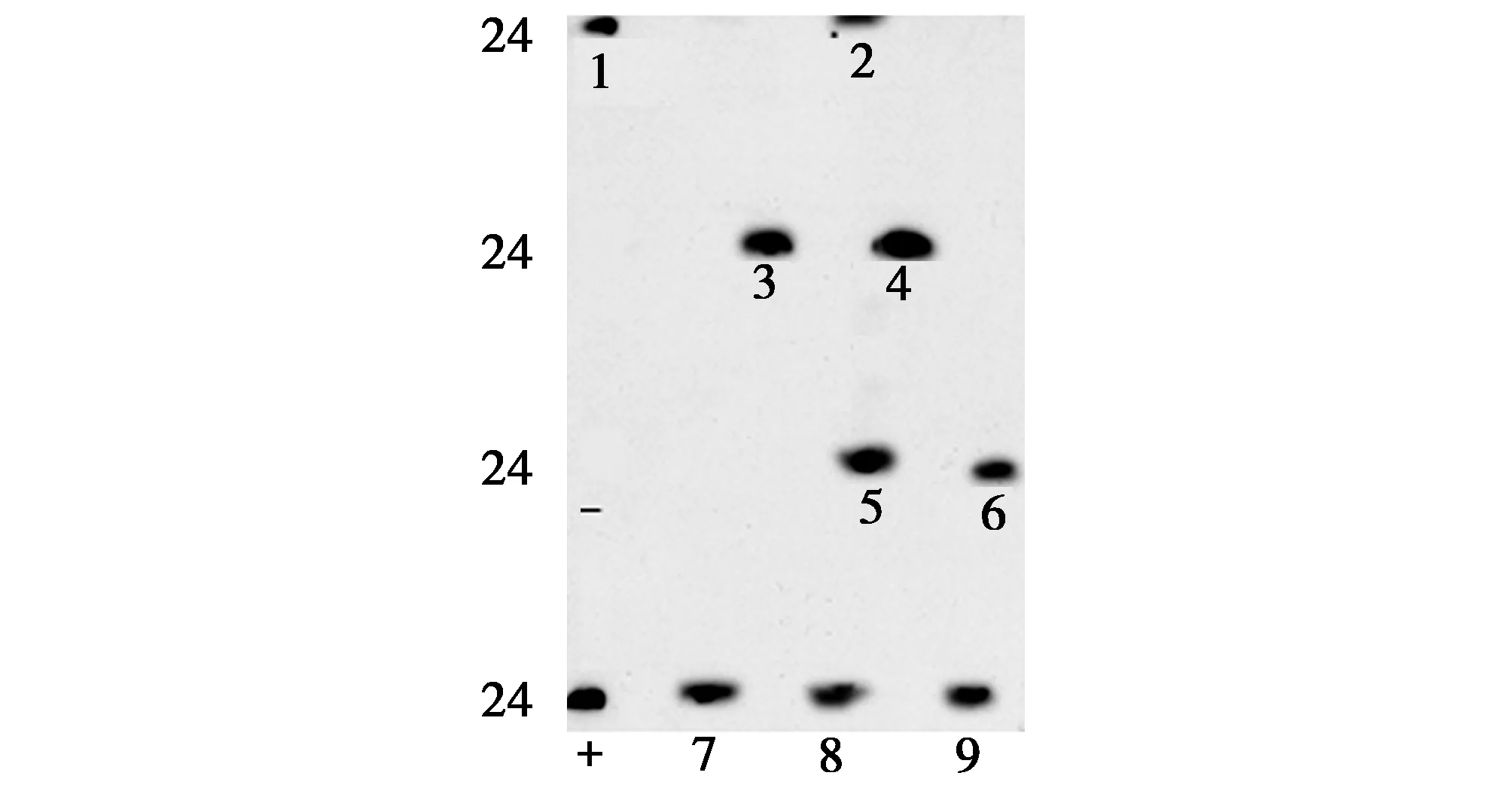
圖1 蝙蝠腦組織BDV磷蛋白WB曝光結果(+為陽性對照,-為陰性對照,1~9實驗標本)Fig 1.The results of western blot BDV phosphoprotein in bat brain tissue.(+ was positive control,-was negative control,1-9 were test specmens)
3 討論
博爾納病病毒(borna diseaase virus,BDV)為含有包膜未分節段的單股負鏈RNA病毒,是目前博爾納病毒屬、博爾納病毒科中唯一的成員,其復制和轉錄都在細胞核內進行,目前結合博爾納病毒的系統樹分析以及生物學特征表面博爾納病毒屬至少有5個種類:Ⅰ、哺乳動物類BDV-1,包括傳統的博爾納病毒和流行株NO/98;Ⅱ、鸚鵡類BDV-1,包括鳥以及鸚鵡類BDV-1、2、3、4、7;Ⅲ、雀形類BDV-1:包括鳥以及亞尼沙愛金絲雀BDV-L1、L2、L3、LS;Ⅳ、雀形類BDV-2:梅花雀BDV EF;Ⅴ、水禽BDV-:鳥BDV 062CG[3]。BDV地理分布較廣泛,遍及日本、澳大利亞、伊朗、意大利、瑞士、德國、土耳其等均有關于BDV感染動物或人的相關報道[4]。2010年研究者Horie和Belyi[5-6]在人和其他脊椎動物中發現了EBL(endogenization borna like,EBL)基因序列,在部分微型蝙蝠中也發現了EBL-N、EBL-L、EBL-M基因序列。EBL基因序列與BDV已知的標準株基因序列相似性達40%以上,而且Kinnunen[7]認為EBL基因序列特別是EBL-N基因序列可以使一類物種更有機會成為BDV攜帶者。可能蝙蝠在BDV流行病學中也扮演重要的角色。
本實驗采用WB方法檢測貴州省遵義市綏陽地區野生蝙蝠腦組織中是否表達BDV-P,發現9例(9/82)標本陽性,陽性率11%,表明遵義綏陽地區的蝙蝠可能為BDV自然感染攜帶者,與學者Horie的研究結果相吻合。結合前期本課題組成員王長明[8]采用FQ-nRT-PCR方法對遵義地區山羊PMBC中的BDV-P24基因片段、劉海軍[9-10]用FQ-nRT-PCR對遵義及周邊地區牛群中PMBC中的BDV-P24基因片段的檢測以及用ELISA檢測貴州部分地區病毒性腦炎、吉蘭-巴雷綜合癥等神經系統疾病患者中血清中BDV抗原、特異性抗體以及抗原-抗體免疫復合物,說明遵義地區可能為BDV流行地區之一。本實驗以蝙蝠腦組織BDV-P為檢測對象,其陽性率明顯高于前期成員檢測PBMC中BDV-RNA研究結果,一方面可能由于腦組織中BDV相關蛋白過量表達,另一方面可能由于在PBMC中病毒RNA復制低或者已降解的RNA[11]。
近年來文獻報道BDV出現許多新的自然感染宿主,如蝙蝠、嚙齒動物以及食蟲類[12]。但感染BDV動物的耐受機制以及感染途徑仍不清楚,但研究者通過實驗證明BDV極有可能是通過嗅神經、三叉神經或者是舌咽神經進行傳播,也能通過被感染動物的分泌物進行傳播。Okamoto等[13]研究者實驗性的感染小鼠發現BDV即可以水平傳播,也能垂直傳播。有研究報道認為BDV感染可能為動物源性,BDV可以從感染BDV的動物向人類傳播,人類與蝙蝠同屬于哺乳動物,古老的病毒可能在人和蝙蝠的細胞膜上都有相應的病毒受體[14-15],這樣人類和蝙蝠都有可能成為BDV感染的攜帶者。遵義綏陽地區林業較為發達,蝙蝠活動范圍較大,蝙蝠分泌物可能會污染當地農作物間接傳播給人類,走訪當地人生活習慣,發現他們主要是自給自足,并且有一部分人曾食蝙蝠,使當地居民感染BDV的概率大大增加。
總而言之,貴州遵義綏陽地區蝙蝠可能為BDV的自然感染宿主,因此,本研究結果豐富了貴州省BDV分子流行學資料,有助于對潛在的BDV感染爆發流行做好防范工作。但由于收集標本的局限性以及樣本數量較少,后續研究還需擴大樣本量以及多地區的收集標本,以及了解其他可能攜帶BDV的物種。
[1] 李志峰,俞守義,吳毅.廣西嶺景鎮某山村蝙蝠攜帶 SARS 樣冠狀病毒及狂犬病毒的調查研究[J].醫學動物防制,2007,23(10):721-723.
[2] Rodhain E.Bats and viruses:complex relationship[J].Bulletin de la Societe de Pathologie Exotique(1990),2015,108(4):272-289.
[3] Kuhn J H,Durrwald R,Bao Y,et al.Taxonomic reorganization of the family Bornaviridae[J].Archives of Virology,2015,160(2):621-632.
[4] Kinnunen P M,Palva A,Vaheri A,et al.Epidemiology and host spectrum of Borna disease virus infections[J].Journal of General Virology,2013,94(Pt 2):247-262.
[5] Horie M,Honda T,Suzuki Y,et al.Endogenous non-retroviral RNA virus elements in mammalian genomes[J].Nature,2010,463(7277):84-87.
[6] Belyi V A,Levine A J,Skalka A M.Unexpected inheritance:multiple integrations of ancient bornavirus and ebolavirus/marburgvirus sequences in vertebrate genomes[J].PLoS Pathogens,2010,6(7):e1001030.
[7] Kinnunen P M,Palva A,Vaheri A,et al.Epidemiology and host spectrum of Borna disease virus infections[J].Journal of General Virology,2013,94(Pt 2):247-262.
[8] 王長明,徐平,葛均江,等.貴州遵義地區山羊Borna病毒P24基因片段的檢測[J].中國人獸共患病學報,2009,25(2):149-151.
[9] 劉海軍,王長明,謝婷婷,等.貴州省及部分周邊地區牛博爾納病病毒感染的情況調查[J].重慶醫學,2011,40(32),3296-3299.
[10] 劉海軍,謝祖勤,郭霞,等.貴州部分地區精神分裂癥患者血清PBMC博爾納病病毒CIC及抗體的檢測[J].貴州醫藥,2015,39(3):203-206.
[11] Zhang L,Wang X,Zhan Q,et al.Evidence for natural Borna disease virus infection in healthy domestic animals in three areas of western China[J].Archives of Virology,2014,159(8):1941-1949.
[12] Nobach D,Bourg M,Herzog S,et al.Shedding of infectious Borna disease virus-1 in living bicolored white-toothed shrews[J].PLoS One,2015,10(8):e0137018.
[13] Okamoto M,Hagiwara K,Kamitani W,et al.Experimental vertical transmission of Borna disease virus in the mouse[J].Archives of Virology,2003,148(8):1557-1568.
[14] Rackova S,Janu L,Kabickova H.Borna disease virus(BDV)circulating immunocomplex positivity in addicted patients in the Czech Republic:a prospective cohort analysis[J].BMC Psychiatry,2010,10(1):70.
[15] Teplitsky V,Pitlik S,Richt J A,et al.Increased prevalence of Borna disease virus ELISA and immunofluorescent antibodies in horses from farms situated along the paths of migratory birds[J].Israel Journal of Veterinary Medicine,2003,58(2/3):80-85.
Bats;BDV;Phosphoprotein;Western blot
DectionofBornaDiseaseVirusPhosphoproteininBrainTissueofBatsinZunyiRegion,GuizhouProvince
YangLilingLeiYihuiXuPing
(TheAffiliatedHospitalofZunyiMedicalCollege,Zunyi,563000,China)
To investigate the status of Borna disease virus(BDV)natural infection in wild bats,we use the western blotting method to detect the phosphoprotein expression of BDV in 82 wild bat brain tissue specimens collected from the Zunyi region of Guizhou Province.Result showed that 9 of 82 specimens were phosphoprotein positive,which indicated that BDV natural infection exists in the bats in Zunyi region of Guizhou Province.
稿件運行過程
2015-10-29
BDV;
磷蛋白;
蛋白免疫印跡;
S858.9
A
2310-1490(2016)02-126-03
研究貴州省遵義地區野生蝙蝠腦組織中BDV自然感染情況。方法:采用蛋白免疫印跡檢測貴州省遵義地區82只野生蝙蝠腦組織中BDV磷蛋白表達情況。結果:82只蝙蝠腦組織中BDV磷蛋白陽性9例(11%)。結論:貴州省遵義地區蝙蝠存在BDV自然感染。
國家自然科學基金,神經疾病與Borna病癥毒感染的相關性研究
楊利玲,女,25歲,碩士研究生;主要從事中樞神經系統感染研究。E-mial:18798680327@163.com

