低溫脅迫下東北林蛙GLUT1轉錄表達水平的動態變化
郭柏宏肖向紅鞏珊珊張晶鈺柴龍會
(東北林業大學,哈爾濱,150040)
低溫脅迫下東北林蛙GLUT1轉錄表達水平的動態變化
郭柏宏 肖向紅鞏珊珊 張晶鈺 柴龍會
(東北林業大學,哈爾濱,150040)
葡萄糖轉運體1;
東北林蛙(Ranadybowskii)主要分布在我國東北部,季節性的低溫環境使東北林蛙具有高效的抗凍策略,形成高濃度的葡萄糖保護劑是重要的抗凍機制之一。GLUT1是機體細胞中分布最廣泛葡萄糖轉運蛋白。本實驗采用高通量測序技術獲得東北林蛙GLUT1 mRNA片段,通過實時熒光定量PCR技術分析低溫脅迫下(-1℃)東北林蛙隨脅迫時間延長,其肝臟、骨骼肌、心臟、脂肪、皮膚組織中GLUT1轉錄水平的表達變化。結果發現,肝臟和心臟的GLUT1在低溫脅迫24 h達到峰值,分別為對照組的9.17倍和5倍;脂肪體和骨骼肌的GLUT1轉錄水平于48 h達到峰值,為對照組的7.2倍;GLUT1在皮膚中沒有顯著變化。結果表明,GLUT1參與東北林蛙低溫脅迫下的應激反應,并在形成細胞高濃度葡萄糖方面發揮著重要作用。
東北林蛙(Ranadybowskii)主要分布于我國東北部、朝鮮、日本及俄羅斯等地。由于此地處亞寒帶,冬季氣候寒冷干燥,年平均溫度達到0℃以下,作為兩棲類變溫動物,東北林蛙越冬時要面臨嚴峻的低溫威脅和生存壓力,因此在環境溫度過低時會通過冬眠降低機體代謝水平,維持生命[1-2]。其中,體內形成高濃度的葡萄糖作為抗凍保護劑是機體重要的抗凍保護機制之一,它在減少細胞水分流失,降低冰晶形成,防止細胞塌陷,穩定細胞膜和膜內大分子起到重要作用[3-6]。
葡萄糖轉運體1(glucose transporter protein 1,GLUT1),是哺乳動物中轉運葡萄糖跨膜運輸重要的載體蛋白,糖轉運體蛋白家族(GLUTs)是促進己糖跨膜運輸的一系列蛋白,GLUTs家族中共有14名成員GLUT(1-14),每一個成員都分別對不同的己糖有特異性的親和能力、特異性的組織分布、亞細胞定位以及生理功能。GLUT1是一種膜蛋白,在哺乳動物中基本結構由 12個跨膜片段組成,可以順濃度差將細胞外的葡萄糖運送至細胞內部[7]。GLUT1是目前已知分布最廣的GLUT家族的葡萄糖轉運體,在各個組織器官都有不同程度的表達。在人體中主要表達于紅細胞,血腦屏障,表皮細胞等[8]。
目前GLUT1的研究主要是見于哺乳動物和人的腫瘤及糖尿病方面[9],對于兩棲類低溫環境下葡萄糖作為機體抗凍保護劑的相關機制研究還很少。本實驗通過對低溫脅迫下GLUT1基因表達水平分析為兩棲類抗凍保護劑的形成提供證據,同時也為GLUT1的功能性研究提供新的視角。
1 實驗材料與方法
1.1 實驗動物
東北林蛙,健康成年雄性36只,采集于黑龍江省鐵力林場,體重(22±2)g。其中實驗組18只,對照組18只。飼養在通氣良好的容器中,容器中加入適量活性碳處理的水,以不沒過蛙身高度為準。將蛙放置于4℃環境中適應2周,同時設實驗對照組。
1.2 低溫模型的建立
將在4℃的東北林蛙置于-1℃溫控冰箱馴養45 min后,開始計時低溫脅迫。分別于4 h、8 h、12 h、24 h、48 h和72 h組織樣本采集,每個時間點分別隨機取樣3只。采用雙毀髓法迅速取其肝臟、心臟、骨骼肌、皮膚和脂肪體樣本,-80℃保存備用。
1.3 總RNA的提取和cDNA的合成
將組織用去酶的剪刀剪碎,加入TRIzol?Reagent(ambion,USA)1 000mL,勻漿,具體步驟按照TRIzol?Reagent說明書操作。總RNA濃度與完整性通過分光光度計和2%瓊脂糖凝膠電泳檢測。總RNA-80℃保存備用。cDNA的合成用ReverTra Ace?qPCR RT Master Mix with gDNA Remover(TOYOBO,Japan)反轉錄試劑盒完成,具體操作以說明書為準,cDNA保存于-20℃。
1.4 實時熒光定量PCR
1.4.1 引物設計
東北林蛙GLUT1序列片段由高通量測序獲得(由華大基因測序分析),東北林蛙GLUT1引物由Beacon Designer 7軟件完成(表1)。通過RT-PCR和標準曲線選擇適合的引物。按照2x Taq Master Mix(TIANGEN,Beijing)說明書進行PCR反應,模版為反轉錄實驗合成的cDNA。PCR條件:94℃ 2 min變性;94℃ 30 s,55℃ 30 s,72℃30 s,共30個循環擴增;72℃ 5 min 延伸。得到的PCR產物進行瓊脂糖凝膠電泳檢測。
1.4.2 標準曲線的繪制
將得到清晰的單一且片段大小正確的條帶進行qPCR標準曲線的繪制。qPCR儀器及分析選用CFX96 Touch Real-Time PCR Detection System(Bio-Rad,Hercules,CA)。以反轉錄實驗獲得的cDNA為模版,進行梯度稀釋,按10倍稀釋成4個梯度。相關酶試劑采用2x SuperReal Premix Plus(TIANGEN,Beijing)熒光定量試劑盒,實驗操作以說明書為準。實驗條件采用兩步法,95℃ 15 min 變性;95℃ 10 s,60℃ 30 s,40個循環,退火和延伸。在每次的延伸后進行熒光檢測,將收集到的數據作為Cq值,進行標準曲線的繪制,保證E=85%~105%,R2>0.980。選取符合條件的引物進行實時熒光定量PCR實驗,具體步驟如熒光定量試劑盒說明書所示,內參基因選用GAPDH。其中每個qPCR反應孔做3次重復,每個時間點做3次獨立樣本重復。
1.4.3 數據處理及分析
將實時熒光定量PCR數據通過Livak(2-ΔΔCq)方法對實驗組和對照組進行處理。最終的數據分析通過SPSS19.0軟件,置信區間設為0.05,實驗數據用均值±標準差(圖2)。SPSS 19.0 分析軟件進行單因素方差分析,通過t檢驗,P<0.05 為差異顯著。
2 結果
2.1 GLUT1引物的選擇及標準曲線的建立
通過引物篩選,內參基因GAPHD和GLUT1的引物PCR結果及繪制標準曲線,溶解曲線結果如下(表1,圖1)。
表1熒光定量PCR引物GAPDH和GLUT1
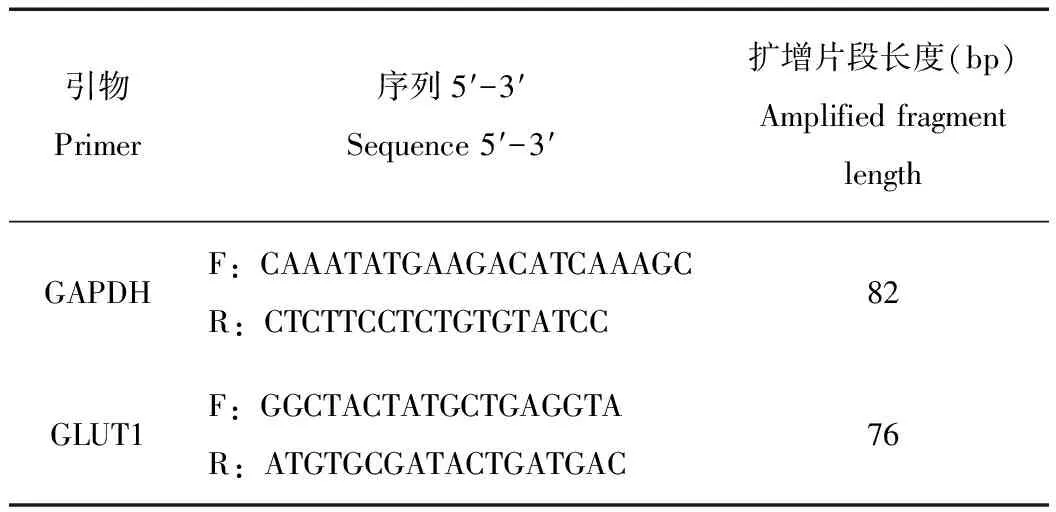
Tab.1 The primers of GAPDH and GLUT1 for qPCR
2.2 低溫脅迫下東北林蛙中GLUT1mRNA表達水平的變化
在低溫-1℃脅迫下,肝臟的GLUT1mRNA表達水平逐漸升高,脅迫24 h后顯著升高為對照組的9.17倍(P<0.01),48 h后其表達水平逐漸降低。心臟的GLUT1mRNA表達水平上調,12~24 h表達量達高峰,為對照組的5倍(P<0.05),48 h后開始降低,72 h降低為對照組的0.5倍。脂肪體的GLUT1mRNA表達水平在最初脅迫的24 h無顯著變化,48 h則顯著升高,為對照組的7.2倍,72 h降至初始水平。骨骼肌的GLUT1 mRNA表達水平在4~8 h逐漸升高為對照組的4.3倍,12~24 h降低為對照組的2倍,48 h后GLUT1 mRNA表達水平又上調達峰值,為對照組的7.9倍(P<0.01),72 h恢復為初始表達水平的2.3倍。皮膚的GLUT1mRNA總體呈上調表達趨勢,為對照組的2~3倍,僅8 h降低至對照組水平的0.4倍。

圖1 GLUT1在qPCR中的溶解曲線Fig.1 The melt curve of GLUT1by qPCR
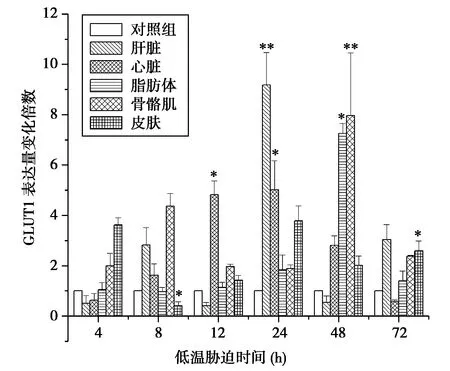
圖2 低溫脅迫下東北林蛙不同組織GLUT1mRNA表達變化內參基因為GAPDH(* P<0.05,** P<0.01)Fig.2 The expression of GLUT1 mRNA during cold exposure in Rana dybowskii The corresponding tissues were liver,heart,fat body and skin. GAPDH as the reference (* P<0.05,** P<0.01)
3 討論
兩棲類耐寒機制的研究始于上世紀八十年代[10],Joanisse在研究Ranasyivatica中發現在低溫環境下兩棲動物通過精確的代謝調節避免細胞外液結冰。目前耐寒性動物有兩種主要的抗凍機制,一種是機體轉換為低代謝狀態,通過抑制某些生化過程,降低能量損耗,從而保護機體免受低溫損傷[11];另一種通過體內合成高濃度的抗凍保護劑,最常見的為甘油和葡萄糖[12]。Storey研究發現在低溫脅迫下美洲樹蛙主要器官的葡萄糖含量增加到150~300 mM,為機體初始水平的30~50倍[6,13]。
GLUT1是一種特異性轉運葡萄糖的載體蛋白,分布廣泛,為細胞轉運葡萄糖,提供細胞代謝所需的能量。因此我們推測,GLUT1的上調表達是細胞內形成高濃度的葡萄糖保護劑的重要機制。本實驗發現,肝臟、心臟、骨骼肌、脂肪體和皮膚中的GLUT1在低溫脅迫下的mRNA表達水平呈上調趨勢。其中,在低溫脅迫初期(4~12 h)上調表達最顯著的是皮膚組織,表明皮膚作為機體外部重要的防御和保護組織,對溫度的變化最為敏感。GLUT1基因水平的上調表達,預示著皮膚是最早合成抗凍保護劑的組織,為保護機體避免細胞結冰,起到了重要的門戶作用。隨后在8 h中表達變化最顯著的是骨骼肌組織,由此可見骨骼肌也是在低溫脅迫早期形成抗凍保護劑的重要組織。低溫脅迫中期(24~48 h),GLUT1mRNA表達上調的組織為內臟器官,其中包括肝臟、心臟和脂肪體,其表達水平達到峰值的時間相對滯后(24~48 h),其中變化最顯著的為肝臟組織。分析肝臟作為機體轉運葡萄糖的重要代謝器官,肝臟對葡萄糖的大量轉運不僅可以形成高濃度的抗凍保護劑,保護機體阻止細胞內冰晶形成,免受低溫損傷,同時也可以為相關抗凍蛋白的合成提供能源,保證機體在低溫應激下的能量所需。在低溫脅迫后期(72 h),組織中上調GLUT1mRNA表達水平都有所回降,可見在機體逐漸適應低溫環境下降低了葡萄糖的轉運水平,以維持細胞內環境的穩態。
綜上所述,通過對低溫脅迫下東北林蛙不同組織中GLUT1mRNA表達水平變化的分析,表明GLUT1參與了低溫脅迫的應激反應,低溫冬眠期為組織器官高效率轉運葡萄糖,在形成細胞內高濃度的葡萄糖抗凍保護劑和能量供應方面起重要作用。
[1] Clark M S,Worland M R.How insects survive the cold:molecular mechanisms-a review[J].Journal of Comparative Physiology B,2008,178(8):917-933.
[2] Block W,Wharton D A,Sinclair B J.Cold tolerance of a New Zealand alpine cockroach,Celatoblattaquinquemaculata(Dictyoptera,Blattidae)[J].Physiological Entomology,1998,23(1):1-6.
[3] Costanzo J P,Lee R E,Lortz P H.Glucose concentration regulates freeze tolerance in the wood frogRanasylvatica[J].Journal of Experimental Biology,1993,181(1):245-255.
[4] Bale J S,Hayward S A L.Insect overwintering in a changing climate[J].The Journal of Experimental Biology,2010,213(6):980-994.
[5] Bazin Y,Wharton D A,Bishop P J.Cold tolerance and overwintering of an introduced New Zealand frog,the brown tree frog(Litoriaewingii)[J].Cryoletters,2007,28(5):347-358.
[6] Storey K B,Storey J M.Insect cold hardiness:metabolic,gene,and protein adaptation[J].Canadian Journal of Zoology,2012,90(4):456-475.
[7] 俞曉燕,孫子林.GLUT1的研究進展[J].現代中西醫結合雜志,2012,21(30):3411-3414.
[8] Sung J Y,Kim G Y,Lim S J,et al.Expression of the GLUT1 glucose transporter and p53 in carcinomas of the pancreatobiliary tract[J].Pathology-Research and Practice,2010,206(1):24-29.
[9] Heilig C W,Brosius F C 3rd,Henry D N.Glucose transporters of the glomerulus and the implications for diabetic nephropathy[J].Kidney international.Supplement,1997,60:S91-99.
[10] Storey K B,Storey J M.Freeze tolerance in animals[J].Physiological Reviews,1988,68(1):27-84.
[11] Margesin R,Neuner G,Storey K B.Cold-loving microbes,plants,and animals-fundamental and applied aspects[J].Die Naturwissenschaften,2007,94(2):77-99.
[12] Costanzo J P,Iverson J B,Wright M F,et al.Cold hardiness and overwintering strategies of hatchlings in an assemblage of northern turtles[J].Ecology,1995,76(6):1772-1785.
[13] Xianghong X,Dong Z,Cuijun Y.Survival and metabolic responses to freezing temperature in the northeast forest frogRanadybowskii[J].Asiatic Herpetological Research,2008,11:147-152.
Glucose transporter 1(GLUT1);Cryoprotectant;Cold exposure;Glucose
TheDynamicofGLUT1mRNAExpressioninRanadybowskiiDuringColdStress
GuoBaihongXiaoXianghong*GongShanshanZhangJingyuChaiLonghui
(NortheastForestryUniversity,Harbin,150040,China)
Dybowski’s frog(Ranadybowskii)is found in northeast China where it faces a seasonally cold climate.Thus the frog has evolved effective self-protection strategies for surviving cold during winter.One of these mechanisms is high concentration of glucose in blood which serves as a cryoprotectant.GLUT1 is the most widely distributed in the body cells.In this study,we obtained partial GLUT1 mRNA fragments by high-throughput sequencing and analyzed the changes in level ofRanadybowskiiGLUT1 mRNA transcript in liver,heart,fat body,skeletal muscle and skin during cold stress at-1℃ by using quantitative real-time PCR.In liver and heart,GLUT1 mRNA levels reached their peaks after 24h of cold stress at 9.17 and 5 fold induction to their control groups,respectively.In skeletal muscle and fat body,the expression of GLUT1 reached its top levels of 7. 2 fold induction after 48h of cold exposure. GLUT1 expression showed no significant change in skin. This study showed that GLUT1 participated in cold stress responses of Rana dybowskii and played an essential role in maintaining high concentrations of glucose.
稿件運行過程
2016-01-18
修回日期:2016-02-03
發表日期:2016-05-10
抗凍保護劑;
冷刺激;
葡萄糖
S858.94
A
2310-1490(2016)02-134-04
郭柏宏,女,27歲,碩士研究生;主要從事分子生物學實驗研究。
*通訊作者:肖向紅, E-mail:xiaoxh2010@sina.com

