幾種因素對大孔樹脂純化羊棲菜多酚效果的影響
曾 帥,周德慶,劉 楠,*
(1.中國水產科學研究院黃海水產研究所,山東青島 266071;2.上海海洋大學食品學院,上海 201306;)
?
幾種因素對大孔樹脂純化羊棲菜多酚效果的影響
曾帥1,2,周德慶1,劉楠1,*
(1.中國水產科學研究院黃海水產研究所,山東青島 266071;2.上海海洋大學食品學院,上海 201306;)
以新鮮羊棲菜為研究對象,比較4種大孔吸附樹脂對羊棲菜多酚的吸附與解吸效果,篩選出其中最適合分離純化羊棲菜多酚的大孔吸附樹脂。研究了pH、流速、樣品濃度、洗脫劑濃度4種因素對大孔吸附樹脂純化羊棲菜多酚的影響。結果表明,AB-8型大孔吸附樹脂對羊棲菜多酚吸附率和解吸率最高,在條件為pH 5,吸附流速1.5 BV/h,樣品濃度70 μg/mL,洗脫劑乙醇濃度70%,洗脫流速1.5 BV/h及洗脫劑用量90 mL下,經樹脂純化后的羊棲菜多酚含量從溶劑萃取初步分離的31.24%提高至62.15%。
大孔吸附樹脂,純化,羊棲菜,多酚
羊棲菜(Sargassumfusiforme),也稱玉海草、鹿角尖等,屬褐藻門。羊棲菜富含多種功能性物質,如褐藻酸、多酚類化合物、甘露醇、褐藻多糖硫酸酯、維生素、碘、β-胡蘿卜素和牛磺酸等[1],日本稱其為“長壽菜”,用它為原料來開發保健品、調味品及方便食品等多種產品[2],具有較高的營養價值和經濟價值。
近年來,葡萄多酚和茶多酚等多酚類物質受到廣泛關注[3],而對羊棲菜多酚的研究中,存在多酚提取量較低、粗提液中多酚純度不高等問題,影響羊棲菜多酚在食品、醫療及化妝品等領域的應用。羊棲菜多酚是一類重要的褐藻多酚化合物,褐藻多酚對自由基有較顯著的清除能力[4],可以作為天然的抗氧化劑與自由基清除劑應用于醫藥、化妝品及保健食品等領域[5]。此外,現代藥理學研究表明,褐藻多酚還具有化學防御[6]、抑菌[7]、抗凝血[8]、延緩衰老[9]、抗高血糖[10]、抗腫瘤[11]及促進睡眠[12]等多種生物活性功能。開展優化羊棲菜多酚分離純化工藝研究對擴大其在食用、藥用和保健等方面的應用具有重要意義。
溶劑萃取法和沉淀分離法作為傳統的植物多酚分離純化方法,存在一些不足,如成本高,純化純度較低等[13]。大孔吸附樹脂具有諸多優點,如選擇性強[14]、穩定性高、吸附容量大[15]、吸附條件溫和、純化純度較高及再生簡便[16]等,能彌補這些不足。近年來,大孔吸附樹脂越來越廣泛應用于動植物原料中活性物質的分離純化。
本研究先對羊棲菜多酚進行溶劑萃取初步分離,然后再選用4種大孔吸附樹脂對羊棲菜多酚進行進一步純化,能避免樹脂因雜質較多而出現堵塞及污染等問題,提高多酚的純化效率。篩選出其中最適合分離純化羊棲菜多酚的大孔吸附樹脂,通過動態吸附和解吸實驗研究pH、流速、樣品濃度、洗脫劑濃度等幾種因素對大孔吸附樹脂純化羊棲菜多酚的影響,為羊棲菜多酚的分離純化應用于生產實踐中提供一定的數據參考。
1 材料與方法
1.1材料與儀器
新鮮羊棲菜浙江省溫州市洞頭縣樂雁美食坊公司;AB-8 大孔吸附樹脂天津南開大學化工廠;DA-201大孔吸附樹脂天津市海光化工有限公司;HP-20大孔吸附樹脂日本三菱化學株式會社;D141大孔吸附樹脂成都中蘭晨光化工研究院;Folin-Ciocalteau試劑上海藍季科技發展有限公司;沒食子酸等國藥集團化學試劑有限公司。
HW·SY21-K恒溫水浴鍋北京長風儀器儀表公司;KQ-300VDE電子天平北京賽多利斯科學儀器有限公司;T6新悅-可見分光光度計北京普析通用儀器有限公司;RE-52AA旋轉蒸發儀上海亞榮生化儀器廠;TYS-200高速多功能粉碎機浙江省永康市紅太陽機電有限公司;STARTER3100 pH計奧豪斯儀器有限公司。
1.2樣品處理
將新鮮羊棲菜在自然條件下風干,然后經粉碎再過40目篩,得到的羊棲菜粉末含水量為3.6%±0.02%(干基),存放于4 ℃冰箱備用。
1.3羊棲菜多酚含量的測定
以沒食子酸為標準品,采用福林酚法[17]繪制羊棲菜多酚含量的標準曲線,根據標準曲線方程計算羊棲菜多酚含量。
1.4羊棲菜多酚樣品的制備
準確稱取1.0000 g羊棲菜粉于帶塞三角瓶中,用體積分數為40%的乙醇溶液以1∶55 g·mL-1料液比在70 ℃下水浴4.5 h,浸提2次,得到羊棲菜多酚粗提物,在45 ℃下減壓旋蒸,得褐色膏狀物,取羊棲菜多酚樣品浸膏20 g,溶于100 mL去離子水中,按1∶1(V/V)分別通過正己烷、二氯甲烷、乙酸乙酯和正丁醇進行萃取[14],得到各自溶劑萃取液,在45 ℃下減壓蒸干,使其含水量與羊棲菜粉末樣品一致,然后稱其質量,根據標準曲線方程計算各自羊棲菜多酚含量,用萃取效果最佳的溶劑對羊棲菜多酚粗提物進行初步分離,將得到的羊棲菜多酚膏狀物用去離子水溶解,作為樣品液。
1.5大孔吸附樹脂預處理
用無水乙醇將4種大孔吸附樹脂浸泡24 h,然后用去離子水進行反復清洗,直至無白色混濁現象,并無乙醇味。再進行酸堿處理,依次加入4倍體積5% HCl、去離子水和5% NaOH浸泡3 h后,用去離子水沖洗至中性。
1.6大孔吸附樹脂的篩選
稱取經預處理的AB-8、DA-201、HP-20及D141四種大孔吸附樹脂各1 g,分別加入錐形瓶中,分別加入50 mL一定質量濃度C0(μg/mL)經萃取分離的羊棲菜多酚樣品液。在25 ℃下水浴振蕩24 h,測定上清液中羊棲菜多酚質量濃度Ce(μg/mL)。過濾得到的吸附樹脂,用去離子水洗滌兩次,再裝入加有50 mL無水乙醇的錐形瓶中。在相同的條件下進行樹脂解吸,測定解吸液中羊棲菜多酚的質量濃度Cd(μg/mL)。
根據以下公式計算4種大孔吸附樹脂對羊棲菜多酚的吸附量、吸附率及解吸率,從而篩選出最合適的大孔吸附樹脂。
吸附量(μg/g)=(C0-Ce)×V0/m
(1)
吸附率(%)=(C0-Ce)/C0×100
(2)
解吸率(%)=Cd/(C0-Ce)×100
(3)
式中,C0:經初步分離的羊棲菜多酚樣品液初始質量濃度,μg/mL;Ce:樹脂吸附平衡時樣品液中羊棲菜多酚的質量濃度,μg/mL;Cd:樹脂解吸后解吸液中羊棲菜多酚的質量濃度,μg/mL;V0:羊棲菜多酚樣品液的體積,mL;m:樹脂質量,g。
1.7羊棲菜多酚的靜態吸附曲線
采用SPSS22.0進行數據處理。計數資料用以卡方檢驗,計量資料用以t值檢驗,以P<0.05判定組間差異有統計學意義。
稱取1 g篩選的最合適樹脂于錐形瓶中,加入50 mL 50 μg/mL經初步分離的羊棲菜多酚樣品液,在25 ℃下水浴振蕩吸附,分別在2、4、6、8、10、12和24 h取上清液,測羊棲菜多酚質量濃度,用公式(1)計算吸附量,繪制對羊棲菜多酚的樹脂靜態吸附曲線。
1.8幾種因素對羊棲菜多酚純化效果影響研究
1.8.1pH對樹脂吸附羊棲菜多酚的影響用0.5 mol/L HCl溶液和0.5 mol/L NaOH溶液將50 mL 50 μg/mL經初步分離的羊棲菜多酚樣品液調成不同的pH(3、4、5、6、7、8、9),以1.0 BV/h的速度過柱(以20 mL的篩選最適樹脂濕法上柱),測定過柱后樣品液中羊棲菜多酚質量濃度,按照公式(2)計算吸附率。
1.8.2吸附流速對樹脂吸附羊棲菜多酚的影響用0.5 mol/L HCl溶液將50 mL 50 μg/mL經初步分離的羊棲菜多酚樣品液調pH為5,分別以0.5、1.0、1.5、2.0、2.5、3.0、3.5和4.0 BV/h過柱,測定過柱后樣品液中羊棲菜多酚質量濃度,按照公式(2)計算吸附率。
1.8.3樣品液濃度對樹脂吸附羊棲菜多酚的影響用0.5 mol/L HCl溶液將50 mL不同質量濃度(50、60、70、80、90、100、110 μg/mL)經初步分離的羊棲菜多酚樣品液調pH為5,以1.5 BV/h過柱,測定過柱后樣品液中羊棲菜多酚質量濃度,按照公式(2)計算吸附率。
1.8.4洗脫劑濃度對樹脂解吸羊棲菜多酚的影響用0.5 mol/L HCl溶液將50 mL 70 μg/mL經初步分離的羊棲菜多酚樣品液調pH為5,以1.5 BV/h過柱,測定過柱后樣品液中羊棲菜多酚質量濃度。將柱中的吸附樹脂轉入錐形瓶中,分別加入50 mL 60%、70%、80%及90%的乙醇溶液,于25 ℃下水浴振蕩解吸,并在2、4、6、8、10、12和24 h取解吸液,測定羊棲菜多酚質量濃度。
1.8.5洗脫流速對樹脂解吸羊棲菜多酚的影響用0.5 mol/L HCl溶液將50 mL 70 μg/mL經初步分離的羊棲菜多酚樣品液調pH為5,以1.5 BV/h過柱,測定過柱后樣品液中羊棲菜多酚質量濃度。再用50 mL 70%的乙醇溶液分別以0.5、1.0、1.5、2.0、2.5、3.0、3.5和4.0 BV/h過柱進行解吸,測定解吸液中羊棲菜多酚的質量濃度,根據公式(3)計算解吸率。
1.9數據處理
采用Excel和SPSS 17.0軟件對實驗數據進行作圖分析和統計分析,定義p<0.05時差異具有統計學意義。
2 結果與分析
2.1羊棲菜多酚含量的測定
以沒食子酸為標準品,采用福林酚法繪制羊棲菜多酚含量的標準曲線,得到標準曲線方程為:Y=0.0161X+0.014,R2=0.9997,表明線性關系良好。
2.2羊棲菜多酚樣品的制備
采用溶劑萃取對羊棲菜多酚粗提物進行初步分離,除去一些大分子蛋白及其他雜質,得到相對較為純凈的羊棲菜多酚樣品,避免下一步純化中樹脂因雜質較多而出現堵塞及污染等問題,提高多酚的純化效率。實驗結果如圖1所示。
由圖1可知,羊棲菜多酚粗提物分別經四種溶劑萃取后,乙酸乙酯相中多酚含量最多,達到31.24%,根據相似相溶原理,溶劑乙酸乙酯更適合萃取羊棲菜多酚。因此,以乙酸乙酯萃取相中的羊棲菜多酚作為下一步樹脂分離純化的樣品。
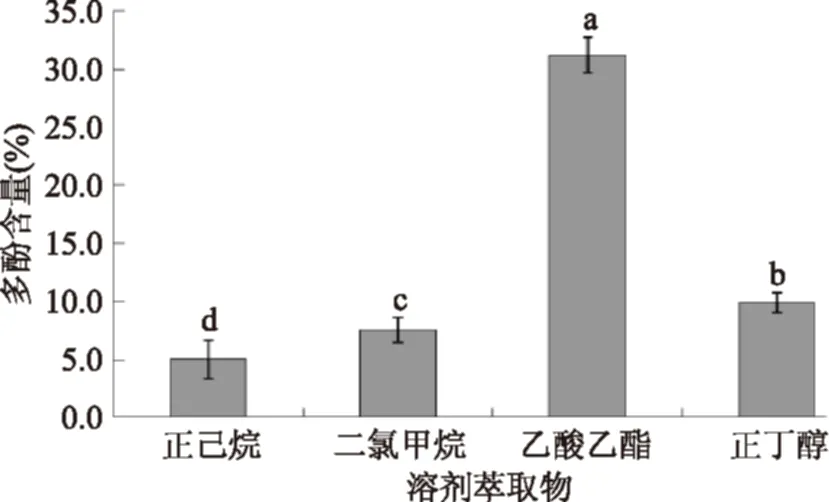
圖1 溶劑分別萃取后各相質量及多酚含量測定結果Fig.1 Each phase quality after solvent extraction respectively and polyphenols content determination results注:圖中所標不同字母表示相互之間差異顯著(p<0.05),相同字母表示差異不顯著(p>0.05)。圖2同。
2.3大孔吸附樹脂的篩選
不同大孔吸附樹脂的結構與性質有所差異,因此吸附分離的效果也不一樣。AB-8、DA-201、HP-20及D141四種大孔吸附樹脂對羊棲菜多酚的吸附與解吸效果如圖2所示。
大孔吸附樹脂對目標物質的吸附與解吸效果由極性、結構和比表面積等多種因素綜合決定。由圖2可知,AB-8吸附樹脂對羊棲菜多酚的吸附率和解吸率均高于其他三種樹脂,可能是因為AB-8吸附樹脂同羊棲菜多酚的極性較為接近,且具有適合的表面結構和較高的比表面積,因此選擇AB-8吸附樹脂對羊棲菜多酚進行進一步的純化。

圖2 4種大孔吸附樹脂對羊棲菜多酚吸附與解吸效果Fig.2 Adsorption and desorption effect of four kindsmacroporous adsorption resin to Sargassum fusiforme polyphenols注:圖中大寫字母表示吸附率差異性,小寫字母表示解吸率差異性。
2.4羊棲菜多酚的靜態吸附曲線
由圖3可知,AB-8樹脂對羊棲菜多酚的吸附具有一定的時間依賴性。0~8 h內AB-8吸附樹脂對羊棲菜多酚的吸附量隨時間增加而增大,0~2 h和6~8 h吸附曲線上升明顯,其中6~8 h吸附速度仍較快,表明AB-8樹脂在吸附量較高時并不是理想的單分子層,可能是因為羊棲菜多酚中的酚羥基和苯環結構使其能夠以氫鍵和疏水鍵發生分子間締合,因此AB-8樹脂對羊棲菜多酚的吸附量有所增加。8 h后吸附量緩慢上升,12 h達到較為穩定的狀態,表明基本達到吸附平衡。
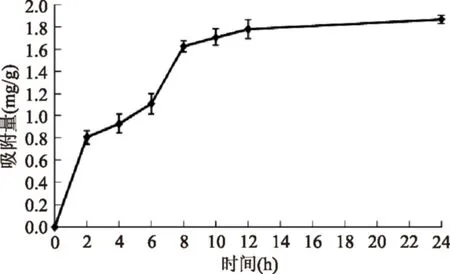
圖3 AB-8吸附樹脂對羊棲菜多酚的靜態吸附曲線Fig.3 AB-8 adsorption resin for Sargassum fusiforme polyphenols static adsorption curve
2.5幾種因素對羊棲菜多酚純化效果影響研究
2.5.1pH對AB-8樹脂吸附羊棲菜多酚的影響pH不同,溶液中化合物的電離狀態也不同,一般情況下,分子狀態的吸附質在吸附過程中更易于被吸附劑吸附。羊棲菜多酚樣品液pH對AB-8樹脂吸附羊棲菜多酚的影響如圖4所示。
由圖4可知,當羊棲菜多酚樣品液pH在3~5之間,AB-8樹脂對羊棲菜多酚的吸附率緩慢上升,可能是由于羊棲菜多酚具有酚羥基結構,顯弱酸性,在弱酸性環境中以分子狀態存在,因此吸附效果較好。而當羊棲菜多酚樣品液pH大于5后,吸附率呈下降趨勢,可能是因為pH升高促進鹽結構的形成,不利于吸附。所以選擇5作為樹脂吸附羊棲菜多酚最合適的pH。
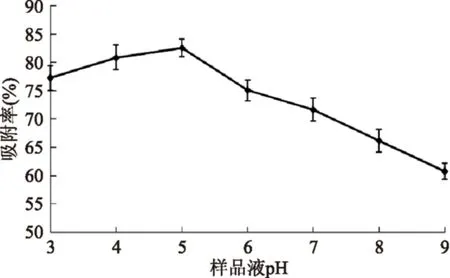
圖4 樣品液pH對AB-8樹脂吸附羊棲菜多酚的影響Fig.4 The effect of sample liquid pH for AB-8 resin adsorption Sargassum fusiforme polyphenols
2.5.2吸附流速對AB-8樹脂吸附羊棲菜多酚的影響由圖5可知,樣品液吸附流速越慢,吸附效果越好,其中在0.5、1.0和1.5 BV/h吸附流速下,AB-8樹脂對羊棲菜多酚的吸附率都在80%以上,而當吸附流速超過2.0 BV/h,吸附率下降較明顯,因為流速過快,樹脂來不及完全吸附樣品液中的羊棲菜多酚。吸附流速慢有利于樣品溶液中的羊棲菜多酚在AB-8樹脂床中充分擴散和吸附,但流速太慢會延長生產周期,因為樹脂床體積為20 mL,樣品液體積為50 mL,當吸附流速為1.0 BV/h,吸附時間便會比1.5 BV/h的吸附時間延長50 min;當吸附流速為0.5 BV/h,吸附時間便會比1.5 BV/h的吸附時間延長200 min。綜合考慮選擇1.5 BV/h的吸附流速。

圖5 吸附流速對AB-8樹脂吸附羊棲菜多酚的影響Fig.5 The effect of adsorption velocity for AB-8 resin adsorption Sargassum fusiforme polyphenols
2.5.3樣品濃度對AB-8樹脂吸附羊棲菜多酚的影響由圖6可知,AB-8樹脂對羊棲菜多酚的吸附具有一定的濃度依賴性。隨著羊棲菜多酚樣品濃度的增大,AB-8樹脂對羊棲菜多酚的吸附率也隨之提高,當樣品液濃度為70 μg/mL時,吸附率達到最大。繼續增大樣品液濃度,吸附率呈逐漸下降趨勢,因為隨著樣品液濃度的增大,與其競爭吸附的雜質也增多,多酚在樹脂內部的擴散能力會隨之降低,并且樣品液濃度過高時,會出現些許絮狀物或沉淀,導致樹脂一定程度的堵塞,吸附能力下降。因此,在后續的吸附實驗中,選擇70 μg/mL作為羊棲菜多酚樣品液濃度。
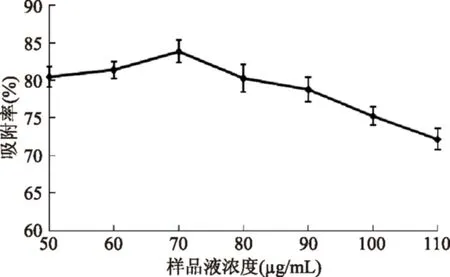
圖6 樣品濃度對AB-8樹脂吸附羊棲菜多酚的影響Fig.6 The effect of sample concentration for AB-8 resin adsorption Sargassum fusiforme polyphenols
2.5.4洗脫劑濃度對AB-8樹脂解吸羊棲菜多酚的影響由圖7可知,四種濃度的乙醇洗脫液對AB-8吸附樹脂的解吸趨勢大致相同,70%乙醇解吸液中羊棲菜多酚濃度最高,解吸效果最好,可能是由于不同體積分數的乙醇溶液,極性大小不同,而70%乙醇的極性與羊棲菜多酚極性較為相近。60%乙醇解吸液中羊棲菜多酚濃度最低,80%和90%乙醇溶液對AB-8樹脂解吸羊棲菜多酚的影響幾乎一致,故選擇70%為洗脫劑濃度。

圖7 乙醇濃度對AB-8樹脂解吸羊棲菜多酚的影響Fig.7 The effect of ethanol concentration for AB-8 resindesorption Sargassum fusiforme polyphenols
2.5.5洗脫流速對AB-8樹脂解吸羊棲菜多酚的影響由圖8可知,洗脫流速越大,AB-8樹脂對羊棲菜多酚的解吸率越低,尤其在洗脫流速大于2.0 BV/h后,解吸率下降更為明顯。當洗脫流速為0.5、1.0和1.5 BV/h時,解吸率比較接近,且均在90%以上,但流速太慢會延長生產周期,因為樹脂床體積為20 mL,若洗脫液體積為50 mL,當洗脫流速為1.0 BV/h,洗脫時間便會比1.5 BV/h的洗脫時間延長50 min;當洗脫流速為0.5 BV/h,洗脫時間便會比1.5 BV/h的洗脫時間延長200 min。綜合考慮時間與解吸率因素,選擇1.5 BV/h的洗脫流速較為合適。
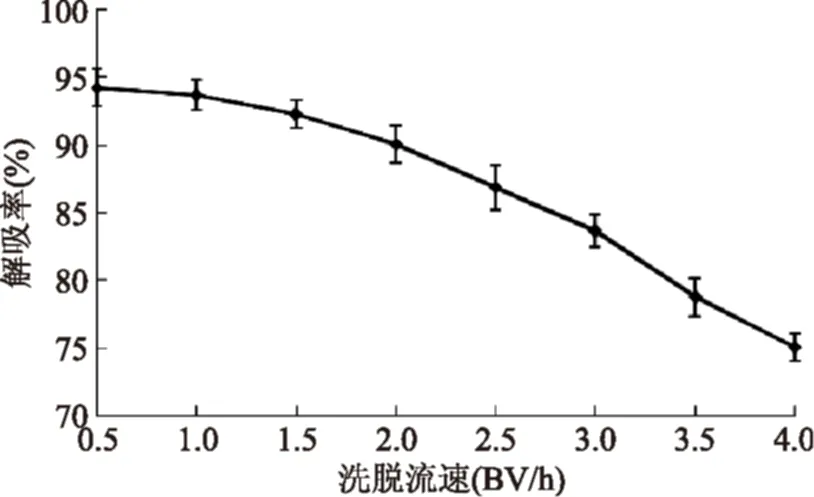
圖8 洗脫流速對AB-8樹脂解吸羊棲菜多酚的影響Fig.8 The effect of elution velocity for AB-8 resin desorption Sargassum fusiforme polyphenols
2.5.6洗脫劑用量對AB-8樹脂解吸羊棲菜多酚的影響由圖9可知,10~70 mL洗脫液中的多酚含量較高,當洗脫劑乙醇溶液用量達到40 mL時,AB-8樹脂中羊棲菜多酚開始被大量洗脫下來,當洗脫劑用量達到90 mL時,洗脫液中羊棲菜多酚濃度已接近零,可認為已經基本洗脫完全,無拖尾現象。因此,用90 mL乙醇溶液進行洗脫最合適。
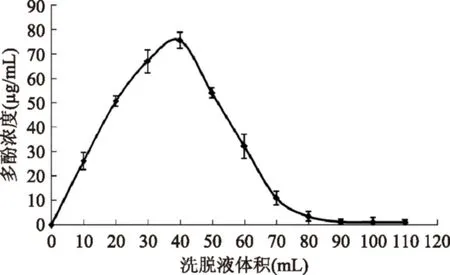
圖9 洗脫劑用量對AB-8樹脂解吸羊棲菜多酚的影響Fig.9 The effect of eluent dosage for AB-8 resin desorption Sargassum fusiforme polyphenols
2.6純化后羊棲菜多酚含量的測定
在上述最佳吸附和解吸條件下,用AB-8吸附樹脂對經初步分離的羊棲菜多酚樣品液進行分離純化,收集前90 mL洗脫液,在45 ℃下減壓旋蒸,得褐色膏狀物,使其含水量與羊棲菜粉末樣品一致,然后稱其質量,按照1.3的方法對羊棲菜多酚含量進行測定,實驗結果如表1所示。
由表1可知,經AB-8吸附樹脂純化后的羊棲菜多酚含量達到62.15%,而溶劑萃取初步分離后羊棲菜多酚含量僅為31.24%,有明顯提高。
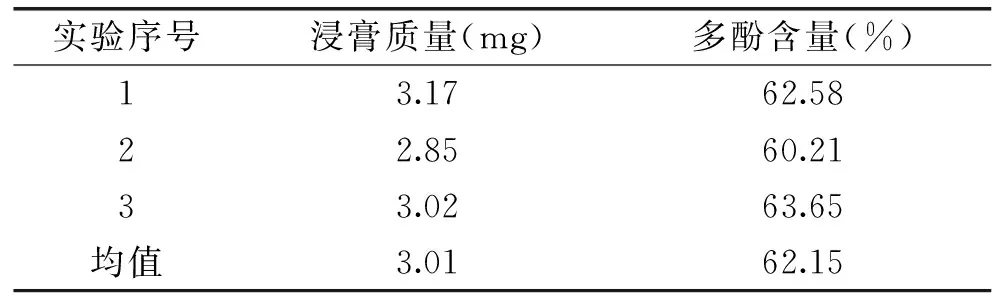
表1 AB-8吸附樹脂對羊棲菜多酚的分離純化效果
3 結論
通過比較4種大孔吸附樹脂對羊棲菜多酚的吸附與解吸效果,篩選出AB-8型吸附樹脂為最適合分離純化羊棲菜多酚的大孔吸附樹脂。通過動態吸附和解吸實驗研究了幾種因素對大孔吸附樹脂純化羊棲菜多酚的影響,得出最佳動態吸附條件為pH5,吸附流速1.5 BV/h,樣品液濃度70 μg/mL;最佳動態洗脫條件為洗脫劑乙醇濃度70%,洗脫流速1.5 BV/h及洗脫劑用量90 mL。在最優條件下,經AB-8樹脂吸附分離得到的樣品中,羊棲菜多酚含量從溶劑萃取初步分離的31.24%提高至62.15%,具有較好的工業生產應用價值。
[1]何傳輝,何傳波,魏好程,等.羊棲菜多酚提取工藝優化[J].食品安全質量檢測學報,2015,6(8):2896-2902.
[2]程忠玲,吳效楠.羊棲菜褐藻糖膠的抗凝血和促血管內皮細胞生長活性研究[J].食品研究與開發,2011,32(4):165-167.
[3]Spigno G,Faveri DM. Microwave-assisted extraction of tea phenols:A phenomenological study[J]. Journal of Food Engineering,2009,93(2):210-217.
[4]王君虹,郜海燕,葛林梅,等.微波輔助提取羊棲菜多酚的工藝研究[J].浙江農業學報,2013,25(6):1368-1372.
[5]呂成林,汪秋寬,宋悅凡,等.羊棲菜多酚的提取及純化工藝研究[J].食品工業科技,2014,35(22):231-235.
[6]Pangestuti R,Kim SK. Biological activities and health benefit effects of natural pigments derived from marine algae[J]. Journal of Functional Foods,2011,3(4):255-256.
[7]Eom SH,Kim YM,Kim SK. Antimicrobial effect of phlorotannins from marine brown algae[J]. Food and Chemical Toxicology,2012,50(9):3251-3255.
[8]Li YX,Wijesekara I,Li Y,et al. Phlorotannins as bioactive agents from brown algae[J].Process Biochemistry,2011,46(12):2219-2224.
[9]Kang MC,Kim KN,Wijesinghe WAJP,et al. Protective effect of polyphenol extracted from Ecklonia cava against ethanol induced oxidative damageinvitroand in zebrafish model[J]. Journal of Functional Foods,2014,6:339-347.
[10]Pantidosa N,Boathb A,Lundc V,et al. Phenolic-rich extracts from the edible seaweed,ascophyllumnodosum,inhibitα-amylase andα-glucosidase:Potential anti-hyperglycemic effects[J]. Journal of Functional Foods,2014,10:201-209.
[11]YangYI,AhnJH,ChoiYS,et al. Brown algae phlorotannins enhance the tumoricidal effect of cisplatin and ameliorate cisplatin nephrotoxicity[J]. Gynecologic Oncology,2015,136(2):355-364.
[12]錢卓權,殷皓臻,黃曉林,等.三種海藻抑菌活性和抗氧化活性[J].浙江農業學報,2014,26(2):384-387.
[13]馬樂,韓軍歧,張潤光,等.大孔吸附樹脂在植物多酚分離純化中的應用現狀[J].食品工業科技,2015,36(12):364-367.
[14]侯曉丹,袁其朋,田海源.大孔吸附樹脂法分離石榴籽中多酚及其抗氧化活性研究[J].食品科技,2010,35(1):194-198.
[15]呂群金,衣杰榮,丁勇.大孔吸附樹脂對楊桃渣多酚吸附分離的優化[J].食品科學,2010,31(6):39-42.
[16]胡明明,張國文,何力.大孔吸附樹脂分離純化花生殼多酚的研究[J].食品科技,2011,36(11):197-200.
[17]張軍,李江遐,陸翠珍,等. Folin-ciocalteu比色法測桑葉中多酚含量[J].激光生物學報,2012,21(2):131-135.
Factors affecting polyphenol purification of macroporous resin fromSargassumfusiforme
ZENG Shuai1,2,ZHOU De-qing1,LIU Nan1,*
(1.Yellow Sea Fishery Research Institute,Chinese Academy of Fishery Science,Qingdao 266071,China;2.College of Food Science & Technology,Shanghai Ocean University,Shanghai 201306,China)
To screen suitable polyphenol purifying macroporous resin from freshSargassumfusiforme,comparison of polyphenol adsorption and desorption capabilities was made among 4 macroporous resins. Effects of 4 factors,namely pH,flow rate,sample concentration and eluent concentration,were studied. The highest polyphenol adsorption and desorption rates were observed in resin AB-8 under the condition of pH 5,adsorption flow rate 1.5 BV/h,sample concentration 70 μg/mL,eluent ethanol concentration 70%,elution flow rate 1.5 BV/h and the dosage of eluent 90 mL. The polyphenols content increased from 31.24% of preliminary separation to 62.15%.
macroporous adsorption resin;purification;Sargassumfusiforme;polyphenols
2016-03-04
曾帥(1991-),男,在讀碩士研究生,研究方向:海洋功能食品,E-mail:naxiaozizengshuai@163.com。
劉楠(1982-),女,博士,研究方向:海洋功能食品,E-mail:liunan@ysfri.ac.cn。
中央級公益性科研院所基本科研業務費(20603022015001);青島市市南區科技發展資金項目(2014-14-008-SW)。
TS254.1
B
1002-0306(2016)18-0297-05
10.13386/j.issn1002-0306.2016.18.048

