酸菜中降解亞硝酸鹽乳酸菌的篩選、鑒定及其在發酵香腸中的應用
崔 玨,孫會剛,朱兆麗,婁雪蓮
(1.徐州工程學院食品(生物)工程學院,江蘇徐州 221111;2.江蘇省食品資源開發與質量安全重點實驗室,江蘇徐州 221111)
?
酸菜中降解亞硝酸鹽乳酸菌的篩選、鑒定及其在發酵香腸中的應用
崔玨1,2,孫會剛1,2,朱兆麗1,婁雪蓮1
(1.徐州工程學院食品(生物)工程學院,江蘇徐州 221111;2.江蘇省食品資源開發與質量安全重點實驗室,江蘇徐州 221111)
目的:依據多項評價指標篩選亞硝酸鹽降解能力強且適用于肉制品發酵的乳酸菌。方法:首先采用添加0.3% CaCO3的MRS培養基從15份不同產地的農家自制酸菜中篩選乳酸菌,其后以降解亞硝酸鹽能力和肉制品發酵劑所需要求為篩選指標對初篩所得乳酸菌進行復篩,并對其進行菌種的分子鑒定。最后以篩選到的菌株為發酵劑制作單菌株發酵香腸,通過檢測香腸在發酵和貯藏期間的NaNO2含量來進一步驗證所得菌株的實際降解亞硝酸鹽能力。結果:篩選到1株降解亞硝酸鹽能力優良(降解率為78.77%)且適于肉制品發酵的乳酸菌菌株,16S rDNA全序列分析鑒定為鼠李糖乳桿菌(LactobacillusrhamnosusGG,ATCC 53103)。香腸發酵實驗結果顯示,在發酵結束時香腸的NaNO2含量為12.2 mg/kg,低于國家標準。同時,微生物指標檢測結果證明了此條件下生產的發酵香腸的質量是安全可靠的。結論:鼠李糖乳桿菌能有效降低發酵香腸中的NaNO2含量,可用于開發成用于生產低亞硝酸鹽的健康、安全的肉品發酵劑。
酸菜,乳酸菌,亞硝酸鹽,發酵香腸
食品中過量添加亞硝酸鹽的致癌風險已被多項研究證明,然而由于其在加工肉類制品中具有發色、抑菌、抗氧化、增加風味等作用,目前還很難找到完美的替代物質,因此在肉制品生產中還在廣泛使用[1-2]。食品中亞硝酸鹽的危害主要是由于其可分解生成亞硝基,而亞硝基可與蛋白質代謝產物仲胺類化合物結合生成亞硝胺,而亞硝胺是一種極強的致癌物質,長期攝入可誘發多種消化道癌癥[3-4]。2015年,加工類肉制品已被世衛組織列為一級致癌物,主要就是因為亞硝酸鹽的添加。因此,尋找能有效降低肉制品中亞硝酸鹽的方法是近年來研究的熱點。目前降低肉制品中的亞硝酸鹽的方法主要有化學法和生物法兩類,化學法是通過添加由發色劑、抗氧化劑、多價鰲合劑和抑菌劑混合組成的添加劑來替代亞硝酸鹽在肉制品的添加。生物法則是利用微生物產生亞硝酸鹽還原酶來降解亞硝酸鹽或通過微生物產酸降低環境pH來促進亞硝酸鹽分解為NO,從而達到降低肉制品中亞硝酸鹽含量的目的[5-6]。
乳酸菌是一類能夠進行糖發酵,產生代謝產物乳酸的革蘭式陽性細菌,其作為發酵劑已經在發酵香腸的生產過程中廣泛使用幾百年。乳酸菌在肉制品的加工過程中,由于其可將糖類物質分解形成乳酸而降低肉制品中的pH,從而有效降解肉制品中的亞硝酸鹽,同時還可抑制腐敗菌和致病菌的生長[7-8]。目前多項研究已從自然發酵食品中篩選到多種具有降解亞硝酸能力的微生物,大多數為乳酸菌,主要包括植物乳桿菌、乳酸乳球菌、嗜酸乳桿菌、泡菜乳酸菌等,并將其作為發酵劑用于生產各式發酵香腸[9-10]。為了篩選到具有更高降解活性的乳酸菌,本研究以亞硝酸鹽降解能力為主要篩選指標從不同產地的農家自制的酸菜中篩選降解亞硝酸鹽能力強同時適用于肉制品發酵的乳酸菌,并以其為發酵劑進行單菌株發酵香腸的制作,通過測定香腸發酵期和貯藏期的亞硝酸鹽含量,對其降解亞硝酸鹽的能力進行驗證,以期為開發、生產健康、安全的加工肉制品提供理論依據。
1 材料與方法
1.1材料與儀器
酸菜分別產自貴州、重慶、四川、云南、湖南、吉林的農家自制酸菜;菌株篩選、培養、生化鑒定所采用的培養基均按文獻方法配制[11];豬后腿肉、肥膘、腸衣市售;胡椒粉、食鹽、蔗糖、葡萄糖、亞硝酸鈉均為食品級。
SHP-150型電熱恒溫培養箱上海精宏設備有限公司;全自動立式壓力蒸汽滅菌鍋上海博訊實業有限公司醫療設備廠;超凈工作臺上海博迅實業有限公司醫療設備廠;721G分光光度計上海精密科學儀器有限公司;PHS-3C酸度計上海雷磁。
1.2實驗方法
1.2.1乳酸菌篩選分別稱取15份酸菜樣品各20 g,在無菌條件下加入180 mL無菌蛋白胨水制備成10倍稀釋液,4 ℃保存備用。將上述稀釋液稀釋105后,取0.1 mL涂布于添加0.3% CaCO3的固體MRS培養基中,30 ℃厭氧培養48 h后,挑取具有較大溶鈣圈的單菌落。反復劃線進行分離純化,直至顯微觀察下菌體一致。挑取純菌進行革蘭氏染色,選取革蘭氏陽性和觸酶陰性菌株,于25~32 ℃厭氧培養48 h保存備用。
1.2.2具有降解亞硝酸鹽能力菌株篩選將上述分離到的乳酸菌菌株按10 mL/kg接種量取種齡為18 h的種子,接種于200 mL含125 μg/mL NaNO2,pH6.0的液體MRS培養基中,30 ℃厭氧培養。24 h后,檢測培養基中的NaNO2含量,用亞硝酸鹽降解率來表示菌株降解亞硝酸鹽的能力。亞硝酸鹽含量測定方法參考國標鹽酸萘乙二胺法[12]。亞硝酸鹽降解率根據以下公式計算:
亞硝酸鹽降解率(%)=最初亞硝酸鹽含量-殘留的亞硝酸鹽含量/最初亞硝酸鹽含量×100
1.2.3篩選菌株發酵特性測試以生產發酵香腸為目標,通過耐鹽性實驗、耐硝性實驗、24 h產酸能力實驗、發酵葡萄糖產氣實驗、產H2S實驗、產粘液實驗、氨基酸脫羧酶實驗、精氨酸產胺實驗,進一步篩選符合肉品發酵要求的乳酸菌菌株,實驗方法參照文獻[9]。
1.2.4篩選菌株的16S rDNA全序列分析將按上述方法篩選獲得的菌株進行培養,提取菌株的DNA,采用16S rDNA細菌通用引物進行擴增、測序,測序工作由中美泰和生物技術有限公司完成。所得序列在GenBank數據庫中利用BLAST進行在線同源性比對,并將比對結果中最相似菌株序列進行系統發育樹的構建。
1.2.5乳酸菌菌株在發酵香腸中的應用將原料肉去除不宜加工和影響產品質量的部分后,絞碎并按比例(瘦肉∶肥肉=8∶2)混合,按肉重加入2.8%鹽、0.5%蔗糖、0.015% NaNO2、1%香辛料進行充分混合后,置于4 ℃環境下,腌制24 h。然后按肉重2%進行接種處于對數生長期的發酵劑,使接種量達到106CFU/g以上。接種后的肉料,充填于豬腸衣內。經灌腸后的濕香腸,在55 ℃短暫烘干腸衣外部水分后置于30 ℃恒溫恒濕培養箱中進行24 h發酵。發酵結束后,進行14 d的干燥脫水(10 ℃、相對濕度70%)、成熟(15 d),待香腸成熟后即開始貯藏實驗。實驗是模擬在日常銷售的情況下,評價香腸的感官變化,因此貯藏溫度控制為20~30 ℃。
1.2.6發酵香腸在發酵期乳酸菌活菌數、pH、NaNO2含量測定在香腸發酵過程中,分別于0、4、8、12、16、20、24 h取樣,測定其乳酸菌活菌數、pH、NaNO2含量。乳酸菌活菌數測定:樣品在無菌條件下除去腸衣,稱取25 g樣品,剪碎后加入225 mL滅菌生理鹽水中,劇烈震蕩30 min,混勻后梯度稀釋,選擇合適的稀釋度傾注平板,30 ℃于MRS培養基中培養48 h后進行計數[13]。pH測定:將樣品絞碎后,準確稱取10.00 g加入90 mL蒸餾水中,將樣品分散乳化,靜置30 min后過濾,取濾液用酸度計進行pH的測定。NaNO2含量測定方法參照1.2.2。
1.2.7發酵香腸貯藏過程中的感官評價選擇香腸的中間部位,將樣品切為5 mm左右的薄片,10位食品專業的人員組成感官評定小組,以色澤20分、外觀20分、組織狀態30分、風味30分為標準對貯藏期間的發酵香腸進行感官評價,分數匯總后,取平均值作為發酵香腸的感官評分,評分標準見表1。

表1 發酵香腸感官評價標準
1.2.8發酵香腸貯藏過程中霉菌、酵母菌、肉毒梭狀芽孢桿菌的檢測分別檢測貯藏第0周(香腸成熟時)、1周(第7 d)、2周(第14 d)、3周(第21 d)的菌落總數、大腸菌群、霉菌及酵母菌、肉毒梭狀芽孢桿菌數量,具體檢測方法參照國標[14-17]。
1.3數據處理
運用Excel和SPSS 16.0軟件進行統計分析。
2 結果與分析
2.1乳酸菌的初步篩選
從不同產地的農家自制泡菜中,初步分離到12株能夠在添加了CaCO3的固體MRS培養基中生長并產生溶鈣圈的菌,對分離得到的各菌株用顯微鏡觀察其菌體形態,同時進行革蘭氏染色和過氧化氫酶實驗,結果見表2。
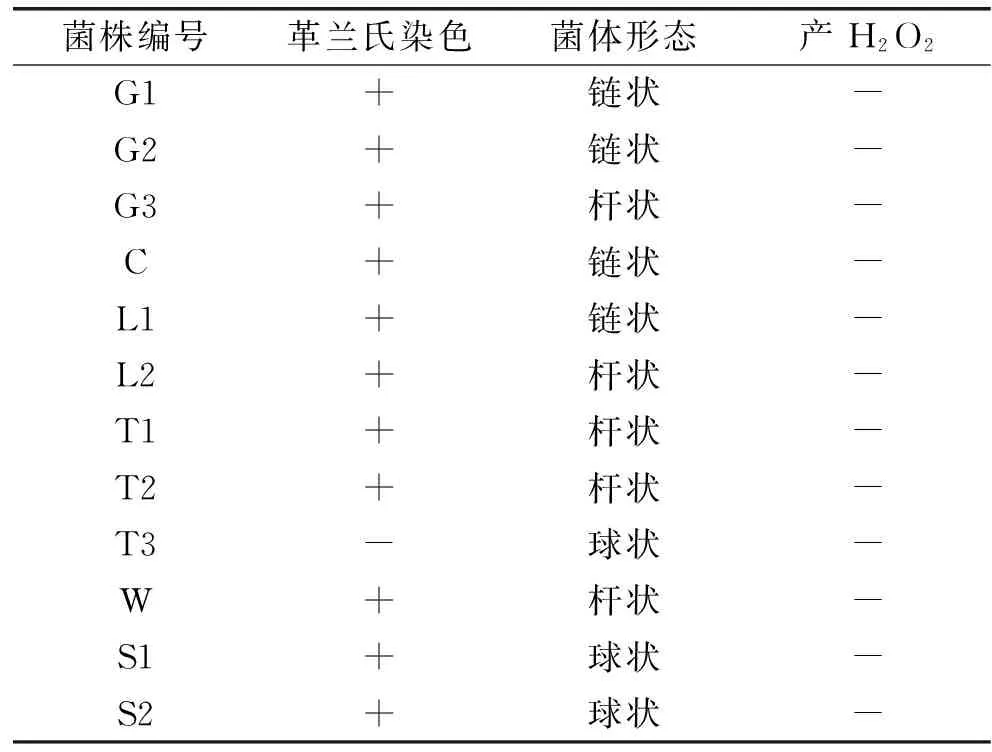
表2 初篩菌株鑒定結果
注:+表示陽性結果,-表示陰性結果;表3同。
如表2結果顯示,12株菌中除T3為革蘭氏陰性菌外,其他均為革蘭氏陽性菌且過氧化氫酶反應陰性,初步確定11株菌均為乳酸菌。
2.2具有降解亞硝酸鹽能力菌株篩選
對11株分離到的乳酸菌菌株用含有亞硝酸鹽的MRS液體培養基培養,進一步篩選具有降解亞硝酸鹽能力的菌株,最終篩選到降解效果較好(降解率超過50%)的6株菌(圖1),其中編號為L1的菌株降解效果最好,亞硝酸鹽降解率達到78.77%。
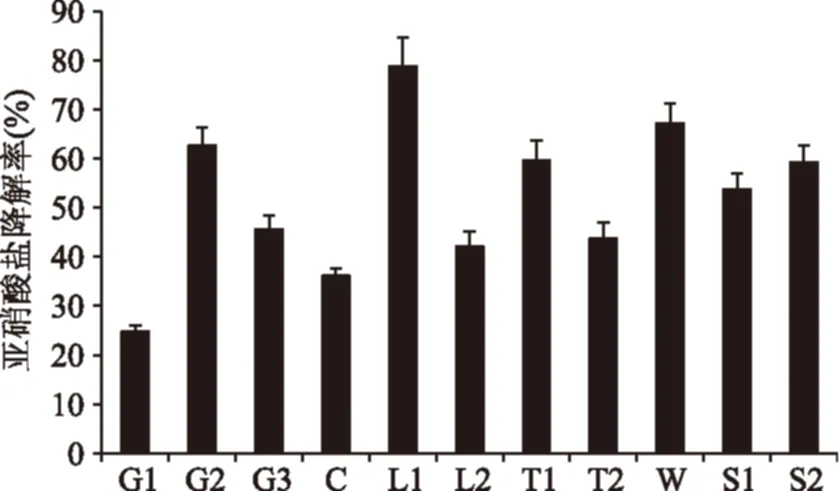
圖1 菌株亞硝酸鹽降解率Fig.1 Nitrite degradation of lactic acid bacteria
2.3菌株發酵特性測試
以肉品發酵劑所需特性為篩選評價目標,篩選滿足能耐受6%NaCl和150 mg/kg NaNO2、24 h產酸能力較強、發酵葡萄糖不產氣、不產H2S、水解精氨酸不產氨、不具有氨基酸脫羧酶活性、不產粘液、不具有分解脂肪和蛋白質的能力、不產H2O2、能夠抑制致病菌和腐敗菌的生長等條件的優良菌株。結果見表3,綜合各項評價指標,菌株L1、W、T1符合篩選標準。結合降解亞硝酸鹽實驗結果,最終選取菌株L1為最優的肉品發酵劑,進行菌株鑒定。
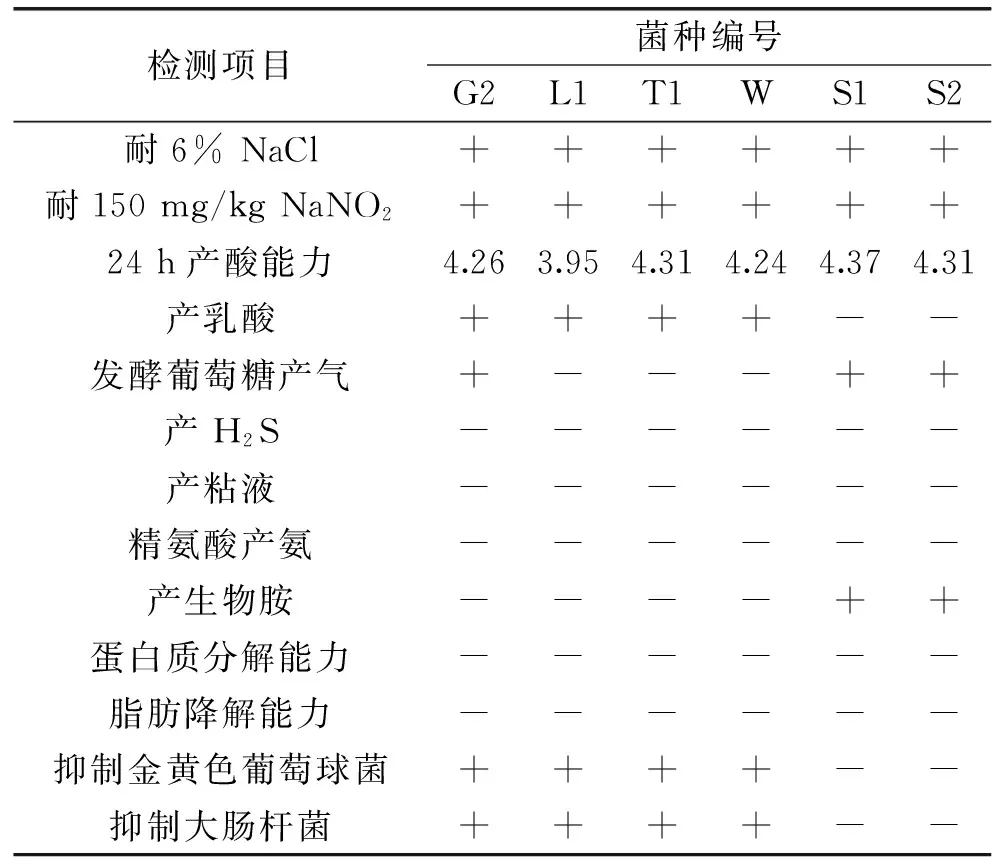
表3 菌株發酵特性測定
2.4L1菌株的16S rDNA全序列分析
序列比對結果見圖2,在比對匹配度最高的結果中,所測得的菌株L1的16S rDNA序列部分與Lactobacillussp.乳酸桿菌屬的不同菌種的16S rDNA序列有很高的同源性。其中,在與已知菌種的匹配中,與鼠李糖乳桿菌(LactobacillusrhamnosusGG,LGG)的序列相似度最高,因此確定L1菌株為LGG。LGG是全球廣受關注的益生菌之一,該菌相對于其他種類的益生菌有更強的動物消化道環境耐受能力和腸道定植能力,具有調節腸道菌群、預防和治療腹瀉和提高機體免疫力等功能[18-20]。目前對于LGG的開發多見于發酵乳制品和益生菌制劑,而其在發酵肉質品中的應用的研究還較少。因此,接下來將以LGG為發酵劑應用于發酵香腸中,進一步檢測其在肉制品中的亞硝酸鹽降解能力。
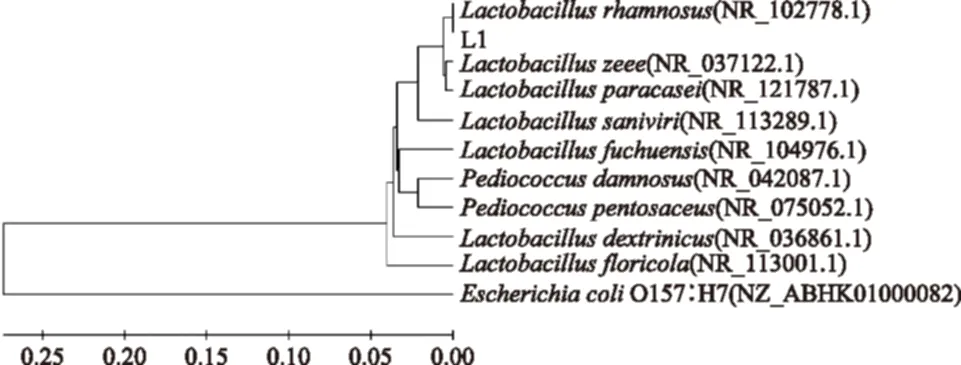
圖2 菌株16S rDNA序列比對結果Fig.2 Results of 16S rDNA sequence alignment
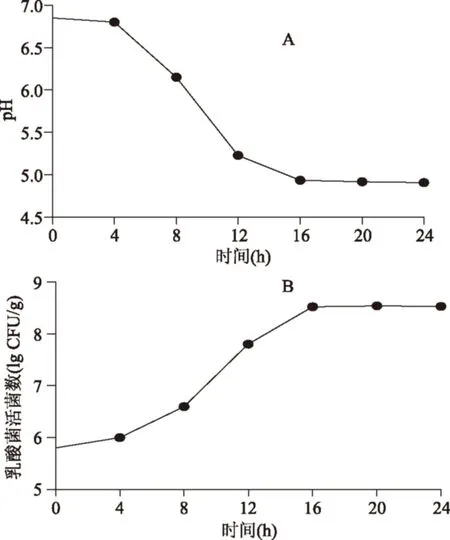
圖3 香腸在發酵過程中的pH和乳酸菌活菌數變化Fig.3 pH and colony-forming unit in fermentation period of fermented sausage
2.5發酵香腸發酵過程中pH與乳酸菌活菌數變化
由圖3可知,在發酵期間,香腸的pH隨著發酵時間延長和乳酸菌菌數增加而快速下降,尤其是發酵8~12 h內降低速度最快,到24 h達到最低值4.91。乳酸菌的活菌數在香腸發酵過程中逐漸增加,在8~12 h這段時間里生長速度達到最大值,在發酵20 h時活菌數達到最大值,數量超過108CFU/g。
2.6發酵香腸發酵和貯藏過程中NaNO2含量變化
為驗證LGG在發酵香腸中的降解亞硝酸鹽的作用,實驗檢測了香腸在發酵過程中的NaNO2含量(圖4),結果顯示,NaNO2含量在發酵期的12~16 h期間快速降低,相對于pH的快速下降時期有一定的滯后,隨后NaNO2含量減少速度逐漸放緩,到發酵結束時含量為12.2 mg/kg。在貯藏期間,NaNO2的含量繼續降低,最終貯藏3周的發酵香腸的NaNO2含量為6.3 mg/kg,遠低于國家規定的殘留量30 mg/kg的標準。在進行肉制品加工過程中,亞硝酸鹽作為發色劑在改善肉制品顏色方面具有重要作用,但過量使用亞硝酸鹽會導致NO-大量殘留,NO-在pH2~4的條件下可與次級胺類物質可形成亞硝胺這種強致癌物質,已有多項研究發現亞硝胺能誘導實驗動物發生癌變,特別是消化系統癌癥,例如食道癌、胃癌、結腸癌等。隨著人們對食品安全意識的提高,多項研究致力于開發能取代亞硝酸鹽的安全且高效的添加劑,研究發現,乳酸菌通過產生乳酸使肉制品的pH降低,生成游離亞硝酸,隨后分解為NO,而NO可與肉中的肌紅蛋白結合形成對熱穩定的玫瑰色的亞硝基肌紅蛋白(NO-Hb),從而賦予產品明亮的鮮紅色,同時亞硝酸鹽分解還有利于提高產品質量和安全性[21-22]。
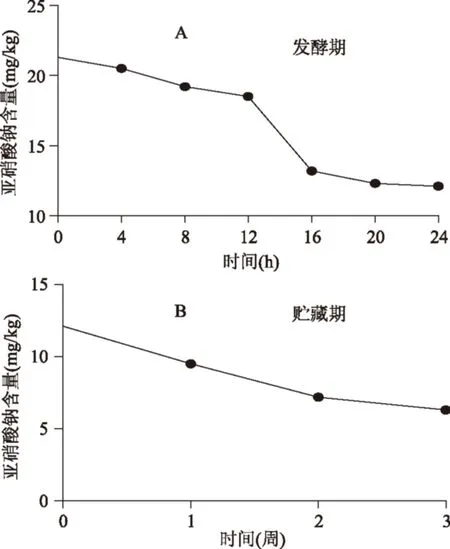
圖4 發酵香腸在發酵和貯藏過程中的NaNO2含量Fig.4 Concentration of NaNO2 in fermentation period and storage period of fermented sausage
2.7發酵香腸的感官評定
分別于貯藏開始時、第1周、第2周、第3周時對發酵香腸進行感官評定,感官評分為10位評定人員打分的平均分。由表4可知,在發酵香腸的貯藏期間,發酵香腸的感官評分隨貯藏時間延長而逐漸下降,當發酵香腸貯藏進行到第3周時,各組發酵香腸的顏色變為灰紅,光澤變淡,切面光澤略微發暗,與貯藏初期相比彈性略微下降,但氣味正常,有淡淡的芳香,仍可食用。
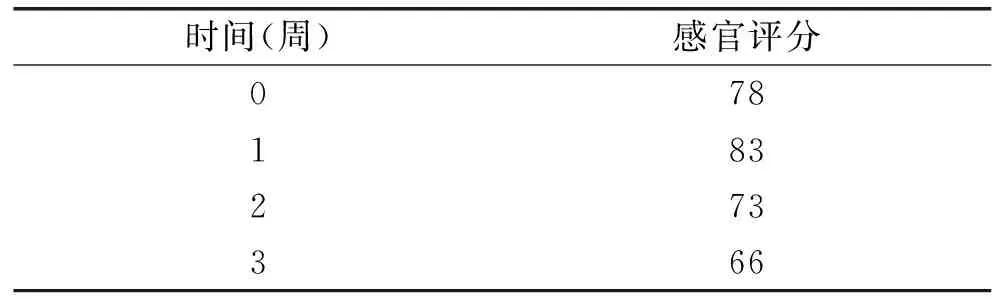
表4 發酵香腸感官評定結果
2.8香腸貯藏期內腐敗菌與致病菌檢測
由表5中數據可知,發酵香腸在貯藏期內由于水活度較低和乳酸菌生成乳酸造成的pH較低的環境,使得大腸菌群、霉菌和酵母菌以及肉毒梭狀芽孢桿菌等微生物生長受到抑制,各項微生物指標符合國家標準(菌落總數≤50000 CFU/g,大腸菌群≤30 CFU/100 g,致病菌不得檢出),由此可推測發酵香腸具有較高的安全性,不易受到外源性腐敗菌和致病菌的污染,但由于整個產品未經高溫蒸煮滅菌,仍存在被污染的風險,這需要對產品生產的原料的質量和生產環境的衛生要嚴格把關,以減少微生物污染的發生。
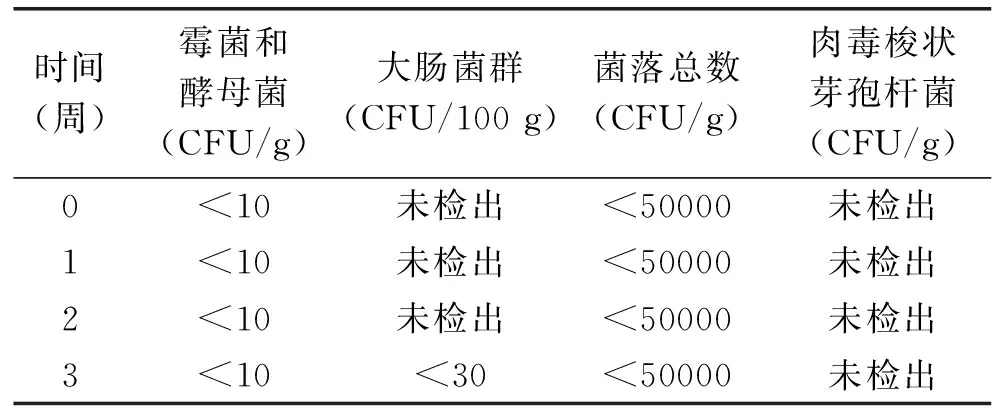
表5 香腸中腐敗菌和致病菌檢測
3 結論
本研究從酸菜中分離到了1株具有較好的降解亞硝酸鹽能力,且適于肉品發酵的乳酸菌菌株,16S rDNA全序列分析鑒定為鼠李糖乳桿菌。以鼠李糖乳桿菌為發酵劑生產的發酵香腸在發酵期結束時的NaNO2含量為12.2 mg/kg。貯藏期間香腸的NaNO2含量繼續降低,最終貯藏3周的發酵香腸的NaNO2含量為6.3 mg/kg,遠低于國家規定的殘留量30 mg/kg的標準,說明鼠李糖乳桿菌在發酵肉制品中具有較好的亞硝酸鹽降解能力,同時微生物指標也證明了此條件生產的發酵香腸安全可靠。此研究為今后的鼠李糖乳桿菌在加工生產品質優良、安全的發酵肉制品的開發應用提供理論依據。
[1]Honikel KO. The use and control of nitrate and nitrite for the processing of meat products[J].Meat Science,2008,78(1-2):68-76.
[2]Sebranek JG,Bacus JN.Cured meat products without direct addition of nitrate or nitrite:what are the issues[J]. Meat Science,2007,77(1):136-147.
[3]Jon OL,Mark T G,Amrita A,et al. Nitrate and nitrite in biology,nutrition and therapeutics[J]. Nature Chemical Biology,2009,5:865-869.
[4]Larsson SC,Bergkvist L,Wolk A. Processed meat consumption,dietary nitrosamines and stomach cancer risk in a cohort of Swedish women[J]. International Journal of Cancer,2006,119(4):915-919.
[5]樓鼎鼎,梁燕,張英,等.竹葉抗氧化物在中式香腸中的應用研究[J].食品科學,2004,11(25):190-191.
[6]王德寶,王佩霞,趙麗華,等. 復合發酵劑對羊肉發酵香腸亞硝酸鹽殘留量和品質的影響[J]. 食品工業科技,2015,36(8):206-209.
[7]Ammor MS,Mayo B. Selection criteria for lactic acid bacteria to be used as functional starter cultures in dry sausage production:An update[J]. Meat Science,2007,76(1):138-146.
[8]Fadda S,López C,Vignolo G.Role of lactic acid bacteria during meat conditioning and fermentation:peptides generated as sensorial and hygienic biomarkers[J]. Meat Science,2007,86(1):66-79.
[9]劉志文,袁偉靜,張三燕,等. 三江鎮腌菜中降解亞硝酸鹽乳酸菌的篩選和初步鑒定[J]. 食品科學,2012(1):166-169.
[10]黃金枝,楊榮玲,唐道邦,等. 不同菌種組合對發酵廣式香腸品質的影響[J]. 現代食品科技,2014(10):147-153.
[11]凌代文. 乳酸細菌分類鑒定及實驗方法[M].北京:中國輕工業出版社,1999:4-5,117-129.
[12]GB/T 5009.33-2010,食品中亞硝酸鹽與硝酸鹽的測定[S].
[13]GB/T 4789.35-2-10,食品微生物學檢驗乳酸菌檢驗[S].
[14]GB/T 4789.15-2010,食品微生物學檢驗霉菌和酵母計數[S].
[15]GB/T 4789.12-2010,食品微生物學檢驗肉毒梭菌及肉毒毒素檢驗[S].
[16]GB 4789.3-2-10食品微生物學檢驗大腸菌群計數[S].
[17]GB 4789.2-2019食品微生物學檢驗菌落總數測定[S].
[18]Ingemar O,Justus R,Reetta S,et al. Mucosal Adhesion Properties of the Probiotic Lactobacillus rhamnosus GG SpaCBA and SpaFEDPilin Subunits[J]. Applied and Environmental Microbiology,2010,76(7):2049-2057.
[19]Minna KS,Soile T,Hilpi R,et al. Lactobacillus Bacteremia during a Rapid Increase in Probiotic Use ofLactobacillusrhamnosusGG in Finland[J]. Clinical Infectious Diseases,2002,35(10):1155-1160.
[20]周鮮嬌,饒穎竹,黃婷娟,等. 發酵酸菜中鼠李糖乳桿菌的分離及其生物活性[J]. 食品工業科技,2014(22):199-202.
[21]陳荷鳳,崔海輝,李兵. 乳酸菌在肉制品加工中的作用[J]. 肉類工業,2001(11):16-17.
[22]徐光域,王衛,郭曉強. 發酵香腸加工中的發酵劑及其應用進展[J]. 食品科學,2002,23(8):306-310.
Isolation and identification of nitrite-degrading lactic acid bacteria from pickles and application in fermented sausage
CUI Jue1,2,SUN Hui-gang1,2,ZHU Zhao-li1,LOU Xue-lian1
(1.College of Food Engineering,Xuzhou Institute of Technology,Xuzhou 221111,China;2.Jiangsu Key Laboratory of Food Resource Development and Quality Safe,Xuzhou Institute of Technology,Xuzhou 221111,China)
Objective:To screen lactic acid bacteria from pickles,which could decompose nitrite in sausage. Methods:At first,lactic acid bacteria were screened from 15 different regional pickles,using MRS medium which add 0.3% CaCO3. Secondly,further experiments were executed according to nitrate degradation efficiency and standards of meat starter,and the bacterial strain which acquired from experiment was identified by using 16S rRNA encoding gene(16S rDNA)sequence.At last,fermented sausages were produced using the lactic acid bacteria asa starter,and concentrations of NaNO2in fermentation and storage period were detected. Results:One strain of lactic acid bacteria meetsthe standards,and it was identified to be 100% similar toLactobacillusrhamnosusGG. The nitrite concentration in fermented sausage was 12.2 mg/kg. At the same time,the results of microbiological detection demonstrated that with this condition,quality of the fermented sausage was safe.Conclusion:LactobacillusrhamnosusGG could significantly eliminate the nitrite in fermented sausage,and could be used as an efficient and healthy starter in fermented sausage production.
pickle;lactic acid bacteria;nitrite;fermented sausage
2015-12-25
崔玨(1980-),女,博士,副教授,研究方向:食品功能因子開發與食品質量控制,E-mail:cuijue1980@hotmail.com。
徐州工程學院自然科學培育項目(XKY2011111)。
TS201.6
A
1002-0306(2016)18-0251-05
10.13386/j.issn1002-0306.2016.18.039

