PAX8、WT-1、HER2在不同轉移方式的晚期卵巢上皮性癌中的差異表達
王麗麗郭紅燕張雪輝張馨田
PAX8、WT-1、HER2在不同轉移方式的晚期卵巢上皮性癌中的差異表達
王麗麗①郭紅燕②張雪輝①張馨田③
目的:探討PAX8、WT-1、HER2在不同轉移方式的晚期卵巢上皮性癌中的表達差異,為臨床治療提供一定的理論基礎。方法:收集臨床樣本,按照轉移方式分為淋巴結轉移組1例、混合轉移組14例和盆腹腔轉移組5例。采用實時定量熒光PCR方法檢測PAX8、WT-1、HER2在20例不同轉移方式的晚期卵巢上皮性癌中的相對表達量。結果:PAX8、WT-1、HER2在20例患者中均有表達;混合轉移組PAX8、WT-1、HER2基因表達高于盆腹腔轉移組。結論:PAX8、WT-1、HER2基因的表達可能與腫瘤的轉移方式有關,可能成為提示預后的基因指標并對臨床有一定提示作用,但仍需擴大樣本進一步驗證。
PAX8; WT-1; HER2; 晚期卵巢上皮性癌; 差異表達
First-author's address:Peking University Third Hospital,Beijing 100191,China
卵巢上皮性癌是全球致死率最高的婦科惡性腫瘤之一,多見于中老年婦女,目前手術及化療是其一線治療方案。盡管手術技術不斷提高,化療藥物不斷更新,卵巢上皮性癌患者的預后卻仍未得到顯著改善,原因主要是卵巢的解剖學結構。卵巢癌起病隱匿,早期癥狀不明顯,70%~80%的患者確診時已是晚期,而晚期病例往往缺乏有效的治療手段,出現轉移和復發是其死亡的主要原因[1]。近年來研究發現這與卵巢上皮性癌的異質性有關,異質性在臨床上的體現主要是:即使是相同組織學類型的晚期卵巢上皮性癌,轉移途徑卻截然不同,如部分病例以盆腹腔廣泛播散轉移為主,淋巴結無轉移;部分病例已出現廣泛的淋巴結轉移,但盆腹腔無廣泛的播散灶;另一些患者盆腹腔及淋巴結均可見廣泛的腫瘤轉移。有研究發現PAX8、WT-1、HER2三種基因與卵巢上皮性癌的發生、發展、浸潤和轉移密切相關,本文旨在探討PAX8、WT-1、HER2在不同轉移類型的晚期卵巢上皮性癌中的表達含量的差異,從而為臨床的診斷、治療、預后評估提供一定的理論基礎。
1 資料與方法
1.1 一般資料 收集北京大學第三醫院臨床病理診斷為Ⅲ期和Ⅳ期的20例卵巢上皮性癌患者的組織標本,并將其分為三組:其中僅1例患者只出現淋巴結轉移,病灶局限在盆腔,無腹腔轉移(淋巴結轉移組);14例患者盆腹腔和淋巴結均有轉移(混合轉移組);5例患者盆腹腔廣泛轉移,而淋巴結轉移為陰性(盆腹腔轉移組)。其中年齡≤45歲者6例,>45歲者共14例;20例患者的組織病理學類型均為漿液性癌;除淋巴結轉移組中1例患者為ⅢA1期外,其余均為ⅢA1期以上,其中ⅢA2期1例,ⅢB期5例,ⅢC期和Ⅳ期有13例;3例患者病理學分級為低級別,余17例為高級別。
1.2 主要生化試劑
1.2.1 化學試劑 包括Trizol、DEPC、瓊脂糖、溴酚藍、溴化乙錠、三氯甲烷、無水乙醇、異丙醇。
1.2.2 分子量標準 Maker Ⅴ。
1.2.3 試劑盒 RevertAid First Strand cDNA Synthesis Kit(購自Thermo公司),IQTMSYBR Green Supermix(購自Bio-rad公司)。
1.2.4 引物設計與合成 普通引物使用Primer Premier 5.0軟件設計,由北京奧科公司合成;Realtime PCR引物由Takara公司設計并合成。
1.2.5 主要儀器 微量低溫高速離心機(Biofuge Stratos)購自Heraeus Instrument公司,凝膠成像分析系統(Gel Doc 2000)購自Bio-Rad公司,MyCycler?PCR儀購自Bio-Rad公司,高壓蒸汽消毒器購自SANYO公司,Bio-rad Minioption PCR實時熒光定量PCR儀購自Bio-Rad公司。
1.3 方法
1.3.1 提取組織中總RNA,逆轉錄合成cDNA 本實驗采用Trizol試劑(購自Invitrogen公司)提取卵巢癌組織中的總RNA,并用紫外分光光度法測定RNA的濃度及純度,最后使用RevertAid First Strand cDNA Synthesis Kit(購自Thermo公司)將RNA反轉錄為cDNA。
1.3.2 檢測PAX8、WT-1、HER2的相對表達量 筆者采用Real-time PCR方法進一步檢測PAX8、WT-1、HER2三種基因在這20例卵巢上皮性癌患者的卵巢癌組織中的cDNA相對表達量,選定β-actin作為內參基因,從而計算目標基金相對表達量,實驗過程和數據分析均于北京大學醫學部藥理系實驗室完成,引物合成由Takara公司完成,引物序列和PCR反應條件如下:
反應在Bio-rad Minioption PCR(實時熒光定量PCR)儀中進行,反應體系如下:
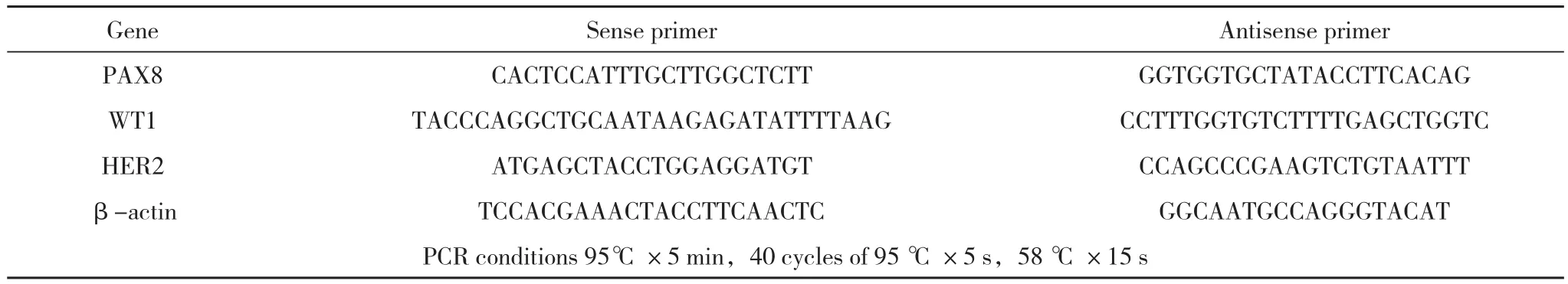
Antisense primer PAX8CACTCCATTTGCTTGGCTCTTGGTGGTGCTATACCTTCACAG WT1TACCCAGGCTGCAATAAGAGATATTTTAAGCCTTTGGTGTCTTTTGAGCTGGTC HER2ATGAGCTACCTGGAGGATGTCCAGCCCGAAGTCTGTAATTT β-actinTCCACGAAACTACCTTCAACTCGGCAATGCCAGGGTACAT PCR conditions 95℃×5 min,40 cycles of 95 ℃×5 s,58 ℃×15 s GeneSense primer

ComponentVolume(μL)Primer(Forward and reverse)2 SYBR Green master mix(購自Bio-rad公司)10 cDNA2 ddH2O6
2 結果
2.1 三組患者PAX8、WT-1、HER2基因表達分布情況比較 PAX8、WT-1、HER2三種基因在20例患者中均有表達,表達分布如圖1。
2.2 PAX8、WT-1、HER2在盆腹腔轉移組和混合轉移組中差異表達 由于淋巴結轉移組僅有1例,易導致假陰性的出現,故進行統計學分析時未列入比較。混合轉移組中三種基因的表達均高于盆腹腔轉移組,在混合轉移組中,HER2基因的表達量約為盆腹腔轉移組的3.5倍,PAX-8基因的表達量約為盆腹腔轉移組的2.5倍,而WT-1基因的表達量約為盆腹腔轉移組的2倍,見圖2。
3 討論
PAX8基因屬于轉錄因子配對盒基因家族,PAX家族蛋白是均由128個氨基酸形成的高度保守區域,該配對盒可識別特異DNA結合部位,啟動轉錄,控制基因調節。現已證明,PAX8在胚胎發育中具有重要作用,尤其是對甲狀腺、腎臟、Wolffian管和Mullerian管的形成起關鍵作用,但在胚胎成熟后,PAX8的表達量大幅減少。
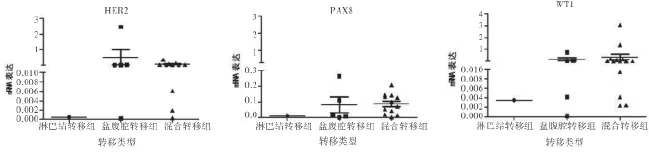
圖1 三組PAX8、WT-1、HER2基因表達分布
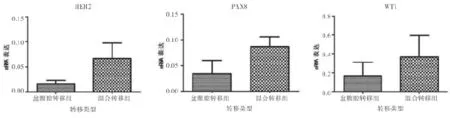
圖2 PAX8、WT-1、HER2在盆腹腔轉移組和混合轉移組中差異表達
有研究表明,在某些癌癥細胞中,PAX8的表達量較高,如原發性及轉移性卵巢上皮性腫瘤[2-3]。有學者發現PAX8在卵巢漿液性、子宮內膜樣、透明細胞癌及卵巢上皮包涵囊腫中存在高表達,可以用于區分漿液性卵巢癌與惡性間皮瘤,也可以區分卵巢癌與乳腺癌[4-5]。另外,有報道證實PAX8對卵巢癌細胞的增殖中起關鍵性作用,在16%的原發性卵巢腫瘤中擴增,有望成為治療卵巢癌的藥物靶點[6-7]。
WT-1基因位于人11號染色體短臂1區3帶,長約50 kb,有10個外顯子,富含“GC”同源序列。WT-1基因是在對遺傳腎臟胚胎腫瘤(Wilm's tumor)的分子遺傳學機制進行研究時發現的,并最先在腎母細胞癌中被定義為抑癌基因,但近來的研究表明它也有癌基因的作用,同時WT-1基因也可以激活某些基因的轉錄[8]。WT-1基因的正常功能是調控細胞生長,抑制其過分增殖,當WT1基因發生突變、缺失或失活,則失去調控細胞生長的功能,導致腫瘤的發生。WT-1基因編碼的蛋白也具有極為復雜的生理功能,它同時具有活化和抑制的雙重作用,在多種腫瘤的發生與發展過程中起著重要作用[9]。
文獻[10]報道,WT-1在卵巢漿液性乳頭狀癌的陽性表達率高,而在卵巢子宮內膜樣癌和大多數子宮內膜漿液性乳頭狀癌表達則呈陰性,這可能對卵巢上皮性癌的分類診斷有所幫助。Goldstein等[11]在30例卵巢漿液性乳頭狀癌中研究發現有29例WT-1陽性表達,陽性率為97%,而18例子宮內膜漿液性乳頭狀癌WT-1均為陰性。亦有研究表明,WT-1基因在52/67(93%)的卵巢漿液性癌中都有表達,但在粘液性癌、子宮內膜癌和透明細胞癌中并沒有觀察到此現象。另外WT-1表達與卵巢漿液性癌的分級和分期有關[12]。以上均說明WT-1基因可以作為診斷漿液性卵巢癌和判斷漿液性卵巢癌分期分級的指標。
HER2即c-erbB-2基因編碼的跨膜受體樣蛋白,是表皮生長因子受體(EGFR)家族的成員之一。HER2基因在正常情況下處于非激活狀態,當受到體內外某些因素作用后,該基因被異常激活,HER2蛋白異常高表達,進而引起瀑布式的連鎖反應,啟動胞內異常增殖的傳導通路,促進細胞生長、增殖、分化和遷移,從而誘發腫瘤形成。一方面,HER2與其他受體結合成異二聚體后能發揮信號轉導功能;另一方面,HER2的異二聚體使EGFR在細胞膜過表達,加速了細胞的增殖,以上兩點與HER2在腫瘤細胞的增殖生長、侵犯和轉移密切相關。
有研究表明,15%~30%的卵巢癌在HER2/neu蛋白過度表達,HER2/neu蛋白過度表達與卵巢癌患者較短存活期呈負相關,可作為預后因素,HER2的高表達與腫瘤細胞的轉化、增殖及侵襲轉移密切相關[13-14]。Suo等[15]發現HER2蛋白表達水平高低與卵巢癌的分化程度關系密切,在多數低分化的卵巢癌組織中HER2的表達水平較高。文獻[16-17]對164例晚期卵巢癌進行研究,發現其中HER2過表達率為16%,但未發現HER2過表達與臨床病理參數、組織學類型及病理分期有相關性。經上述研究提示:PAX8、WT-1、HER2與卵巢上皮性癌本身特征和浸潤、轉移關系密切,故筆者選取上述三種基因分別分析在不同轉移方式的Ⅲ期和Ⅳ期卵巢上皮性癌中的表達差異。
本文研究結果表明:PAX8、WT-1、HER2三種基因在20例患者中均有表達;混合轉移組中三種基因的表達含量均高于盆腹腔轉移組,其中HER2基因的表達量約為盆腹腔轉移組的3.5倍,PAX-8基因的表達量約為盆腹腔轉移組的2.5倍,而WT-1基因的表達量約為盆腹腔轉移組的2倍。這對于臨床工作具有一定的提示作用:PAX8、WT-1、HER2基因表達與晚期卵巢上皮性癌轉移密切相關,可能成為提示預后情況的基因指標,并且通過檢測基因表達的含量可能為手術方式的選擇提供一定的參考。但是由于所收集的病例數較少,在分析混合轉移組和盆腹腔轉移組的PAX8、WT1、HER2基因相對表達量時,兩者之間并沒有出現顯著的統計學差異,且由于淋巴結轉移組只有1例,為了避免統計誤差的出現未將其納入研究,所以筆者無法分析只有淋巴結轉移,病灶局限在盆腔這類患者的基因相對表達量與其他兩組的差異。然而,本次研究只是作為基礎研究的一次初試,并且已經顯示出了一定的臨床價值,以后將收集更多的組織樣本分析不同轉移方式晚期卵巢上皮性癌中三種基因的差異表達,還要在早期卵巢上皮性癌患者以及正常卵巢組織中進一步進行驗證,以期找到新的可靠的卵巢腫瘤標志物。
綜上所述,卵巢上皮性癌是致死率極高的婦科腫瘤,同時也是一種高度異質性的疾病。在臨床上主要體現在:相同組織學類型的卵巢上皮性癌卻存在不同的生物學行為(即臨床表現不同),治療效果和預后也不盡相同。PAX8、WT-1、HER2三種基因與卵巢上皮性癌的發生、發展、浸潤和轉移密切相關。盆腹腔和淋巴結均有轉移時三種基因的表達高于只有盆腹腔轉移而淋巴結陰性者,這對臨床有一定指導作用,可能成為提示預后情況的基因指標或者為手術方式的選擇提供一定的基礎。但是需擴大組織樣本進一步驗證。
[1] Rose S L,Goodheart M J,DeYoung B R,et al.P21 expression predicts outcome in p53-null ovarian carcinoma[J].Clin Cancer Res,2003,9(3):1028.
[2] Mittag J,Winterhager E,Bauer K,et al.Congenital hypothyroid female pax8-deficient mice are infertile despite thyroid hormone replacement therapy[J].Endocrinology,2007,148(2):719.
[3] Bouchard M,de Caprona D,Busslinger M,et al.Pax2 and Pax8 cooperate in mouse inner ear morphogenesis and innervation[J]. BMC Dev Bio1,2010,10(1):1-17.
[4] Bowen N J,Logani S,Dickerson E B,et al.Emerging roles for PAX8 in ovarian cancer and endosalpingeal development[J]. Gynecol Oncol, 2007,104(2):331-337.
[5] Kroll T G,Sarraf P,Pecciarini L,et al.PAX8-PPAR gamma1 fusion oncogene in human thyroid carcinoma[J].Science,2000,289(5483):1357.
[6] Paulette M F,Dan W,Damanzoopinder S,et al.Pair Box 8(PAX8)protein expression in high grade,late stage(stageⅢAnd Ⅳ) ovarian serous carcinoma[J].Gynecol Oncol,2012,127(1):198.
[7] Cheung H W,Cowley G S,Weir B A,et al.Systematic investigation of genetic vulnerabilities across cancer cell lines reveals lineage-specific dependencies in ovarian cancer[J].Proc Natl Acad Sci,2011,108(30):12 372.
[8] Pritchard-Jones K,Hastie N D.Wilms' tumour as a paradigm for the relationship of cancer to development[J].Cancer Surv,1990,9(3):555.
[9] Werner H.Increased expression of the insulin-like growth factor 1 receptor gene,IGF1R,in Wilms tumor is correlated with modulation of IGF1R promoter activity by the WT-1 Wilms tumor gene product[J].Proc Natl Acad Sci USA,1993,90(12):5828.
[10] Wang Z Y.The Wilms' tumor gene product,WT-1,represses transcription of the platelet-derived growth factor A-chain gene[J].J Biol Chem,1992,267(31):21 999.
[11] Goldstein N S,Uzieblo A.WT-l immunoreactivity in uterine papillary serous carcinomas is different from ovarian serous carcinomas[J].Am J Clin pathol,2002,117(4):541.
[12] Al-Hussaini M,Stockman A,Foster H,et al.WT-1 assists in distinguishing ovarian from uterine serous carcinoma and in distinguishing between serous and endometrioid ovarian carcinoma[J].Histopathology,2004,4(2):109.
[13] Huang L W,Garrett A P,Bell D A,et al.Diferential expression of matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 protein and mRNA in epithelial ovarian tumours[J].Gynecol Oncol,2000,77(3):369.
[14] Sebastian S,Settleman J,Reshkin S J,et al.The complexity of targeting EGFR signaling in cancer:from expression to turnover[J].Biochim Biophys Acta,2006,1766(1):120.
[15] Suo Z,Karbovo E,Trope C G,et al.Papillary serous carcinoma of the ovary:an ultrastructural and immunohistochemieal study[J].Ultrastruct Pathol,2004,28(3):141.
[16] Camilleri-Broet S,Hardy-Bessard A C,Le-Tourneau A,et al.HER-2 overerexpression is an independent marker of poor prognosis of advanced primary ovarian carcinoma,a multicenter study of the G1NECO group[J].Ann Oncol,2004,15(1):104.
[17] Gessler M,Poustka A,Cavenee W,et al.Homozygous deletion in Wilms tumours of a zinc-finger gene identified by chromosome jumping[J].Nature,1990,343(6260):774.
Differential Expression of PAX 8,WT-1 and HER2 in Advanced Epithelial Ovarian Cancer with Different Metastatic Modes
WANG Li-li,GUO Hong-yan,ZHANG X ue-hui,et al.//Medical Innovation of China,2016,13(27):020-024
Objective:To explore the differential expression of PAX8,WT-1 and HER2 in advanced epithelial ovarian cancer with different metastatic modes and provide some theoretical basis for clinical treatment. Method:The clinical samples were collected,they were divided into lymph node metastasis group of 1 case,mixed metastasis group of 14 cases and pelvic-abdominal metastasis group of 5 cases according to the metastasis ways.The relative expression of PAX8,WT-1 and HER2 in 20 patients with advanced epithelial ovarian cancer were detected by real-time quantitative fluorescent PCR method.Result:20 cases all had expressed PAX8,WT-1 and HER2.The expression of PAX8,WT-1 and HER2 in mixed metastasis group was higher than that of pelvicabdominal metastasis group.Conclusion:The expression of PAX8,WT-1 and HER2 may be associated with the metastasis way of tumor,and probably become the genetic indicators for clinical work,but it is necessary to expand the sample for further validation.
PAX8; WT-1; HER2; Advanced epithelial ovarian carcinoma; Differential expression
10.3969/j.issn.1674-4985.2016.27.006
①北京大學附屬第三醫院 北京 100191
②北京大學第三醫院
③中山大學中山醫學院
郭紅燕
(2016-07-17) (本文編輯:李穎)

