刺參體內RNA干擾方法的初步研究
張宇鵬+田燚+宸帆+海龍+亞青

摘 要:以刺參溶菌酶基因(lysozyme gene, LYZ)為靶基因探索構建刺參體內RNA干擾體系。構建了3個刺參溶菌酶基因特異性的RNA干擾重組質粒,以刺參體腔液原代培養細胞為靶細胞進行篩選;分別以口腔注射和腹腔注射的方式以及不同的注射劑量對刺參LYZ進行體內RNA干擾,并運用qPCR技術測定刺參LYZ的表達量;最后,對刺參LYZ進行體內RNA干擾,并分別運用qPCR技術和比濁法測定刺參LYZ的表達量及其酶活性。結果顯示:3種RNA干擾重組質粒的沉默效率分別為40%、45%、0%;體腔注射RNA干擾重組質粒時,各組織中LYZ的表達量均出現了顯著的上升(P<0.05),而從口腔注射時,體腔液和肌肉中LYZ的表達量均出現極為顯著的下降(P <0.01),而在管足中未出現明顯變化;當其注射劑量為0.5 μg和5 μg時未對LYZ的表達產生有效的抑制作用;當注射劑量為10 μg和25 μg時,刺參體內LYZ的表達受到了明顯抑制,但是注射劑量為25 μg時,部分刺參個體出現吐腸現象;在轉染12 h后,刺參體腔液、肌肉、體壁、疣足和管足組織中LYZ的表達量開始下降,到第四天后開始回升。表明:只有從口腔注射RNA干擾重組質粒且注射劑量達到10 μg時才能有效地抑制靶基因的表達;刺參體內RNA干擾具有系統性,可以在各個組織間相互傳導。
關鍵詞:刺參;溶菌酶基因;RNA干擾
中圖分類號:S917.1
文獻標識碼:A
RNA干擾(RNA interference)是指雙鏈RNA(dsRNA)在細胞內特異性的誘導與之同源互補的mRNA的降解,從而使相應基因的表達關閉,最終引發基因轉錄后水平沉默的現象(PTGS)[1-3]。到目前為止,RNA干擾是最準確和有效的在“體外”和“體內”條件下抑制特異基因表達的方法[4]。現在,RNA干擾技術被越來越廣泛地應用于水生動物基因組學的研究中。Genciana Terova等[5]利用dsRNA和shRNA抑制肌肉生長抑制素(MSTN)的表達,從而驗證該基因的功能。Liu等[6]使用dsRNA使QM表達沉默,表明QM對于凡納濱對蝦和太平洋白蝦的主動防御起到了正向調節作用。在進行體內RNA干擾時,可以通過浸泡、飼喂和注射等方式將人工構建的RNA干擾序列導入實驗動物體內。Genciana Terova等[5]分別通過電脈沖和注射的方式成功地將dsRNA和shRNA導入海鱸體內。Naoki等[7]的研究表明動物體內RNA干擾存在劑量和時間依賴性的效應。
刺參(Apostuchopus japonicas)具有較高的經濟價值和藥用價值[8],是目前中國水產養殖業的主要養殖品種之一。但是,近年來刺參細菌性和病毒性病害屢屢大面積發生,給養殖業者帶來了巨大損失[9-10]。故提升刺參養殖業者的防病和治病能力顯得愈發迫切。溶菌酶是生物體內極為重要的一種非特異性免疫因子,在機體免疫過程中不僅能催化水解細菌細胞壁而導致細菌溶解死亡[11-12],還可誘導其他免疫因子。水生動物血清溶菌酶活力的高低是衡量機體免疫狀態的指標之一。血清溶菌酶活力提高,其免疫能力也相應提高[13]。Nermeen M Abu-Elala等[14]使用生物活性免疫增強劑-殼源殼聚糖刺激尼羅羅非魚(Oreochrmis niloticus),吞噬活性/指數、NBT、溶菌酶活性及ACH50等免疫參數均顯著上升,且對嗜水氣單胞菌的抗感染能力增強。Patrizia Pagliara等[15]使用高濃度鋅處理海膽(Paracentrotus lividus)后,溶菌酶活性等免疫指標出現短暫下降,同時抗溶藻弧菌V. alginolyticus活性也相應下降,表明海膽的免疫力下降。
本研究以刺參溶菌酶基因的cDNA序列為依據,設計用于RNA干擾的miRNA前體序列,分析不同注射方式和注射劑量條件下刺參溶菌酶基因的表達量變化,為構建刺參體內RNA干擾體系提供參考依據。
1 材料與試劑
1.1 實驗材料
實驗用刺參取自遼寧省大連市東北部海域,暫養于水槽內,飼養溫度為12~16℃,飼料為海參配合飼料。
1.2 主要實驗試劑
大腸桿菌感受態細胞和壯觀霉素購自美國Sigma公司;無內毒素質粒大提試劑盒購自北京天根公司,Entranster-in vivo轉染試劑購自北京英格恩公司,Trizol總RNA提取試劑購自Life Technologies公司,EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix試劑盒購自北京全式金生物技術有限公司,SYBR Premix Ex TaqTMII購自大連寶生物工程有限公司, BLOCK-iT Pol II miR RNAi Expression Vector Kit with EmGFP 均購置于Invitrogen公司,HQ高純度質粒抽提試劑盒購置Invitrogen公司。引物合成和測序由上海生工生物工程股份有限公司完成。
2 方法與操作
2.1 刺參溶菌酶基因miRNA干擾前體序列及主要引物的設計
根據刺參溶菌酶基因(GenBank: KF773759.1)序列設計刺參溶菌酶基因的miRNA干擾前體序列。設計所得序列見表1。
2.2 刺參溶菌酶基因RNA干擾重組質粒的構建
將合成的寡聚單鏈DNA退火連接成雙鏈DNA,然后將退火的雙鏈DNA與RNA干擾載體按下列體系在室溫連接30 min構建RNA干擾重組質粒:5×ligation buffer 4 μL、pcDNA6.2-GW/EmGFP 2 μL、ds oligo(10 nm) 4 μL、T4 DNA ligase(1 U/μL)1 μL、ddH2O 9 μL。接下來將連接產物轉化到大腸桿菌感受態細胞中并涂布于含壯觀霉素的LB固體培養基上于37 ℃恒溫過夜培養至平板上有可見菌落。最后,挑取一個單菌落放入1.5 mL離心管中(試管內有1 mL含壯觀霉素的LB液體培養基),于200 r/min、37 ℃培養箱中搖菌過夜培養。運用PCR技術對菌液進行檢測后選取含正確條帶的陽性克隆菌液送上海生工公司測序。
2.3 制備RNA干擾重組質粒
在含壯觀霉素的LB培養基中接種目標菌株,于37 ℃搖床200 r/min振蕩培養 16 h,按照北京天根公司的質粒提取試劑盒的說明書提取質粒,完成后將質粒置于-20℃保存以用于后續試驗。
2.4 RNA干擾重組質粒的篩選
轉染前一天將刺參體腔液原代培養細胞以5×106個/mL 濃度接種于24孔板中。轉染前換用1 mL無血清和抗生素的LB液體培養基。每孔加入的轉染復合物體積為18 μL,其中含2 μg RNA干擾重組質粒、2 μL Lipofecter脂質體轉染試劑和相應體積的待用培養液。接下來將細胞在37 ℃恒溫培養箱中培養4~6 h后,換上含抗生素的完全培養液,放置在37 ℃的恒溫培養箱中繼續培養,每24 h更換一次培養液。在細胞瞬時轉染48 h后,提取細胞樣品中的總RNA用于測定溶菌酶基因的表達量,所用引物如表2所示。qPCR反應體系的總體積為20 μL且各組分的體積如下:SYBR 10 μL,Primer F/R 各0.8 μL,ROX 0.4 μL,cDNA 1 μL,ddH2O 7 μL;反應條件如下:預熱階段為95 ℃,30 s,PCR反應階段共40個循環分別為95 ℃,5 s、60 ℃,32 s,獲得熔解曲線階段為95 ℃,15 s,60 ℃,60 s,95 ℃,15 s,60 ℃,15 s。
2.5 刺參體內RNA干擾方法的探索
2.5.1 刺參體內RNA干擾的最佳注射方式 選取生長一致、健康狀況良好的刺參隨機分為5組,每組3頭,使用250 μL規格的微量進樣器注射RNA干擾重組質粒,每頭刺參的注射劑量為0.625 μg/g。其中:第一、二組為實驗組,第一組為體腔注射RNA干擾重組質粒miRNA-2,第二組為口腔注射RNA干擾重組質粒miRNA-2;第三、四組為陰性對照組,第三組以體腔注射陰性對照質粒,第四組以口腔注射陰性對照質粒;第五組為空白對照組,未做任何處理。注射48 h后,提取刺參體腔液、管足和肌肉組織的總RNA,使用qPCR技術檢測刺參溶菌酶基因的相對表達量。
2.5.2 刺參體內RNA干擾的最佳注射劑量 選取生長一致、健康狀況良好的刺參隨機分為6組,每組3頭,第一、二、三和四組為實驗組,第五組為陰性對照組,第六組為空白對照組。均以口腔注射的方式將轉染復合物注射進入刺參體內。其中,第一組每頭刺參注射0.5 μg RNA干擾重組質粒miRNA-2,第二組每頭刺參注射5 μg RNA干擾重組質粒miRNA-2,第三組每頭刺參注射10 μg RNA干擾重組質粒miRNA-2,第四組每頭刺參注射25 μg RNA干擾重組質粒miRNA-2,第五組每頭刺參注射等體積的陰性對照質粒,第六組刺參不做任何處理。注射48 h后,分別提取各實驗組刺參體腔液、管足和肌肉組織的總RNA,使用qPCR技術檢測溶菌酶基因的相對表達量。
2.5.3 刺參體內RNA干擾的時間效應 選取生長一致、健康狀況良好的刺參隨機分為7組,每組3頭,用250 μL微量進樣器以口腔注射的方式注射RNA干擾重組質粒。其中:第一、二組分別為空白對照組和陰性對照組,每頭刺參分別注射等體積的PBS和10 μg陰性對照質粒,然后提取刺參各組織總 RNA;第三至七組為實驗組,每頭刺參分別注射10 μg RNA干擾重組質粒miRNA-2,依次于12、24、48 h及4 d和8 d后提取各組織用于后續實驗。最后,應用qPCR技術檢測溶菌酶基因的相對表達量,并使用溶菌酶活性檢測試劑盒檢測各組織樣品中的溶菌酶活性(具體操作見南京建成生物科技有限公司的產品說明書)。
2.6 數據處理
基因相對表達量的計算采用2-ΔΔCT法。溶菌酶基因的表達量是與內參基因CYTB相比的相對表達量。△△CT=(待測樣品目的基因CT的平均值-待測樣本內參基因CT的平均值)-(對照樣品目的基因CT的平均值-對照樣本內參基因CT的平均值)。基因的表達量F=2-△△CT ,目標基因的干擾效率為1-2-△△CT。
此外,溶菌酶活性按下述公式計算:
待測樣本蛋白濃度(g/L)= [(測定OD值-空白OD值)/(標準OD值-空白OD值)]
×標準品濃度(0.563 g/L)
溶菌酶的活力(U/mL)=(空白OD值-測定OD值)×1 000×稀釋倍數
溶菌酶的比活(U/mg)=測試物溶菌酶活力(U/mL)/測試物蛋白濃度(mg/mL)
3 實驗結果
3.1 RNA干擾重組質粒的鑒定與測序
將轉化至感受態大腸桿菌中的RNA干擾重組質粒進行普通PCR檢測后,使用瓊脂糖凝膠電泳觀察片段長度,電泳圖顯示目的片段長度與預期一致,282 bp(圖1 );為進一步檢測插入RNA干擾重組質粒中的DNA片段是否為相應的目的片段及插入方向是否正確,將菌檢正確的菌樣送至生工公司測序,結果表明各個RNA干擾重組質粒中插入的DNA片段均為正確的目的片段且插入方向正確(圖2 )。
3.2 溶菌酶基因特異性的RNA干擾重組質粒篩選結果
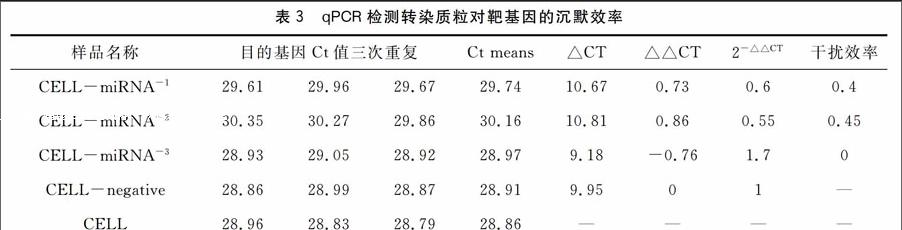
將溶菌酶基因特異性的RNA干擾重組質粒轉染到培養的刺參體腔液原代細胞48 h后,收集細胞并提取總RNA進行qPCR檢測。3種RNA干擾重組質粒對溶菌酶基因的沉默效率分別為40 %、45 %、0 %(見表3)。
3.3 刺參體內RNA干擾的最佳注射方式
為了探索刺參體內RNA干擾時RNA干擾重組質粒的最佳注射方式,運用qPCR技術對分別從刺參口腔和腹腔注射RNA干擾重組質粒48 h后的刺參各組織樣品中溶菌酶基因表達量進行檢測。結果如圖3所示:從體腔注射RNA干擾重組質粒后,各組織中溶菌酶基因表達量均出現了顯著的上升;而從口腔注射RNA干擾重組質粒后,體腔液和肌肉中溶菌酶基因表達量均出現非常顯著的下降,而管足中溶菌酶基因表達量略微上升。
3.4 刺參體內RNA干擾的最佳注射劑量
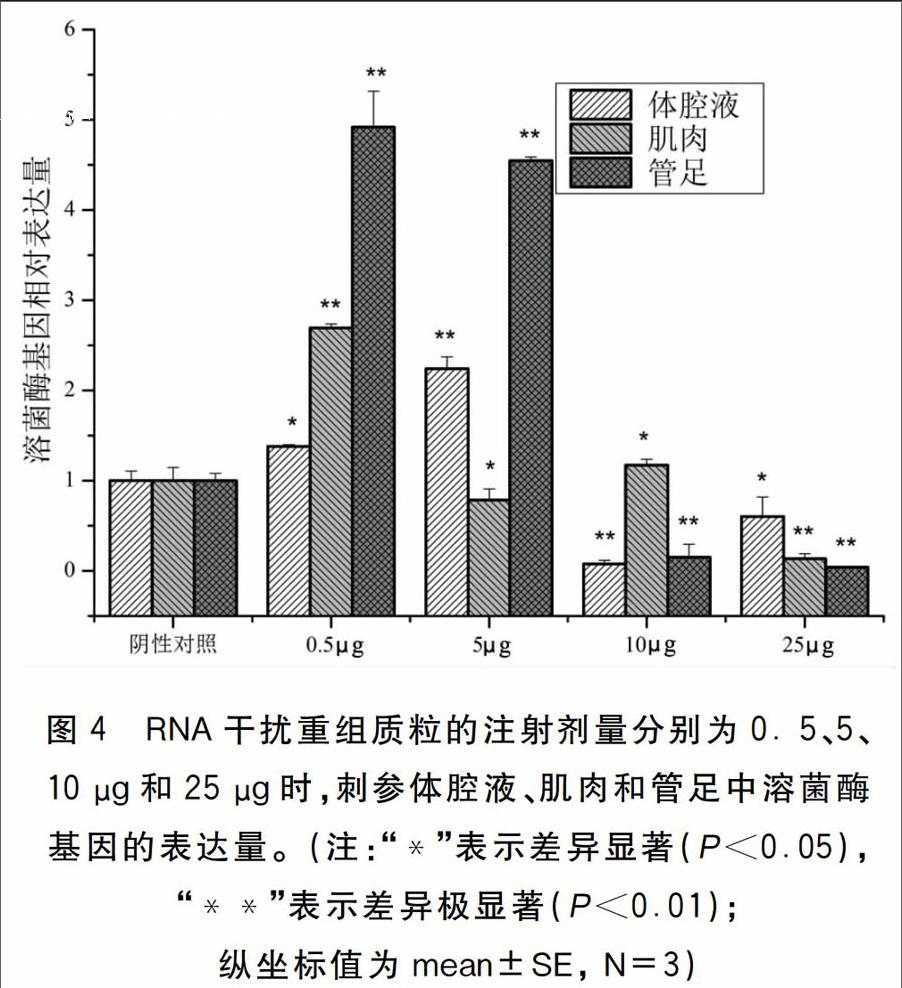
為確定RNA干擾重組質粒的最佳注射劑量,分別以口腔注射的方式給各實驗組刺參注射不同劑量的RNA干擾重組質粒。結果如圖4所示:注射劑量為0.5 μg時刺參各組織中溶菌酶基因表達量均出現顯著上升(P<0.05);注射劑量為5 μg時管足和體腔液中的溶菌酶基因表達量出現極為顯著的上升(P<0.01),而在肌肉的表達量則顯著下降(P<0.05);注射劑量為10 μg時,管足、肌肉和體腔液中溶菌酶基因表達量均出現顯著地下降(P<0.05);注射劑量為25 μg時,管足、肌肉和體腔液中溶菌酶基因表達量亦出現顯著下降(P<0.05),且刺參個體中出現吐腸現象。
3.5 刺參體內RNA干擾的時間效應
為探索刺參體內RNA干擾在其各個組織中的表達模式,使用 RNA干擾重組質粒miRNA -2對刺參進行體內RNA干擾,以口腔注射的方式將其注射進入刺參體內,分別在轉染后12、24、48 h、4 d和8 d提取刺參體腔液、肌肉、體壁、疣足和管足組織樣品測定其mRNA表達量和溶菌酶活性,計算每個實驗組3個平行樣品的平均值并作圖,結果如圖5所示:體腔液中溶菌酶基因的表達量在前48 h呈下降趨勢,之后其表達量快速上升,而其酶活性卻持續下降;肌肉中溶菌酶基因的表達量呈階梯下降并在48 h達到最小值0.1,之后逐步回升,而其酶活性呈波動式變化并在12 h達到最大值468 U/mL;體壁中溶菌酶基因表達量及其酶活性的變化趨勢基本一致,分別在12 h達到最大值1.4和245 U/mL,之后呈下降趨勢;疣足中溶菌酶基因表達量及其酶活性在前48 h未出現顯著變化,分別在48 h達到其最小值,之后其表達量開始逐步回升;管足中溶菌酶基因的表達量在12 h顯著上升(P< 0.05),在48 h其表達量達到最小值0.18,之后逐步回升而其酶活性在12 h達到最大值,之后逐漸下降。
4 討論
自1998年Fire和Mello發現了RNA干擾現象以來[3],RNA干擾技術已經被廣泛應用于癌癥研究、抗病毒及基因功能研究等眾多領域。隨著RNA干擾技術的逐漸成熟,近年來RNA干擾技術在水產動物研究中的應用逐漸增多。本研究旨在刺參中探索建立一種穩定的RNA干擾技術,以幫助研究人員進行刺參基因功能研究及抗病毒等方面的研究。
在動物機體中,RNA干擾質粒可以用電穿孔導入和液體動力注射導入靜脈、皮下及肌肉等方法導入體內[16]。Genciana Terova等[5]用肌肉注射然后使用電脈沖儀導入的方法成功介導了RNA干擾使靶基因沉默。而Liu等[6]通過在太平洋白蝦和凡納濱對蝦腹部注射的方法成功介導RNA干擾使QM沉默,證明QM對于凡納濱對蝦和太平洋白蝦的主動防御起到了正向調節作用。在本研究中,分別從刺參的體腔和口腔注射RNA干擾重組質粒以介導RNA干擾使溶菌酶基因沉默,結果表明:體腔注射的方法未能成功介導RNA干擾使溶菌酶基因沉默,而通過口腔注射則可以成功介導RNA干擾使溶菌酶基因沉默,體腔液和肌肉等組織中的溶菌酶基因表達量出現了極為顯著的下降。
以往的研究表明:RNA干擾對靶基因的抑制效率具有一定的劑量依賴效應[17]。Naoki等[7]給小鼠尾靜脈注射不同劑量的pu6-stem21 RNA干擾重組質粒后發現隨著質粒DNA劑量的增加,RNA干擾的沉默效率逐漸提高。此外,何國平等[18]將外源報告基因和編碼短發夾RNA的質粒共轉染HEK293H細胞,結果表明:在一定范圍內,RNA干擾載體介導的抑制效應與干擾載體劑量大小有關,當劑量加大到足以抑制外源基因表達時,抑制效應則維持在一“平臺期”。由此,從刺參口腔注射不同劑量的RNA干擾重組質粒,結果發現:當RNA干擾重組質粒的注射劑量為0. 5 μg和5 μg時,刺參體腔液、肌肉和管足中溶菌酶基因的表達量顯著上升,這與Naoki等[7]的實驗結果基本一致,即RNA干擾重組質粒的注射劑量過低時,其靶基因的表達不僅未受到抑制,相反其表達量出現顯著上升,可能是由于靶基因的mRNA未被充分地降解并在細胞自身的調節下大量轉錄靶基因mRNA予以補充,接下來隨著質粒DNA劑量的增加,RNA干擾的沉默效率逐漸提高,但是,當RNA干擾重組質粒劑量為25 μg時,RNA干擾重組質粒介導的抑制效應未出現顯著提升且刺參出現吐腸現象,初步推測是由于RNA干擾質粒劑量過大導致刺參出現了強烈的應激反應,從而削弱了RNA干擾重組質粒的抑制效應。
研究表明:在體內和體外RNA干擾中,RNA干擾具有時間依賴性。Naoki等[7]對小鼠的體內RNA干擾實驗顯示:在注射RNA干擾重組質粒6 h后靶基因的表達量才開始下降;而何國平等[18]進行的體外RNA干擾實驗顯示:EGFP mRNA表達水平在6 h無變化,直到12 h后才出現微弱的降低,表明細胞內siNRAs生成需要一定時間誘導表達。在本實驗中,注射RNA干擾重組質粒后12 h,溶菌酶基因表達量上升,之后其表達量下降,表明轉染12 h后,刺參體內開始產生有效的RNA干擾效應,而12 h時溶菌酶基因表達量上升可能是在注射時刺參體內產生應激反應。此外,RNA干擾效應在不同組織之間的傳遞是RNA干擾系統性發生的決定性因素。以前的研究表明,RNA干擾的系統性在不同物種中是不一樣的[19]。某些甲殼動物和線蟲的RNA干擾效應能夠系統性發生[20-21],而果蠅的 RNA 干擾效應則不能系統性發生[19]。本研究發現,不同注射部位能夠引起不同的RNA干擾效應-體腔注射不會引發RNA干擾效應:從體腔注射RNA干擾重組質粒時只在個別組織如管足中引發RNA干擾效應,而從口腔注射則能夠系統性地在刺參各個組織中引發RNA干擾效應;在刺參體內RNA干擾的時間效應實驗中,注射RNA干擾重組質粒12 h后,刺參管足中溶菌酶基因的表達量持續下降,而其酶活性下降后從24 h開始逐步回升,與體腔液中溶菌酶基因的表達量變化趨勢基本一致。通過對刺參的解剖實驗表明:管足和疣足等組成刺參的水管系統,管足中的體液來自體腔液和疣足。推測體腔液和疣足中合成的溶菌酶通過體液循環到達管足,從而導致管足中溶菌酶活性上升。
綜上所述,當RNA干擾重組質粒的注射劑量為10 μg且從口腔注射時能夠在刺參體內引發有效的RNA干擾效應,該RNA干擾效應具有系統性即能夠在不同組織之間的傳遞,且RNA干擾重組質粒介導的刺參體內RNA干擾最長能持續4 d左右。
參考文獻:
[1]Zammore P D, Tuschl T, Sharp P A, et a1. RNAi:double-stranded RNA directs the ATP- dependent cleavage of Mrna at 21 to 23 nucleotide intervals[J]. Cell. 2000, 10l(1): 25-33
[2] Bernstein E; Caudy A A; Hammond S M. Role for a bidentate rebonuclease in the initiation step of RNA entergerence[J]. Nature, 2001,409(6 818): 363-366
[3] Fire A. Xu S. Montgomery M K. et a1. Potent and specific genetic interference by double- stranded RNA in Caenorhabditis elegans [J]. Nature, 1998, 391(6669): 806-811
[4] Shim, M. S., & Kwon, Y. J. Efficient and targeted delivery of siRNA in vivo[J]. FEBS Journal,2010, 277:4814–4827
[5] Genciana Terova, Simona Rimoldi, Giovanni Bernardini, Marco Saroglia. Inhibition of Myostatin Gene Expression in Skeletal Muscle of Fish by In Vivo Electrically Mediated dsRNA and shRNAi Delivery[J]. Mol Biotechnol.2013, 54:673–684
[6] Yongjie Liu, Zhaoying Qian, Rongfeng Qu , et a1. Molecular characterization, immune responsive expression and functional analysis of QM, a putative tumor supperssor gene from the Pacific white shrimp, Litopenaeus vannamei[j]. Fish & Shellfish Immunology 2014 (37) : 1-10
[7] Naoki Kobayashi, Yumi Matsui, Atsushi Kawase,et al. Vector-Based in Vivo RNA Interference: Dose- and TimeDependent Suppression of Transgene Expression [J]. The journal of pharmcology and experimental therapeutics,2004,308(2): 688-693
[8] 樊繪曾. 海參: 海中人參-關于海參及其成分保健醫療功能的研究與開發[J].中國海洋藥物, 2001 (4):37-44
[9] 王印庚, 方波, 張春云, 等. 養殖刺參保苗期重大疾病“腐皮綜合征”病原及其感染源分析[J]. 中國水產科學, 2006, 13(4): 610-616
[10] 張春云, 王印庚, 榮小軍. 養殖刺參腐皮綜合征病原菌的分離與鑒定[J]. 水產學報, 2006, 30(1): 118-123
[11] Mori K, Nakanishi T, Suzuki T, et al. Defense mechanisms in invertebrates and fish[J]. Tanpa- kushitsu Kakusan Koso, 1989, 34(3): 214-223
[12] Boman H G, Faye I, Gudmundsson G H, et al. Cell-free immunity in cecropia. A model system for antibacterial proteins[J]. Eur J Biochem, 1991, 20(1): 23-31
[13] 鄭清梅, 吳悅全, 葉星. 水生動物溶菌酶的研究進展[J]. 上海水產大學學報, 2006, 15(4): 484-486
[14] Nermeen M Abu-Elala; Samah H Mohamed; Manal M Zaki; Alaa E Eissa. Assessment of the immune-modulatory and antimicrobial effects of dietary chitosan on Nile tilapia (Oreochrmis niloticus) with special emphasis to its bioremediating impacts[J] . Fish & shellfish immunology , 2015 , 8(4):678-685
[15] Patrizia Pagliara ; Loredana Stabili. Zinc effect on the sea urchin Paracentrotus lividus immunological competence[J]. Chemosphere,2012, (89):563-568
[16] 陳蕓, 朱作言. RNA干擾在抗病毒研究中的應用[J]. 水生生物學報, 2006, 30(3): 356 -359
[17] Gruber J, Manninga H, Tuschl T, et a1. Specific RNAi mediated gene knockdown in zebrafish cell lines [J]. RNA Biology, 2005(2):101- 105
[18] 何國平,張思仲,王英成,等. 短發夾RNA介導RNA干擾的時間和劑量效應研究[J].生物化學與生物物理進展, 2005, 32(3):258-267
[19] 董超華. 軟體動物毛蚶 RNA干擾技術的應用研究[J]. 中國農學通報 2012, 28(23): 113-117
[20] Robalino J, Bartlett T, Shepard E, et al. Double-stranded RNA induces sequence -specific antiviral silencing in addition to nonspecific immunity in a marine shrimp: convergence of RNA interference and innate immunity in the invertebrate antiviral response[J]. Journal of virology,2005,79:13561-13571
[21] Hunter C P, Winston W M, Molodowitch C, et al. Systemic RNAi in Caenorhabditis elegans[J].Cold Spring Harbor symposia on quantitative biology, 2006, 71: 95-100
(收稿日期:2016-05-19;修回日期:2016-05-23)

