納米TiO2催化一鍋法合成喹唑啉酮并酞嗪酮及3-酰胺基異吲哚酮并喹唑啉酮類化合物
張 金, 劉 佳, 馬養民, 楊秀芳, 程 佩, 范 超, 盧 萍
(1. 陜西科技大學化學與化工學院, 2. 教育部輕化工助劑化學與技術重點實驗室, 西安 710021)
?
納米TiO2催化一鍋法合成喹唑啉酮并酞嗪酮及3-酰胺基異吲哚酮并喹唑啉酮類化合物
張金1,2, 劉佳1, 馬養民1,2, 楊秀芳1,2, 程佩1, 范超1, 盧萍1
(1. 陜西科技大學化學與化工學院, 2. 教育部輕化工助劑化學與技術重點實驗室, 西安 710021)
以納米TiO2為催化劑, 靛紅酸酐、 2-甲酰基苯甲酸、 不同芳香肼或酰肼類化合物為原料, 在乙醇/水溶液為溶劑的條件下一鍋法合成, 高產率得到6個喹唑啉酮并酞嗪酮類化合物及10個3-酰胺基取代的異吲哚酮并喹唑啉酮類化合物. 該方法簡潔高效, 反應條件溫和, 為喹唑啉酮并雜環類化合物的合成提供了一條新途徑.
納米TiO2; 一鍋法; 喹唑啉酮并酞嗪酮; 3-酰胺基異吲哚酮并喹唑啉酮
喹唑啉酮及其衍生物是一類重要的含氮稠雜環化合物[1,2], 在天然產物和藥物分子中廣泛存在, 例如駱駝寧堿A[3]、 吳茱萸次堿[4]和色胺酮[5]等. 此類化合物具有廣譜的生物及藥理活性, 例如抗菌[6]、 抗炎[7]、 抗腫瘤[8]、 抗驚厥[9]及預防高血壓[10]等. 喹唑啉酮骨架并多環化合物具有重要應用價值, 例如, 異吲哚酮并喹唑啉酮類化合物可作為一種潛在的Tumor Necrosis Factor-alpha(TNF-α)抑制劑[11], 用于治療類風濕性關節炎和潰瘍性結腸炎等炎癥; 喹唑啉酮并吲唑類化合物是潛在的磷酸二酯酶抑制劑[12], 可以用于治療哮喘和慢性肺炎等疾病, 同時這類化合物還是一種新型的藍色熒光試劑材料[13]; 帶有二芳基脲結構的喹唑啉衍生物具有潛在的抗腫瘤作用[14]; 前文[15]報道了喹唑啉酮螺吲哚酮類化合物對細菌有良好的抑制作用.
近年來, 關于以喹唑啉酮為骨架的稠雜環化合物的合成取得了一些進展[16,17]. Kuma等[12]及Yang等[18]分別以金屬鈀鹽為催化劑利用不同的原料合成喹唑啉酮并吲唑類化合物. Chen等[19]與Yang等[20]采用一價銅鹽作為催化劑合成了一系列喹唑啉酮并吲唑類化合物. 另外, 酵母菌[21]、 環糊精[22]及納米金屬氧化物[23]等作為催化劑及微波輔助[24]等催化方法也被應用于稠雜環類喹唑啉酮類化合物的合成, 并取得良好的產率. 但這些方法均存在催化劑價格昂貴、 溶劑毒性大及產物后處理復雜等局限性. 為了設計更加簡潔的合成路線, 得到更多具有潛在活性的稠雜環化合物, 本文利用納米TiO2催化三組分一鍋法反應, 以乙醇/水溶液為溶劑, 更加綠色環保; 并且使用不同的氮源(肼或酰肼)參與反應時, 分別得到喹唑啉酮并酞嗪酮類化合物及3-酰胺基取代的異吲哚酮并喹唑啉酮類化合物.
1 實驗部分
1.1試劑與儀器
靛紅酸酐、 5-氯靛紅酸酐和納米TiO2(粒徑5~15 nm)均購于薩恩化學技術上海有限公司; 2-甲酰基苯甲酸、 苯甲酰肼、 對甲基苯甲酰肼、 對甲氧基苯甲酰肼、 3-吡啶甲酰肼、 乙酰肼、 苯肼、 對氯苯肼和對甲氧苯肼均為分析純, 購于北京偶合科技有限公司; 乙醇、 石油醚和乙酸乙酯(均為分析純)均購于天津市河東區紅巖試劑廠; 柱層析Al2O3(200~300目)購于天津科密歐試劑有限公司.
XT5型顯微熔點儀(北京市科儀電光儀器廠); VECTOR-22型傅里葉紅外光譜儀、 AVANCE Ⅲ 400 MHz核磁共振儀(TMS內標)和Impact HD Q-TOF高分辨質譜(德國Bruker公司); 旋轉蒸發儀(上海亞榮科技有限公司); DF-101S型集熱式恒溫加熱磁力攪拌器(鄭州長城科工貿有限公司).
1.2實驗過程
目標化合物5a~5f及6a~6j的合成路線如Scheme 1所示.

5a:R1=H, R2=H; 5b:R1=H, R2=OCH3; 5c:R1=H, R2=Cl; 5d:R1=Cl, R2=H; 5e:R1=Cl, R2=OCH3; 5f:R1=Cl, R2=Cl; 6a:R1=H, R3=Ph; 6b:R1=H, R3=4-CH3-Ph; 6c:R1=H, R3=4-OCH3-Ph; 6d:R1=H, R3=3-pyridyl; 6e:R1=H, R3=CH3; 6f:R1=Cl, R3= Ph; 6g:R1=Cl, R3=4-CH3-Ph; 6h:R1=Cl, R3=4-OCH3-Ph; 6i:R1=Cl, R3=3-pyridyl; 6e:R1=Cl, R3=CH3Scheme 1 Synthesis of isoindolo[2,1-a]quinazolinone and quinazolino[2,1-b]phthalazine-5,8-dione derivatives
1.2.1反應條件的優化以靛紅酸酐(1.0 mmol)、 2-甲酰基苯甲酸(1.1 mmol)和苯肼(1.1 mmol)為反應底物, 對合成喹唑啉酮并酞嗪酮類化合物反應的催化劑用量和溶劑進行探索, 利用薄層色譜層析(TLC)監測反應進程, 根據不同反應條件下的產率篩選出最佳反應條件.
1.2.2反應底物的拓展在優化的反應條件下, 向反應瓶中加入靛紅酸酐、 2-甲酰基苯甲酸、 芳香肼或酰肼類化合物, 以3 mL乙醇水溶液(乙醇與水體積比為1∶1)為溶劑, 攪拌加熱至80 ℃回流反應4 h后, 利用柱層析(用石油醚和乙酸乙酯分別以體積比10∶2, 10∶3, 10∶4, 2∶1和1∶1進行梯度洗脫)對產物分離純化, 粗產品用二氯甲烷重結晶, 得到純品化合物. 化合物的結構經核磁共振氫譜、 核磁共振碳譜、 紅外光譜及高分辨質譜表征. 所得化合物的表征數據如表1所示, 核磁共振譜圖、 紅外譜圖及質譜圖見圖S1~S64(見本文支持信息).

Table 1 Appearance, yields, melting points and HR-MS data of compounds 5a—5f and 6a—6j
Continued

Compd.Appearancem.p./℃HRMS(ESI)(calcd.),m/z[M+H]+IR(KBr),ν/cm-16hWhitesolid233—2344560723(4560727)173529,165435,150835,102170,669816iWhitesolid199—2014050748(4050754)324055,170944,165475,148351,139686,109893,91388,744856jWhitesolid217—2193420636(3420645)327439,173321,170590,166870,148500,139700,82531,74587

Table 2 1H NMR and 13C NMR data of compounds 5a—5f and 6a—6j
Continued

Compd.1HNMR(400MHz),δa13CNMR(100MHz),δb6f868(s,1H),806(d,J=87Hz,1H),791(dd,J=80,47Hz,4H),760(dd,J=89,55Hz,4H),748(dd,J=165,86Hz,3H),670(s,1H)16703,16466,16318,13741,13497,13397,13264,13258,13128,13058,13027,13022,12864,12854,12708,12493,12441,12163,11963,71376g874(s,1H),804(d,J=87Hz,1H),787(dd,J=51,32Hz,2H),780(d,J=82Hz,2H),763—756(m,3H),748(dd,J=84,36Hz,1H),722(d,J=80Hz,2H),665(s,1H),241(s,3H)16735,16512,16371,14383,13790,13544,13439,13303,13170,13098,13063,12960,12909,12785,12759,12547,12482,12206,12011,7182,21656h857(s,1H),808(d,J=87Hz,1H),793(dd,J=140,56Hz,4H),764(tt,J=74,41Hz,3H),757—750(m,1H),695(d,J=88Hz,2H),672(s,1H),390(s,3H)16696,16517,16380,16345,13804,13551,13439,13302,13180,13103,13064,12963,12912,12553,12485,12294,12211,12025,11422,7193,55526i1143(s,1H),917(s,1H),888(d,J=40Hz,1H),844—828(m,1H),814(dd,J=87,29Hz,1H),803—798(m,2H),791(dd,J=87,26Hz,1H),782(t,J=70Hz,1H),776(t,J=73Hz,1H),767(d,J=30Hz,1H),759(d,J=74Hz,1H),685(s,1H)16514,16478,16224,15325,14863,13834,13568,13558,13426,13375,13119,13089,12962,12806,12578,12431,12399,12241,12046,9950,71466j1060(s,1H),806(d,J=87Hz,1H),795(d,J=79Hz,2H),783(t,J=75Hz,2H),776(d,J=71Hz,1H),764(d,J=75Hz,1H),664(s,1H),211(s,3H)16993,16486,16214,13825,13548,13407,13363,13104,13083,12959,12793,12593,12418,12234,12050,7118,2034
a. Compounds 5a—5f, 6b, 6d, 6f, 6g, 6h:1H NMR(400 MHz, CDCl3),13C NMR(100 MHz, CDCl3);b. compounds 6a, 6c, 6e, 6i, 6j:1H NMR(400 MHz, DMSO-d6),13C NMR(100 MHz, DMSO-d6).
2 結果與討論
2.1最佳反應條件探索
以靛紅酸酐(1.0 mmol)、 2-甲酰基苯甲酸(1.1 mmol)和苯肼(1.1 mmol)為反應底物, 探索納米TiO2催化合成喹唑啉酮并稠雜環類化合物的最佳反應條件(反應溶劑, 催化劑用量), 結果如表3所示. 利用TLC監測反應進程, 比較反應所得化合物純品的產率, 篩選出最佳反應條件. 由表3可知, 不使用催化劑時, 未得到目標化合物(表3, Entry 1); 使用不同量的納米TiO2為催化劑時, 目標產物產率從20%提高到89%, 說明納米TiO2在反應過程中起到了關鍵作用. 當分別使用純乙醇、 甲醇或水為溶劑時, 產率分別為32%, 20%和40%(表3, Entries 2~4). 使用不同體積比的乙醇/水為溶劑進行反應4 h后, 發現產率在乙醇與水體積比為1∶1時達到89%(表3, Entries 5~9), 說明水作為溶劑有利于催化反應的進行, 而乙醇作為溶劑有利于原料在溶劑中分散, 因此選擇乙醇/水(體積比1∶1)為最佳反應溶劑. 還考察了催化劑的用量對產率的影響, 當催化劑用量(摩爾分數)從3%增加到5%時, 產率不斷增加, 當催化劑用量大于5%, 產率無明顯增加(表3, Entries 7,10~13), 因此, 選擇最佳催化劑用量為5%.

Table 3 Optimization of the reaction conditionsa
綜上, 篩選出最優反應條件為使用靛紅酸酐(1.0 mmol)、 2-甲酰基苯甲酸(1.1 mmol)和肼及酰肼類衍生物(1.1 mmol)進行一鍋法反應, 以5%納米TiO2為催化劑, 以乙醇/水(體積比為1∶1)為溶劑, 反應4 h后得到產物.
2.2反應底物的拓展
在最優反應條件下, 對反應底物的適用范圍進行了考察. 首先選取帶有不同取代基的芳香肼類化合物作為氮源, 與靛紅酸酐及2-甲酰基苯甲酸進行反應, 共合成了6種喹唑啉酮并酞嗪酮化合物5a~5f, 其中5b~5f為首次合成. 與苯肼為底物進行反應的產率(表4, Entry 1)相比, 當芳香肼上帶有供電子基團甲氧基時, 反應產率高達93%(表4, Entry 2), 說明反應物中帶有供電子基團利于雜環的形成. 當芳香肼上有鹵素取代時, 產率相對降低(表4, Entries 3和4). 另外, 當選用5-氯靛紅酸酐進行反應時, 產率略有下降(表4, Entries 4~6).
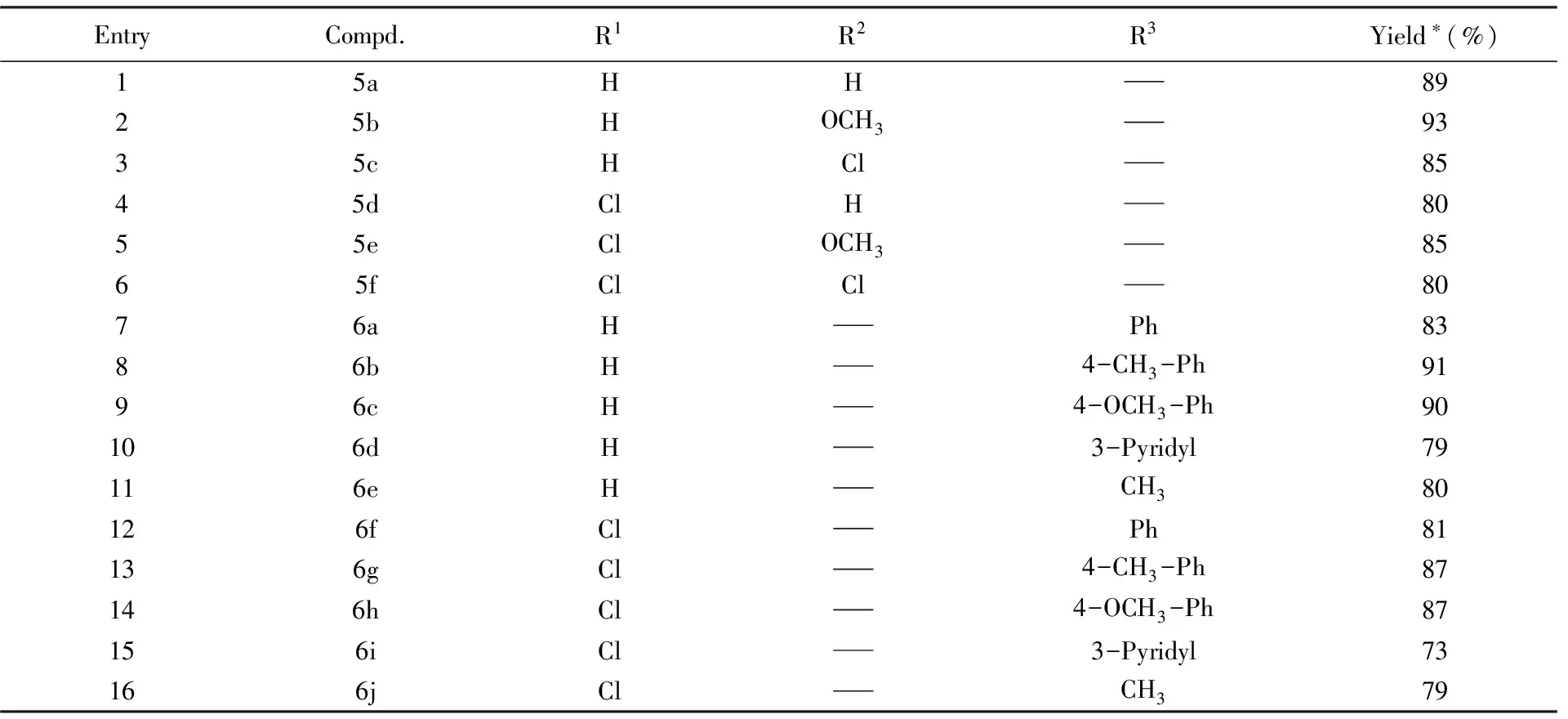
Table 4 One-pot synthesis of isoindolo[2,1-a]quinazolinone and quinazolino[2,1-b]phthalazine-5,8-dione derivatives
* Isolated yield.
在優化的反應條件下, 當選取酰肼衍生物作為氮源進行反應時, 并未得到喹唑啉酮并酞嗪酮類化合物, 而是以高收率得到了一系列3-酰胺基取代的異吲哚酮并喹唑啉酮類化合物6a~6j, 其中6b~6j為首次報道(見表4). 由表4可知, 與選用苯甲酰肼進行反應對比(表4, Entry 7), 當選用帶有供電子基團的芳香酰肼進行反應時, 產率明顯提高(表4, Entries 8, 9, 13和14). 當選用3-吡啶酰肼進行反應時, 產物產率略有下降, 這與3-吡啶酰肼有一定的吸電子作用有關(表4, Entries 10, 15). 當選用乙酰肼進行反應時, 與芳香酰肼參與反應時的產率相比略有減小, 說明芳香酰肼更有利于環的形成(表4, Entries 11, 16).
2.3反應機理的推測
納米TiO2催化合成喹唑啉酮并酞嗪酮和3-酰胺基異吲哚酮并喹唑啉酮可能的反應機理如Scheme 2所示, 推測合成反應可能按照A和B 2種不同的途徑進行. 首先, 靛紅酸酐在納米TiO2的作用下, 親核反應活性增加, 與芳香肼或酰肼類化合物反應脫去1分子CO2, 分別生成中間體ⅠA或ⅠB. 在納米TiO2作用下, 中間體ⅠA或ⅠB與2-甲酰基苯甲酸的醛羰基縮合分別生成中間體ⅡA或ⅡB, 中間體ⅡA和ⅡB發生分子內的環化反應, 再經過1,5-H質子轉移形成中間體喹唑啉酮環, 得到中間體ⅢA和ⅢB. 其中, A途徑生成的ⅢA中間體上的羧基與肼上的氨基發生縮合反應, 從而生成喹唑啉酮并酞嗪酮類化合物5. 然而, 中間體ⅢB上由于酰肼上的氨基與羰基相連, 導致酰肼氮原子上的電子云密度降低, 減小了其親核進攻的活性, 不能生成酞嗪酮環, 羧基與喹唑啉酮環上的氨基發生縮合反應, 脫去1分子水進而生成3-酰胺基異吲哚酮并喹唑啉酮類化合物6.

Scheme 2 Proposed formation mechanism of compounds 5 and 6
2.4催化劑的可回收性
通過離心分離對催化劑進行回收, 通過對其催化活性進行考察發現, 相同的催化條件下催化劑重復使用4次,產率無明顯降低(見圖1).

Fig.1 Recyclability of the catalyst for the one-pot synthesis of compound 5a under the optimal reaction
綜上所述, 以納米TiO2作為催化劑, 靛紅酸酐、 酰肼或芳香肼類化合物與2-甲酰基苯甲酸在乙醇/水(體積比為1∶1)溶劑中回流, 一鍋法合成了喹唑啉酮并酞嗪酮及3-酰胺基異吲哚酮并喹唑啉酮類化合物, 共合成16個化合物, 其中有14個化合物為首次報道. 該合成方法簡潔易行, 反應條件溫和, 使用溶劑綠色環保, 催化劑廉價且用量少, 為喹唑啉酮并雜環類化合物的合成提供了新方法.
支持信息見http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20160292.
[1]Khan I., Ibrar A., Abbas N., Saeed A.,Eur.J.Med.Chem., 2014, 76, 193—244
[2]Khan I., Ibrar A., Ahmed W., Saeed A.,Eur.J.Med.Chem., 2015, 90, 124—169
[3]Servais A., Azzouz M., Lopes D., Courillon C., Malacria M.,AngewChem.Int.Ed., 2007, 46(4), 576—579
[4]Granger B. A., Kaneda K., Martin S. F.,Org.Lett., 2011, 13(17), 4542—4545
[5]Bandekar P. P., Roopnarine K. A., Parekh V. J., Mitchell T. R., Novak M. J., Sinden R. R.,J.Med.Chem., 2010, 53(9), 3558—3565
[6]Grover G., Kini S. G.,Eur.J.Med.Chem., 2006, 41(2), 256—262
[7]Manivannan E., Chaturvedi S. C.,Bioorg.Med.Chem., 2011, 19(15), 4520—4528
[8]Giardina D., Martarelli D., Sagratini G., Angeli P., Ballinari D., Gulini U., Melchiorre C., Poggesi E., Pompei P.,J,Med.Chem., 2009, 52(15), 4951—4954
[9]Kashaw S. K., Kashaw V., Mishra P., Jain N. K., Stables J. P.,Eur.J.Med.Chem., 2009, 44(11), 4335—4343
[10]Jain K. S., Bariwal J. B., Kathiravan M. K., Phoujdar M. S., Sahne R. S., Chauhan B. S., Shah A. K., Yadav M. R.,Bioorg.Med.Chem., 2008, 16(9), 4759—4800
[11]Kumar K. S., Kumar P. M., Kumar K. A., Sreenivasulu M., Jafar A. A., Rambabu D., Krishna G. R., Reddy C. M., Kapavarapu R., Shivakumar K., Priya K. K., Parsa K. V., Pal M.,Chem.Commun., 2011, 47(17), 5010—5012
[12]Siva Kumar K., Mahesh Kumar P., Sreenivasa Rao V., Jafar A. A., Meda C. L. T., Kapavarapu R., Parsa K. V. L., Pal M.,Org.Biomol.Chem., 2012, 10(15), 3098—3103
[13]Yang W., Chen J., Huang X., Ding J., Liu M., Wu H.,Org.Lett., 2014, 16(20), 5418—5421
[14]Hou Y., Wu S., Ma L., Bai J., Liu Z., Zhao Y.,Chem.Res.ChineseUniversities, 2015, 31(5), 766—773
[15]Zhang J., Zhao J., Wang L., Liu J., Ren D., Ma Y.,Tetrahedron, 2016, 72(7), 936—943
[16]Tang J. H., Shi D. X., Wang X. Z., Liu X., Li J. R.,Chem.J.ChineseUniversities, 2012, 33(3), 501—506(唐健紅, 史大昕, 王秀珍, 劉璇, 李加榮. 高等學校化學學報, 2012, 33(3), 501—506)
[17]Zhang J., Ren D., Ma Y., Wang W., Wu H.,Tetrahedron, 2014, 70(34), 5274—5282
[18]Yang W., Qiao R., Chen J., Huang X., Liu M., Gao W., Ding J., Wu H.,J.Org.Chem., 2015, 80(1), 482—489
[19]Chen D., Dou G., Li Y., Liu Y., Wang X.,J.Org.Chem., 2013, 78(11), 5700—5704
[20]Yang W., Ye L., Huang D., Liu M., Ding J., Chen J., Wu H.,Tetrahedron, 2013, 69(46), 9852—9856
[21]Avalani J. R., Patel D. S., Raval D. K.,J.Mol.Catal.B:Enzym., 2013, 90, 70—75
[22]Reddy G. R., Reddy T. R., Chary R. G., Joseph S. C., Mukherjee S., Pal M.,TetrahedronLett., 2013, 54(49), 6744—6746
[23]Santra S., Bagdi A. K., Majee A., Hajra A.,RSCAdv., 2013, 3(47), 24931—24935
[24]Milad T., Haniyeh A., Hamideh N.,Chem.Res.ChineseUniversities, 2014, 30(3), 405—408
(Ed.:P, H, D, K)
? Supported by the Natural Science Basic Research Plan in Shaanxi Province of China(No.2014JQ2064), the Scientific Research Project Item for Key Laboratory of Shaanxi Province Education Department, China(No.15JS012) and the Foundation for Young Scholars of Shaanxi University of Science & Technology, China(No.BJ12-26).
TiO2Nanoparticles-catalyzed One-pot Synthesis of Quinazolino[2,1-b]phthalazin-8-one and 3-Acylamino Isoindolo[2,1-a]quinazoline Derivatives?
ZHANG Jin1,2, LIU Jia1, MA Yangmin1,2*, YANG Xiufang1,2, CHENG Pei1, FAN Chao1, LU Ping1
(1. College of Chemistry & Chemical Engineering, Shaanxi University of Science & Technology, Xi’an 710021, China;2.KeyLaboratoryofAuxiliaryChemistry&TechnologyforChemicalIndustry,MinistryofEducation,Xi’an710021,China)
An efficient and simple one-pot method was developed for the synthesis of two kinds ofN-fused quinazolinone derivatives using nano TiO2particles as catalyst from isatoic anhydride, 2-carboxy benzaldehyde, hydrazides or aromatic hydrazines. Six quinazolino[2,1-b]phthalazin-8-ones and ten 3-acylamino isoindolo[2,1-a]quinazolines were obtained in excellent yields, and the reaction refluxed in aqueous ethanol were environmentally friendly. Attractive features of this methodology were its versatility, mild condition and high efficiency in creating two different structures in a single operation.
TiO2Nanoparticles; One-pot reaction; Quinazolino[2,1-b]phthalazin-8-one; 3-Acylamino isoindolo[2,1-a]quinazoline
10.7503/cjcu20160292
2016-04-29. 網絡出版日期:2016-08-18.
陜西省自然科學基礎研究計劃項目(批準號:2014JQ2064)、 陜西省教育廳重點實驗室項目(批準號:15JS012)和陜西科技大學博士科研啟動基金(批準號:BJ12-26)資助.
O626.4
A
聯系人簡介:馬養民, 男, 博士, 教授, 博士生導師, 主要從事天然產物提取、 鑒定及合成研究. E-mail:mym63@sina.com

