聚胸腺嘧啶單鏈DNA-CuNCs熒光增強法用于汞離子的高靈敏檢測
李 婷, 曹 忠, 李盼盼, 何婧琳, 肖 慧, 楊 嬋
(長沙理工大學化學與生物工程學院, 電力與交通材料保護湖南省重點實驗室,微納生物傳感與食品安全檢測協同創新中心, 長沙 410114)
?
聚胸腺嘧啶單鏈DNA-CuNCs熒光增強法用于汞離子的高靈敏檢測
李婷, 曹忠, 李盼盼, 何婧琳, 肖慧, 楊嬋
(長沙理工大學化學與生物工程學院, 電力與交通材料保護湖南省重點實驗室,微納生物傳感與食品安全檢測協同創新中心, 長沙 410114)
基于Hg2+與DNA中胸腺嘧啶(T)結合的高度特異性和DNA銅納米簇的熒光增強性質, 構建了一種簡便、 靈敏檢測汞離子的新方法. 當Hg2+存在時, 聚T單鏈DNA(P1) 通過T-Hg2+-T 特異性結合形成雙鏈DNA, Cu2+經抗壞血酸鈉還原后生成的中間體Cu+與雙鏈DNA螺旋結構間的氫鍵部分有強的結合力, 促使Cu0附著聚集在雙鏈DNA上形成銅納米簇, 導致體系熒光增強, 從而實現對汞離子的高靈敏檢測. 體系熒光強度與Hg2+濃度的對數值成正比, 對Hg2+檢測的線性范圍為1.0 nmol/L~10 μmol/L, 檢出限達0.4 nmol/L, 對湖水樣品中Hg2+檢測的回收率達到97.2%~106.6%. 與傳統方法相比, 該方法具有無需標記、 檢出限低及選擇性好等優點, 可用于環境水體中汞離子的測定.
熒光增強; 環境水樣; 銅納米簇; T-Hg2+-T; 汞離子
汞離子是環境中危害最大的重金屬污染物之一, 具有致癌、 致畸作用, 是一種蓄積性毒物, 容易侵蝕人的腎臟、 腸胃和神經系統, 嚴重危害人體健康[1]. 因此, 尋求快速、 準確檢測汞離子的方法對于食品安全、 環境污染及臨床醫學等領域具有重要意義. 目前, 檢測汞離子的方法有比色法[2]、 電化學法[3]、 表面增強拉曼光譜法[4]和表面等離子體共振法[5]等. 這些方法大都存在操作復雜、 分析成本高等缺點, 使其應用受到限制. 熒光分析法具有響應時間短、 靈敏度高、 選擇性好、 用樣量少及操作簡便等優點, 近年來備受青睞[6]. 目前, 檢測汞離子的熒光探針主要有以下5種類型:(1) 有機染料, 如王恩舉等[7]基于羅丹明B與1,8-萘酰亞胺間的熒光共振能量轉移, 構建了一種高選擇性Hg2+比率熒光探針, 加入汞離子可誘導探針分子在540 nm處的發射帶逐漸消失, 同時在580 nm附近產生強熒光, 溶液顏色由淺綠色變成橙色, 實現了對汞離子的比色和比率熒光雙重響應. 該方法雖然熒光量子產率高且熒光染料易得, 但其熒光發射光譜寬、 穩定性差且易被漂白. (2) 共軛聚合物, 如Liu等[8]以聚[3-(3′-N,N,N-二甲基氨基-1′-Pro-丙氧基)-4-甲基-2,5-噻吩鹽酸鹽](PMNT)和汞特異型富胸腺嘧啶寡核苷酸(MSO)為檢測器, MSO易與Hg2+形成T-Hg2+-T莖環結構, 利用PMNT與Hg2+和Hg2+-MSO不同的連接方式誘發體系構象變化, 從而展現出熒光性能上的差異, 實現了對汞離子的靈敏檢測. (3) 量子點, 如Freeman等[9]用雙(磺基)辛二酸為雙官能團耦合富胸腺嘧啶核酸修飾CdTe/ZnS量子點, 當存在汞離子時, 量子點末端核酸形成T-Hg2+-T結構誘發體系熒光猝滅, 此熒光探針的汞離子檢出限為10 nmol/L. 該方法的量子點合成過程較復雜, 且生物相容性不佳. (4) 納米粒子, 如Huang等[10]報道了一種基于汞離子聚集誘導猝滅11-巰基十一酸修飾的金納米粒子熒光傳感器, 并通過改變金納米粒子表面的硫醇配體種類來調控體系熒光性能, 汞離子的檢出限為5 nmol/L. 此法雖然實現對汞離子的靈敏檢測, 但納米粒子表面需修飾, 操作較繁瑣. (5) 金屬納米簇, 這是近年來發展的新型熒光納米材料, 因其制備簡單、 光學性質優良且生物相容性好, 已成為研究熱點[11~13]. 如Wang等[14]合成了以富胸腺嘧啶DNA鏈S1為模板形成的銀納米簇(AgNCs), 利用碳納米管的高熒光猝滅能力將體系熒光猝滅, 而汞離子能與S1鏈中的胸腺嘧啶結合形成穩定的T-Hg2+-T結構, 使銀納米簇從碳納米管上脫離, 導致體系熒光恢復, 并利用核酸外切酶Ⅲ的輔助循環放大原理, 實現了汞離子的超靈敏檢測. 該方法檢出限雖然低至30 pmol/L, 但其操作步驟繁瑣, 制備條件苛刻.
相對于銀納米簇等貴金屬納米簇, 作為普通金屬的銅納米簇(CuNCs)的報道較少, Cu具有與Au和Ag相似的性能, 但價格比Au和Ag便宜, 合成CuNCs的前體更容易得到, 且銅納米簇制備條件溫和, 操作簡單、 快速. 目前, 制備銅納米簇的方法有模板法[15]、 刻蝕法[16]及微波法[17]等. 常用的模板分子有寡聚核苷酸(DNA)、 多肽和蛋白質、 硫醇類化合物及樹枝狀聚合物等. Mokhir等[18]合成了以雙鏈DNA為模板的強熒光銅納米簇, 并發現通過改變雙鏈DNA模板的長度可調控銅納米簇的尺寸和熒光性質, 其后以DNA為模板的銅納米簇的合成與應用受到關注, 如利用以雙鏈DNA為模板合成的銅納米簇實現了對單堿基錯配[19]、 核酸酶[20]、 三磷酸腺苷[21]、 鉛離子[22]和多巴胺[23]等的靈敏檢測. 此外, Qing等[24]發現聚T單鏈DNA同樣也可以作為合成銅納米簇的模板, 合成過程僅需5 min; 基于此, 他們[25]將聚T單鏈DNA封鎖在帶狀水凝膠中, 從水凝膠微孔注入銅離子, 構建了一種便捷、 經濟及可視化檢測銅離子的新方法. Ou等[26]利用Pb2+易與Cu+發生嗜金屬作用, 破壞聚T銅納米簇結構從而使該傳感體系熒光強度減弱, 實現了對Pb2+的靈敏檢測, 檢出限為0.4 nmol/L. 因聚T單鏈DNA銅納米簇合成簡單快速, 故在此基礎上開發新的熒光傳感新方法將具有廣闊的發展前景.
本文利用汞離子介導, 以聚T單鏈DNA為模板合成銅納米簇, 形成穩定的T-Hg2+-T結構, 誘導單鏈DNA-CuNCs轉變成雙鏈DNA-CuNCs, DNA構象的變化引起體系熒光增強, 從而建立一種簡單、 高靈敏檢測汞離子的熒光增強傳感新方法.
1 實驗部分
1.1試劑與儀器
DNA核酸探針序列P1(5′-CGGCTTACCTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTAGCTTCTTTCTA-ATA-3′)購于大連寶生物工程技術服務有限公司; 3-嗎啡丙磺酸(MOPS)和抗壞血酸鈉(C6H7NaO6)購于德國Sigma-Aldrich公司; 五水硫酸銅(CuSO4·5H2O)、 硝酸汞[Hg(NO3)2]和氯化鈉購于上海國藥集團化學試劑有限公司; 所用試劑除特別說明外均為分析純; MOPS緩沖溶液(10 mmol/L MOPS+150 mmol/L NaCl, pH=7.6)用于制備銅納米簇. 實驗用水為過濾除菌后的超純水(電阻率≥18.3 MΩ·cm); 配制生物試劑所用水和緩沖溶液均經高溫、 高壓滅菌.
F-7000型熒光光譜儀(日本Hitachi公司); PHSJ-3F型pH計(上海雷磁儀器廠); CZ-500L-W型超純水制備儀(北京國之源有限公司); 手提式壓力蒸汽滅菌器(浙江新豐醫療器械有限公司); BS124S電子天平(北京賽多利斯儀器有限公司).
1.2DNA單鏈銅納米簇的制備
參照文獻[24]方法, 以聚T為模板, 將P1核酸鏈溶解在3-嗎啡丙磺酸MOPS緩沖溶液中配制成P1母液. 將2.0 mmol/L抗壞血酸鈉加入500 nmol/L P1核酸鏈中, 充分混合后, 再加入1.0 mmol/L 硫酸銅, 用移液槍頭輕輕攪拌后, 將溶液置于黑暗環境下于室溫培育5 min, 測定其熒光光譜.
1.3DNA雙鏈銅納米簇的制備
將500 nmol/L P1核酸鏈溶液與10 μmol/L 硝酸汞溶液充分混合均勻后, 于室溫反應30 min, 再依次加入2.0 mmol/L 抗壞血酸鈉和1.0 mmol/L 硫酸銅, 用移液槍頭輕輕攪拌混合均勻后, 置于黑暗環境下于室溫培育5 min, 測定其熒光光譜.
2 結果與討論
2.1檢測原理的探討
Hg2+的檢測原理如圖1所示, 采用抗壞血酸鈉為還原劑, 將Cu2+還原成Cu0, 還原過程中伴隨著中間體Cu+的生成. Cu+與胸腺嘧啶T中的氧原子有微弱的結合[27]; 同時, Cu+自歧化反應生成的Cu0聚集在富含T的單鏈DNA上形成銅納米簇, 產生微弱的熒光信號, 其發射峰位于590 nm. 當存在Hg2+時, Hg2+與DNA中的胸腺嘧啶T高度特異性結合形成穩定的T-Hg2+-T配合物[28], 誘導單鏈DNA折疊成雙鏈DNA, DNA有效的配對和堆疊對銅納米簇的形成有潛在的影響, 此雙鏈DNA中的非Waston-Crick氫鍵部分被認為是Cu+的強結合位點[27], 致使經Cu+歧化后的Cu0更容易聚集在雙鏈DNA螺旋結構內, 從而產生增強的熒光信號, 且發射峰位置由590 nm漂移到610 nm處, 表明形成了不同于原有體系尺寸的銅納米簇, 即由單鏈熒光銅納米簇轉變成雙鏈熒光銅納米簇的成分增多, 從而實現對Hg2+的靈敏檢測. 因此, 雙鏈DNA比單鏈DNA更容易形成銅納米簇, 致使體系熒光增強, 基于此構建了非標記靈敏檢測汞離子的熒光分析新方法.
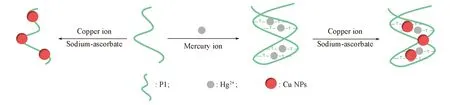
Fig.1 Schematic illustration of the Hg2+ sensing strategy based on the fluorescence enhancing of copper nanoclusters
2.2汞離子介導銅納米簇熒光增強
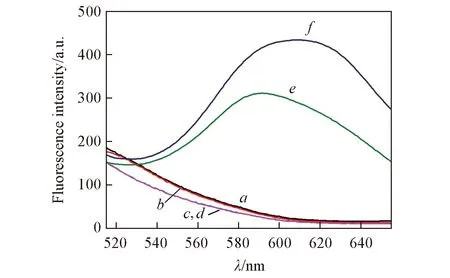
Fig.2 Fluorescence emission spectra of different systems The final concentrations of P1, sodium ascorbate, Hg2+ and Cu2+ were 500 nmol/L, 2.0 mmol/L, 100 nmol/L, and 1.0 mmol/L, respectively. a. P1; b. P1+sodium ascorbate; c. P1+Hg2+; d. P1+sodium ascorbate+Hg2+; e. P1+Cu2++sodium ascorbate; f. P1+ Cu2++sodium ascorbate+Hg2+.
為了考察實驗中各組分對DNA-CuNCs體系熒光強度的影響, 尤其是汞離子對銅納米簇熒光強度的影響, 對6種不同體系進行了熒光檢測. 如圖2所示, 核酸探針P1、 硝酸汞和抗壞血酸鈉3種物質均無熒光發光基團; 將P1、 硝酸汞和抗壞血酸鈉兩兩組合或者全部組合無法改變各物質本身的分子結構和發光特性, 也不能生成具有熒光性質的新物質, 因此譜線a~d均無熒光信號; 當P1、 硫酸銅和抗壞血酸鈉同時存在時, 形成的銅納米簇在590 nm處有熒光信號產生(譜線e). 而當體系中存在100 nmol/L Hg2+時, 體系熒光強度由原來的311.3升高到434.1, 發射峰位置由590 nm漂移到610 nm(譜線f). 此結果表明, 汞離子的介入不僅增強了體系的熒光強度, 而且合成了不同于原有體系尺寸的銅納米簇, 其原因是Hg2+與DNA中的胸腺嘧啶T可高度特異性結合形成穩定的T-Hg2+-T配合物, 誘導單鏈DNA折疊成雙鏈DNA, 由于Cu+與雙鏈DNA螺旋結構間的氫鍵部分有強的作用力, 使得Cu+的歧化產物Cu0更容易聚集在雙鏈DNA, 導致體系熒光強度增強, 因合成銅納米簇的模板分子P1構象的變化和Cu+在P1不同構象中的結合位點不同, 使得形成的銅納米簇尺寸也不同. 以上結果表明, 基于聚胸腺嘧啶單鏈銅納米簇熒光增強檢測汞離子的方法設計合理, 可以對汞離子進行檢測.
2.3孵育時間對體系熒光的影響
實驗中, 將500 nmol/L P1與100 nmol/L 硝酸汞溶液混合均勻, 分別孵育10, 20, 30, 40和50 min后, 再依次加入2.0 mmol/L抗壞血酸鈉和1.0 mmol/L硫酸銅, 置于黑暗環境下于室溫培育5 min, 測定體系的熒光變化, 以考察汞離子對聚胸腺嘧啶DNA P1溶液孵育不同時間對體系熒光的影響. 結果表明, 在用汞離子孵育30 min后, 體系熒光增加幅度趨于平緩, 但在孵育時間30 min處熒光強度增幅最大(見圖3), 因此實驗選取汞離子孵育時間為30 min.
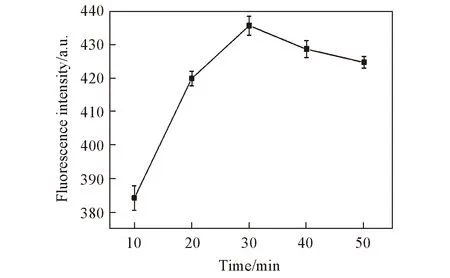
Fig.3 Effect of incubation time on the fluorescence intensity of DNA-CuNCs in the presence of 100 nmol/L Hg2+
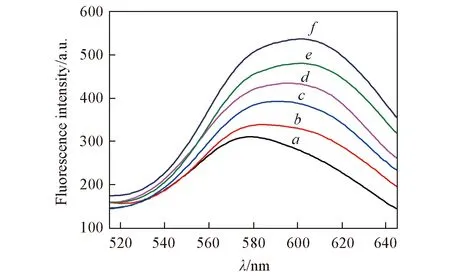
Fig.4 Fluorescence spectra of DNA-CuNCs with addition of different concentrations of Hg2+ ions c(Hg2+)/(nmol·L-1):a. 0, b. 1.0, c. 10, d. 100, e. 103, f. 104.
2.4汞離子的檢測
為進一步驗證該傳感器用于定量檢測Hg2+的可行性, 將不同濃度的Hg2+同核酸鏈P1孵育形成T-Hg2+-T雙鏈DNA結構. 圖4示出了0~10 μmol/L范圍內不同濃度汞離子所產生的熒光光譜圖, 可見, 銅納米簇的熒光強度隨著汞離子濃度的增加而逐漸增強, 表明由汞離子介導單鏈DNA轉變成的雙鏈DNA逐漸增多, Cu+與雙鏈DNA結合形成強熒光銅納米簇. 在汞離子溶液濃度為1.0 nmol/L~10 μmol/L范圍內, Hg2+濃度對數與銅納米簇的熒光強度值呈現良好的線性關系, 其回歸方程可擬合為F=47.87lgc+770.7, 根據空白響應的3倍標準偏差原則, 計算出其檢出限為0.4 nmol/L, 比已有文獻[7~10]報道的熒光生物傳感器的檢出限低.
2.5選擇性考察
為驗證該傳感器對Hg2+的特異性識別能力, 考察了其它可能產生干擾的金屬離子的影響. 圖5為5 μmol/L Hg2+和50 μmol/L其它金屬離子(Ni2+, Zn2+, Mg2+, Co2+, Ce2+, Ca2+, Fe3+, Fe2+, Cd2+, Ba2+, Al3+, Mn2+, Ag+和Cr2+)的相對熒光強度柱狀圖. 由圖5可見, 只有Hg2+能引起銅納米簇熒光強度的顯著變化, 相當于Hg2+濃度10倍的其它金屬離子的加入對銅納米簇的熒光強度并無明顯影響, 即不會干擾該傳感器對Hg2+的檢測, 這表明該傳感器能在復雜的體系中檢測低濃度的Hg2+.
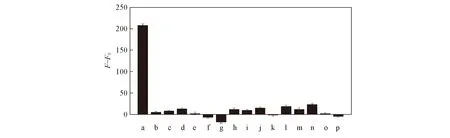
Fig.5 Selectivity of DNA-CuNCs in the presence of 5 μmol/L Hg2+ ions and 50 μmol/L other metal ions a. Hg2+; b. blank; c. Ni2+; d. Zn2+; e. Mg2+; f. Co2+; g. Ce2+; h. Ca2+; i. Fe3+; j. Fe2+; k. Cd2+; l. Ba2+; m. Al3+; n. Mn2+; o. Ag+; p. Cr3+.
2.6湖水樣品中汞離子的檢測
為驗證該傳感器對實際水樣中汞離子檢測的可行性, 采集云影湖水(長沙)進行了分析研究. 所取湖水經過濾膜過濾, 去除浮游生物等雜質, 加入高壓滅菌水將湖水樣品稀釋10倍, 采用標準加入法測定, 即在實際樣品中加入已知標準濃度的汞離子, 測出其加入不同濃度Hg2+溶液前后熒光強度的變化值, 對照工作曲線計算出加標試樣濃度值, 比較測量值與實際加入量, 所得回收率為97.2%~106.6%(見表1), 說明該傳感器適用于實際水樣中汞離子的檢測, 在環境監測領域具有潛在的應用價值.
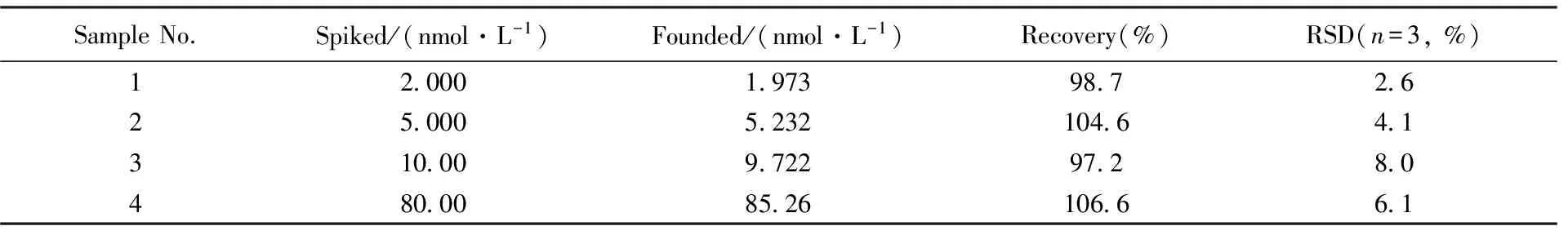
Table 1 Determination results of Hg2+ in Yunying lake water samples
3 結 論
基于T-Hg2+-T結構誘導聚T單鏈DNA(P1)轉變成雙鏈DNA, 使Cu0更易附著聚集在雙鏈DNA上形成強熒光銅納米簇, 建立了一種高靈敏檢測汞離子的熒光增強新方法. 與傳統方法相比, 該方法簡單、 無需標記, 靈敏度高(檢出限達到0.4 nmol/L)且選擇性好, 可用于環境水體中汞離子的檢測. 此外, 銅納米簇熒光增強探針報道較少, 其熒光增強機理有待進一步深入研究.
[1]Nolan E. M., Lippard S. J.,Chem.Rev., 2008, 108(9), 3443—3480
[2]Hao Y. L., Guo Q. Q., Wu H. Y., Guo L. Q., Zhong L. S., Wang J., Lin T. R., Fu F. F., Chen G. N.,Biosens.Bioelectron., 2014, 52, 261—264
[3]Wang D., Liu X. M., Fang Z. X., Li J., Sun M. J.,Chem.Res.ChineseUniversities, 2015, 31(4), 581—584
[4]Tang W. Q., Chase D. B., Sparks D. L., Rabolt J. F.,Appl.Spectros., 2015, 69(7), 843—849
[5]Wang L., Li T., Du Y., Chen C. G., Li B. L., Zhou M., Dong S. J.,Biosens.Bioelectron., 2010, 25(12), 2622—2626
[6]Das N. K., Ghosh S., Priya A., Datta S., Mukherjee S.,J.Phys.Chem.C, 2015, 119(43), 24657—24664
[7]Chen J. Y., Su W., Wang E. J.,Chem.J.ChineseUniversities, 2016, 37(2), 232—238(陳家逸, 蘇偉, 王恩舉. 高等學校化學學報, 2016, 37(2), 232—238)
[8]Liu X. F., Tang Y. L., Wang L. H., Zhang J., Song S. P., Fan C. H., Wang S.,Adv.Mater., 2007, 19(11), 1471—1474
[9]Freeman R., Finder T., Willner I.,Angew.Chem.Int.Ed., 2009, 48(42), 7818—7821
[10]Huang C. C., Yang Z., Lee K. H., Chang H. T.,Angew.Chem., 2007, 119(36), 6948—6952
[11]Tao Y., Li M. Q., Ren J. S., Qu X. G.,Chem.Soc.Rev., 2015, 44(24), 8636—8663
[12]Zhang L. B., Wang E. K.,NanoToday, 2014, 9(1), 132—157
[13]Guo Y. M., Cao F. P., Lei X. L., Mang L. H., Cheng S. J., Song J. T.,Nanoscale, 2016, 8(48), 4852—4863
[14]Wang G. F., Xu G., Zhu Y. H., Zhang X. J.,Chem.Commun., 2014, 50(6), 747—750
[15]Gao F. P., Cai P. J., Yang W. J., Xue J. Q., Gao L., Liu R., Wang Y. L., Zhao Y. W., He X., Zhao L., Huang G. D., Wu F. S., Zhao Y. L., Chai Z. F., Gao X. Y.,ACSNano, 2015, 9(5), 4976—4986
[16]Zhong Y. P., Wang Q. P., He Y., Ge Y. L., Song G. W.,Sens.ActuatorsB, 2015, 209, 147—153
[17]Bhamore J. R., Jha S. J., Munngara A. K., Singhal R. K., Sonkeshariya D., Kailasa S. K.,Biosens.Bioelectron., 2016, 80, 243—248
[18]Rotaru A., Dutta S., Jentzsch E., Gothelf K., Mokhir A.,Angew.Chem.Int.Ed., 2010, 49(33), 5665—5667
[19]Jia X. F., Li J., Han L., Ren J. T., Yang X., Wang E. K.,ACSNano, 2012, 6(4), 3311—3317
[20]Hu R., Liu Y. R., Kong R. M., Donovan M. J., Zhang X. B., Tan W. H., Shen G. L., Yu R. Q.,Biosens.Bioelectron., 2013, 42, 31—35
[21]Zhou Z. X., Du Y., Dong S. J.,Anal.Chem., 2011, 83(13), 5122—5127
[22]Chen J. H., Liu J., Fang Z. Y., Zeng L. W.,Chem.Commun., 2012, 48(7), 1057—1059
[23]Wang H. B., Zhang H. D., Chen Y., Huang K. J., Liu Y. M.,Sens.ActuatorsB, 2015, 220, 146—153
[24]Qing Z. H., He X. X., He D. G., Wang K. M., Xu F. Z., Qing T. P., Yang X.,Angew.Chem.Int.Ed., 2013, 52(37), 9719—9722
[25]Qing Z. H., Mao Z. G., Qing T. P., He X. X., Zou Z., He D. G., Shi H., Huang J., Liu J. B., Wang K. M.,Anal.Chem., 2014, 86(22), 11263—11268
[26]Ou L. J., Li X. Y., Liu H. W., Li L. J., Chu X.,Anal.Sci., 2014, 30(7), 723—727
[27]Russo N., Toscano M., Grand A.,J.MassSpectrom., 2003, 38, 265—270
[28]Berti L., Burley G. A.,NatureNanotech., 2008, 3, 81—87
(Ed.:N, K)
? Supported by the National Natural Science Foundation of China(Nos.31527803, 21275022, 21545010).
High-sensitive Fluorescent Enhancement Detection of Hg(Ⅱ) Ions Based on Poly(thymine)-templated Copper Nanoclusters?
LI Ting, CAO Zhong*, LI Panpan, HE Jinglin*, XIAO Hui, YANG Chan
(Collaborative Innovation Center of Micro/nano Bio-sensing and Food Safety Inspection,HunanProvincialKeyLaboratoryofMaterialsProtectionforElectricPowerandTransportation,SchoolofChemistryandBiologicalEngineering,ChangshaUniversityofScienceandTechnology,Changsha410114,China)
A rapid sensitive fluorescent sensor was developed for Hg(Ⅱ) ions detection based on the specific thymine-Hg2+-thymine structure and photoluminescent property of DNA copper nanoclusters. Upon the addition of Hg2+, poly thymine single strand DNA(P1) is transformed into double strand DNA through the formation of T-Hg2+-T configuration. Sodium ascorbate is effective to reduce Cu2+to Cu0, and this reduction process is accompanied by formation of intermediate Cu+. However, Cu+has a strong binding site within hydrogen-bonding moieties in the helix of dsDNA which facilating Cu0gathered in dsDNA to form stronger fluorescent copper nanoclusters than ssDNA copper nanoclusters, and these changes in fluorescence intensity of DNA-CuNCs are allowed for sensitive analysis of Hg(Ⅱ) ions. Satisfactory linear relationship and detection limit were obtained. The resulting calibration plots exhibited good linear correlations in the range from 1.0 nmol/L to 10 μmol/L for Hg(Ⅱ) ions, and the detection limits of Hg(Ⅱ) ions was 0.4 nmol/L. The proposed method was highly selective and other metal ions have no interfering effects on the determination. Moreover, satisfactory results were obtained while the proposed method was applied to determination of Hg2+in real lake samples.
Fluorescence enhancement;Environmental water sample; Copper nanoclusters; T-Hg2+-T; Mercury ion
10.7503/cjcu20160319
2016-05-09. 網絡出版日期:2016-08-17.
國家自然科學基金(批準號:31527803, 21275022, 21545010)資助.
O657.3
A
聯系人簡介:曹忠, 男, 博士, 教授, 主要從事納米生物傳感與食品安全檢測方面的研究. E-mail:zhongcao2004@163.com
何婧琳, 女, 博士, 講師, 主要從事納米生物傳感與核酸適配體分析方面的研究. E-mail:jinglin_he@163.com

