Lgr-5的表達與Ⅲ期直腸癌患者新輔助放化療結合直腸癌根治術與預后的關系
路 明,劉恒昌,李艷麗
(1.吉林市中心醫院 基本外科,吉林 吉林132000; 2.吉林大學白求恩第一醫院 胃結直腸肛門外科;3.吉林省疾病預防控制中心)
?
Lgr-5的表達與Ⅲ期直腸癌患者新輔助放化療結合直腸癌根治術與預后的關系
路明1,劉恒昌2,李艷麗3*
(1.吉林市中心醫院 基本外科,吉林 吉林132000; 2.吉林大學白求恩第一醫院 胃結直腸肛門外科;3.吉林省疾病預防控制中心)
近年來我國直腸癌的發病率顯著上升,其病死率在所有惡性腫瘤中位居第三,且發病呈年輕化趨勢。目前對于直腸癌的治療,仍以手術切除為主,但由于直腸癌發病部位較深,且周圍解剖結構十分復雜,不易徹底切除,而新輔助放化療可以將手術切除困難,或無法行手術切除的病灶變為可切除[1]。但在臨床工作中發現不同患者對于新輔助放化療后行直腸癌根治術的效果不盡相同。近年來,有文獻報道富含亮氨酸重復單位的G蛋白偶聯受體5(Lgr-5)的高表達可能會影響新輔助放化療并行直腸癌根治術的療效[2]。本次研究著重探討Lgr-5的表達與Ⅲ期直腸癌患者新輔助放化療結合直腸癌根治術預后的關系,現將研究結果報道如下。
1 材料與方法
1.1一般資料隨機選取2007年至2009年,吉林市中心醫院基本外科收治的中、下段直腸癌Ⅲ期的患者103例,其中男64例,女39例,年齡45-73歲,平均年齡(51.4±7.7)歲,中段直腸癌(腫瘤下緣距肛緣大于8 cm且小于11 cm)49例,下段直腸癌(腫瘤下緣距肛緣≤8 cm)54例,行腹部會陰直腸癌切除術(Miles術)者58例,行經腹部直腸切除吻合術(Dixon術)者45例。病理分型:高分化38例,中分化42例,低分化23例。組織類型:非粘液癌82例,粘液癌21例。解剖形態:浸潤型11例,潰瘍型34例,隆起型58例。所有患者均經直腸鏡取病灶組織做病理組織活檢確診為直腸癌;所有患者均按照2010年美國癌癥聯合委員會(AJCC)和國際抗癌聯盟(UICC)制定的結直腸癌TNM分期進行分期,其中Ⅲa期16例,Ⅲb期69例,Ⅲc期18例。排除標準:① 其它器官伴發腫瘤者;② 曾接受過放化療治療者;③ 重要器官(如肝、腎等)功能不全者;④ 曾使用過Notch抑制劑者;⑤ 發生遠處轉移者。所有患者均簽署知情同意書。
1.2方法
1.2.1免疫組織化學法(S-P法) Lgr-5抗體選用兔抗人Lgr-5多克隆抗體(PAB2591,亞諾法生技股份有限公司),SP試劑盒購自上海寶曼生物科技有限公司,按試劑盒說明書操作。
1.2.2結果判定方法[3]選取400倍鏡下4個互不重疊的視野,每個視野計數100個細胞,并數出染色的細胞數量,計算染色細胞所占比例。Lgr-5主要在細胞質中表達,為黃色或棕黃色顆粒。每例標本由三位專家獨立審閱,并以兩位或兩位以上專家一致意見為最終結果。根據細胞染色比例,將結果分為:陰性(-):<5%;弱陽性(+):5%-50%;強陽性(++):>50%。規定此次研究Lgr-5低表達為染色細胞比例≤50%,高表達為染色細胞比例>50%。
1.2.3治療方法所有患者術前均對骨盆野前后2野垂直照射,每次劑量1.8Gy,每周5次,治療5周,共50Gy。與此同時行化療,化療可選方案:① 奧沙利鉑聯合希羅達方案(即XELOX);② 伊立替康聯合5-FU/CF方案(即FOLFIRI); ③ 奧沙利鉑聯合5-FU/CF(即FOLFOX),治療8周。完成新輔助放化療后,休息8周,根據病情選擇Miles術或Dixon術。
1.2.4隨訪方法所有患者術后隨訪,前2年每3個月進行電話隨訪一次,后3年每6個月進行電話隨訪一次,隨訪終點為患者死亡或隨訪結束(2014年12月31日)。

2 結果
2.1Lgr-5在直腸癌組織中的表達情況103例直腸癌患者中,Lgr-5陰性(-)有32例(31.07%),弱陽性(+)有43例(41.75%),強陽性(++)有28例(27.18%),即Lgr-5低表達有75例(72.82%),高表達有28例(27.18%)。Lgr-5在直腸癌組織中的染色情況見圖1。
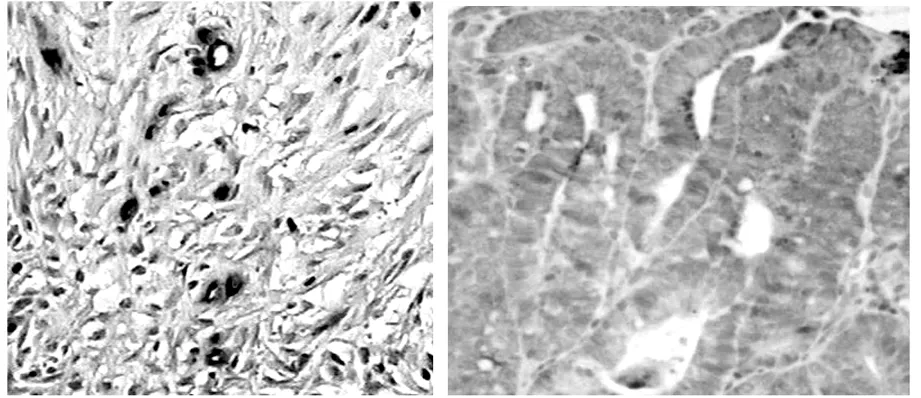
圖1 Lgr-5在直腸癌組織中的表達(×400)
2.2Lgr-5的表達與臨床資料的關系直腸癌組織中Lgr-5的表達與年齡、性別、腫瘤部位、病理類型、組織學類型以及解剖類型均不存在顯著差異(P>0.05)。見表1。
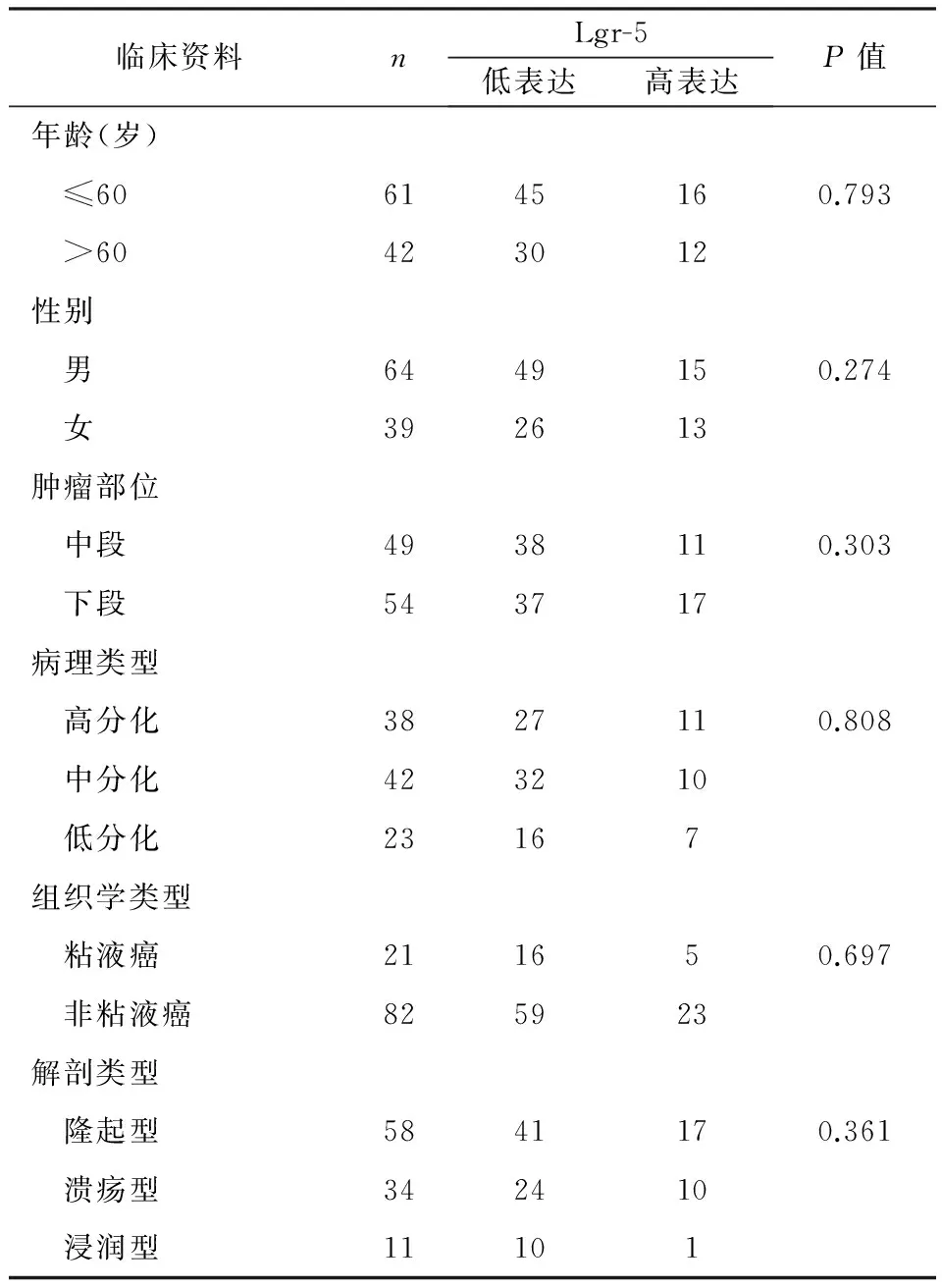
表1 Lgr-5的表達與臨床資料的關系
2.3Lgr-5的表達與直腸癌復發的關系在隨訪過程中75例Lgr-5高表達患者中,有14例(18.67%)發生復發,28例Lgr-5低表達患者中,有5例(17.86%)發生復發,兩者不存在顯著差異(P>0.05);但是Lgr-5高表達患者的復發時間要顯著短于Lgr-5低表達患者的復發時間(P<0.05)。見表2。
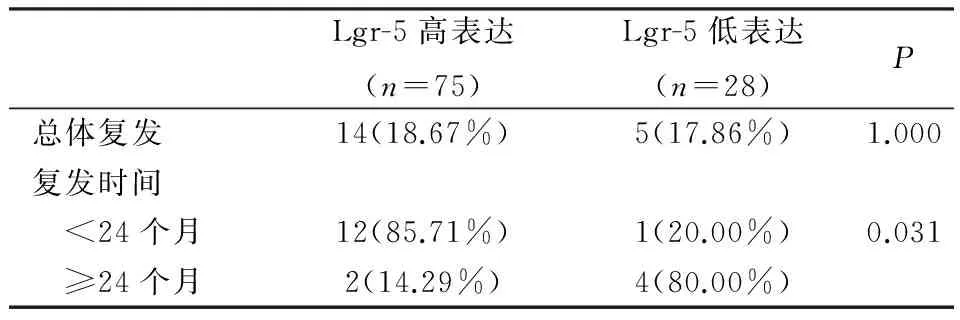
表2 Lgr-5的表達與直腸癌復發的關系[n,(%)]
2.4Lgr-5的表達與生存分析本次隨訪103例患者,中途失訪或因其他原因死亡者17例,全部未完成至少5年隨訪,隨訪成功率為83.50%,其中11例為Lgr-5低表達患者,6例為Lgr-5高表達患者,失訪者不計入最終結果。本次隨訪的平均隨訪時間為56.8個月,中位時間為66.0個月(3-110個月)。64例Lgr-5低表達患者的五年生存率為89.06%(57/64),22例Lgr-5高表達患者的五年生存率為59.09%(13/22)。Lgr-5低表達患者的五年生存率顯著高于Lgr-5高表達患者的五年生存率(P<0.05)。見圖2。
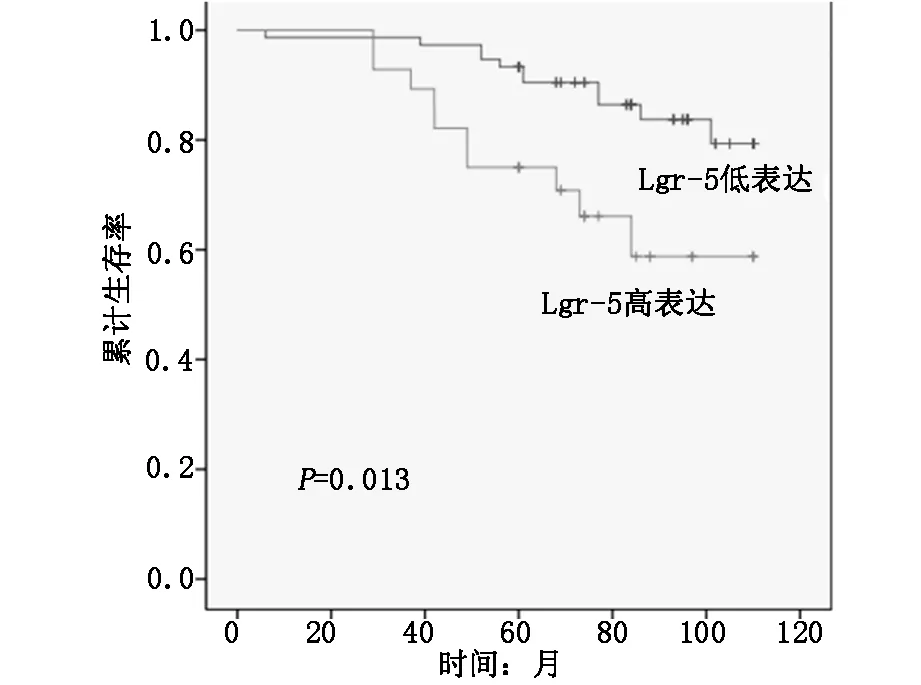
圖2 Lgr-5的表達與生存分析
3 討論
本次研究發現,直腸癌患者中,Lgr-5低表達的患者居多(72.82%),但Lgr-5陽性表達率較高(68.93%),這與Liu等人的研究結果相似[4]。這提示直腸癌的發生可能與腫瘤干細胞有關,因為Lgr-5已經被證實是腫瘤干細胞的標志物,而Carmon的研究結果表明,結腸癌組織中Lgr-5的表達顯著高于正常黏膜組織[5]。說明Lgr-5參與了直腸癌早期的改變,這可能與Lgr-5導致腸黏膜的快速更新,促進腫瘤干細胞形成有關[6]。本次研究發現直腸癌組織中Lgr-5的表達差異與年齡、性別、腫瘤部位、病理類型、組織學類型以及解剖類型均不存在顯著差異,這與Shen的研究結果一致[7]。這提示Lgr-5可能是獨立于各項臨床資料和病理學資料的。但Ramanathan在腸息肉中發現了Lgr-5的表達,說明Lgr-5與直腸癌的發病有關,并且可以早期觀察直腸癌進展的指標[8]。本次研究將Lgr-5免疫組化染色>50%規定為Lgr-5高表達,≤50%為低表達,對兩組患者的復發情況進行了跟蹤,發現兩組患者的總復發率不存在顯著差異(P=1.000),但Lgr-5高表達復發的患者有約85%在24個月內復發,顯著高于Lgr-5低表達復發的患者(20%)。這提示Lgr-5的表達可以作為預測Ⅲ期直腸癌新輔助化療聯合手術治療患者預后的標志。出現這種現象的原因可能是腸干細胞(intestinal stem cells,ISCs)的迅速增殖造成的。ISCs位于結腸隱窩基底部的潘氏細胞之間,控制結腸黏膜上皮的再生,而Takahashi等人在研究中發現ISCs中Lgr-5呈現高表達,并且對于Wnt信號傳導通路的調節尤其敏感[9]。而Kano發現Lgr-5高表達的ISCs壽命顯著長于Lgr-5低表達的ISCs,并且呈持續增殖狀態,并分化成為不同的上皮細胞類型[10]。這可能是造成Lgr-5高表達患者復發時間較短的原因。本次研究對所有患者進行了生存情況的隨訪調查,結果發現Lgr-5低表達患者的五年生存率為89.06%(57/64),Lgr-5高表達患者的五年生存率為59.09%(13/22),Lgr-5低表達患者的五年生存率顯著高于Lgr-5高表達患者的五年生存率(P<0.05)。這提示新輔助放化療聯合手術治療對于Lgr-5低表達的Ⅲ期直腸癌患者的療效較為顯著,而對于Lgr-5高表達的患者則不是十分理想[11]。說明Lgr-5是一個影響Ⅲ期直腸癌患者預后的獨立因素。而Daniela利用RT-PCR檢測新輔助放化療后患者直腸癌組織中Lgr-5基因的表達情況,發現Lgr-5基因高表達的患者,其無病生存率較短[12],與本次研究結果相似。
綜上,Lgr-5高表達是影響新輔助放化療聯合手術治療的Ⅲ期直腸癌患者預后的獨立因素,Lgr-5高表達的Ⅲ期直腸癌患者復發時間較短,五年生存率較低。
[1]Saigusa S,Inoue Y,Tanaka K,et al.Significant correlation between LKB1 and LGR5 gene expression and the association with poor recurrence-free survival in rectal cancer after preoperative chemoradiotherapy[J].Journal of Cancer Research and Clinical Oncology,2013,139(1):131.
[2]Saigusa S,Inoue Y,Tanaka K,et al.Clinical significance of LGR5 and CD44 expression in locally advanced rectal cancer after preoperative chemoradiotherapy[J].International journal of oncology,2012,41(5):1643.
[3]Deng Y,Zhou J,Fang L,et al.ALDH1 is an independent prognostic factor for patients with stages II-III rectal cancer after receiving radiochemotherapy[J].The British journal of cancer,2014,110(2):430.
[4]Liu Z,Dai W,Jiang L,et al.Over-expression of LGR5 correlates with poor survival of colon cancer in mice as well as in patients[J].Neoplasma:Journal of Experimental and Clinical Oncology,2014,61(2):177.
[5]Carmon KS,Gong X,Lin Q.et al.R-spondins function as ligands of the orphan receptors LGR4 and LGR5 to regulate Wnt/β-catenin signaling[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(28):11452.
[6]Kobayashi S,Yamada-Okabe H,Suzuki M,et al.LGR5-positive colon cancer stem cells interconvert with drug-resistant LGR5-negative cells and are capable of tumor reconstitution[J].Stem Cells,2012,30(12):2631.
[7]Shen WW,Zeng Z,Zhu WX.MiR-142-3p functions as a tumor suppressor by targeting CD133,ABCG2,and Lgr5 in colon cancer cells[J].J Mol Med(Berl),2013,91(8):989.
[8]Ramanathan V,Jin G,Westphalen C B,et al.P53 gene mutation increases progastrin dependent colonic proliferation and colon cancer formation in mice[J].Cancer investigation,2012,30(4):275.
[9]Takahashi H,Ishii H,Nishida N,et al.Significance of Lgr5(+ve) cancer stem cells in the colon and rectum.[J].Annals of surgical oncology,2011,18(4):1166.
[10]Kano Y,Tsuchiya K,Zheng X,et al.The acquisition of malignant potential in colon cancer is regulated by the stabilization of Atonal homolog 1 protein[J].Biochemical and Biophysical Research Communications,2013,432(1):175.
[11]Fan YY,Davidso LA,Callaway ES,et al.Differential effects of 2- and 3-series E-prostaglandins on in vitro expansion of Lgr5+ colonic stem cells.[J].Carcinogenesis,2014,35(3):606.
[12]Hirsch D,Barker N,McNeil N,et al.LGR5 positivity defines stem-like cells in colorectal cancer.[J].Carcinogenesis,2014,35(4):849.
1007-4287(2016)09-1512-03
2015-04-10)

