響應面法優化檸條錦雞兒總黃酮超聲提取工藝及其體外抗氧化性研究
寇 亮,李 璐,陸麗娜,康淑荷,*
(1.西北民族大學化工學院,甘肅蘭州 730030;2.環境友好復合材料及生物質利用甘肅省高校重點實驗室,甘肅蘭州 730030)
?
響應面法優化檸條錦雞兒總黃酮超聲提取工藝及其體外抗氧化性研究
寇亮1,2,李璐1,2,陸麗娜1,2,康淑荷1,2,*
(1.西北民族大學化工學院,甘肅蘭州 730030;2.環境友好復合材料及生物質利用甘肅省高校重點實驗室,甘肅蘭州 730030)

檸條錦雞兒,總黃酮,響應面法,超聲輔助提取,抗氧化活性
檸條錦雞兒(Caraganakorshinskiikom)又稱檸條、大白檸條、毛條等,為多年生錦雞兒屬(CaraganaFabr.)灌木,根系龐大,入土深,具有獨特的形態變化和生態適應性,抗干旱、抗寒冷,是我國西北干旱、半干旱地區一種重要的控制荒漠化的多年生灌木,主要分布于甘肅、寧夏、內蒙古、山西、陜西等地[1-4]。檸條錦雞兒的根、莖、葉皆可入藥,有滋陰養血、通經、鎮靜和止癢等功效,用于治療發熱、頭暈頭痛、炎癥和婦科疾病,在傳統中醫藥中應用歷史悠久[5]。它還是高蛋白植物,可作為備選的食品添加劑原料,同時也是荒漠及荒漠草原地帶的優良動物飼料[6]。
錦雞兒屬植物富含黃酮類化合物[7],該類化合物具有調脂、清除自由基、抗菌、抗腫瘤等藥理活性[8],還是一種天然的抗氧化劑,在食品、藥品、化妝品中都有廣泛應用[9]。目前,對檸條錦雞兒的研究大多聚焦于生物分類學、遺傳多樣性和生態價值[10],對其中的黃酮類化合物的提取及生物活性研究卻鮮有報道。張華等[11]比較超聲波-水浴提取法、微波提取法和液氮-乙醇提取法提取檸條錦雞兒中總黃酮得率,發現得率由高到低依次為:超聲波-水浴提取法、微波提取法、液氮-乙醇提取法。本論文運用超聲輔助提取法、通過Box-Behnken設計-響應面法優化檸條錦雞兒總黃酮的提取工藝,并對其體外抗氧化性進行研究,以期為進一步開發利用該植物提供理論依據。響應面曲線法優化檸條錦雞兒總黃酮提取工藝及其體外抗氧化性研究筆者未見文獻報道。
1 材料與方法
1.1材料與儀器
檸條錦雞兒采摘自甘肅省蘭州市五泉山麓,經西北民族大學化工學院制藥工程教研室主任師永清教授鑒定為錦雞兒屬植物檸條錦雞兒Caraganakorshinskiikom。選取檸條錦雞兒地上部分葉及細枝條,室內陰干后,備用。蘆丁對照品購自上海士鋒科技有限公司。其他試劑均為市售商品級分析純試劑。
SP-2100型紫外-可見分光光度計上海光譜儀器有限公司;UX620H型電子分析天平日本島津公司;AB204-S型電子天平瑞士梅特勒公司;SB25-12DT型超聲波清洗機寧波新芝生物科技股份有限公司;DHG-9023A型電熱恒溫鼓風干燥箱上海森信實驗儀器有限公司;DFT-200型高速中藥粉碎機溫嶺市林大機械有限公司。
1.2實驗方法
1.2.1蘆丁標準曲線的制作準確稱取于105 ℃干燥的蘆丁對照品10 mg,80%乙醇定容至10 mL,混合均勻,靜置,得到1 mg/mL蘆丁標準溶液,備用。從上述配制的蘆丁標準溶液中吸取0.0、0.5、1.0、1.5、2.0、2.5 mL分別加入6個干燥的25 mL的容量瓶中,各加入80%乙醇至8 mL,加入1 mL 5%的NaNO2溶液搖勻后靜置6 min,再加入1 mL 10% Al(NO3)3溶液,搖勻,靜置5 min后加入4% NaOH溶液10 mL,最后再用80%乙醇定容并搖勻后靜置15 min。以未加蘆丁標準品的溶液作為空白對照,分別于510 nm處測定6個容量瓶中標準溶液的吸光度值[12]。
1.2.2檸條錦雞兒中總黃酮的提取檸條錦雞兒地上部分葉及細枝條室內陰干后粉碎過24目篩,準確稱取3.00 g,置于100 mL錐形瓶中,用乙醇浸泡,在50 ℃水溫下,50 kHz超聲提取,過濾。濾渣再以相同的條件重復以上步驟超聲、過濾,合并兩次濾液至100 mL容量瓶中并用乙醇定容,從中精密量取1 mL溶液至25 mL的容量瓶中,用“1.2.1”中所述方法配制溶液。以波長510 nm處測量得到的吸光度值來計算總黃酮的得率方程為:

式中:C為待測溶液中總黃酮濃度(mg/mL),Y為總黃酮得率(%)。
1.2.3單因素實驗以超聲時間、料液比、乙醇濃度和提取次數四個因素為研究對象,以檸條錦雞兒總黃酮得率為指標進行單因素實驗。
1.2.3.1超聲時間對總黃酮得率的影響以檸條錦雞兒中的總黃酮得率為指標,在固定料液比1∶30 g/mL、乙醇濃度70%、提取2次的條件下,考察不同超聲時間(20、30、40、50、60 min)對總黃酮得率的影響。
1.2.3.2料液比對總黃酮得率的影響以檸條錦雞兒中的總黃酮得率為指標,在固定超聲時間40 min、乙醇濃度70%、提取2次的條件下,考察不同料液比(1∶10、1∶20、1∶30、1∶40、1∶50 g/mL)對總黃酮得率的影響。
1.2.3.3乙醇濃度對總黃酮得率的影響以檸條錦雞兒中的總黃酮得率為指標,在固定料液比1∶30 g/mL、超聲時間為40 min、提取2次的條件下,考察不同乙醇濃度(50%、60%、70%、80%、90%)對總黃酮得率的影響。
1.2.3.4提取次數對總黃酮得率的影響以檸條錦雞兒中的總黃酮得率為指標,在固定料液比1∶30 g/mL、超聲時間為40 min、乙醇濃度為70%的條件下,考察不同提取次數(1次、2次、3次)對總黃酮得率的影響。
1.2.4響應面法優化檸條錦雞兒總黃酮提取工藝在單因素實驗結果基礎上,按照Box-Benhnken 中心組合實驗設計原理,采用Design-Expert 8.05b軟件設計響應面實驗。本實驗選擇超聲時間(A)、料液比(B)、乙醇濃度(C)三個因素為考察因素,因素水平見表1。

表1 因素水平編碼
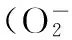
1.2.5.1對羥基自由基(·OH)的清除實驗測定方法參考相關文獻[13-14],取一支10 mL容量瓶,依次加入1 mL 6 mmol/L H2O2溶液、2 mL 2 mmol/L FeSO4溶液、4 mL 6 mmol/L水楊酸乙醇溶液,蒸餾水定容,混合均勻,在37 ℃水浴環境下靜置20 min,于510 nm波長處測定吸收波長A0。取5支10 mL量瓶依次編號為1~5,依次加入濃度為0.2、0.4、0.6、0.8、1.0 mg/mL的檸條錦雞兒總黃酮提取液,然后嚴格按照測定A0的操作步驟分別加入同劑量相同試劑,蒸餾水定容至10 mL,置于37 ℃水浴環境下保溫20 min,在510 nm波長處測定吸收波長Ax。另取5支10 mL容量瓶按照測定Ax操作分別加入檸條錦雞兒總黃酮提取液,以蒸餾水代替上述混合溶液做為對照實驗組,嚴格按照測定A0操作進行實驗,于510 nm測定吸收波長Ax0。
樣品溶液對(·OH)清除率計算公式:[1-(Ax-Ax0)/A0]×100%
式中:A0-空白組溶液的吸光度值;Ax-樣品組吸光度值;Ax0-對照組吸光度值。
式中:A0-空白組溶液的吸光度值;Ax-樣品組吸光度值;Ax0-對照組吸光度值。
1.2.5.3對DPPH·自由基的清除實驗測定方法參考相關文獻[13,16-17]。DPPH·儲備液的準備:稱取1,1-二苯基-2-三硝基苯肼5.0 mg,加無水乙醇進行溶解后定容于50 mL量瓶中,混合均勻。取六支10 mL量瓶按照1~6進行編號,均加入5.0 mL DPPH·儲備液,加入自0.0~2.0 mg/mL以0.4 mg/mL為單位濃度梯度的檸條錦雞兒總黃酮溶液,無水乙醇溶液定容,于暗處放置30 min,在517 nm波長下測定吸收波長A0及Ax。另取5支10mL容量瓶,嚴格按照測定Ax步驟,用無水乙醇溶液代替DPPH·儲備液做對照實驗組,測定Ax0。
樣品溶液對DPPH·清除率按以下公式計算:[1-(Ax-Ax0)/A0]×100%
式中:A0-空白組溶液的吸光度值;Ax-樣品組吸光度值;Ax0-對照組吸光度值。
1.2.5.4對ABTS+自由基的清除實驗測定方法參考相關文獻[18-19]。ABTS+儲備液的配制:2.45 mmol/L過硫酸鉀與7.00 mmol/L ABTS溶液等量均勻混合,黑暗放置反應15 h。向生成的ABTS+溶液中加入無水乙醇,以期于734 nm獲得值為0.70±0.02的吸收值。取六支10 mL量瓶并編號1~6,均加入8.0 mL ABTS+儲備液,再分別加入濃度為0.0 mg/mL至1.0 mg/mL以0.2 mg/mL為濃度梯度的檸條錦雞兒總黃酮溶液,加無水乙醇進行定容,在30 ℃室溫靜置10 min,于734 nm處測定吸收波長A0及Ax。另取5支10 mL容量瓶嚴格按照測定Ax步驟,用無水乙醇代替ABTS+儲備液做對照實驗組,測定Ax0。
樣品溶液對ABTS+清除率按照以下公式計算:[1-(Ax-Ax0)/A0]×100%
式中:A0-空白組溶液的吸光度值;Ax-樣品組吸光度值;Ax0-對照組吸光度值。
1.3數據處理
運用Microsoft Excel(Office 2010)及Design-Expert 8.05b軟件進行數據整理及分析。
2 結果與分析
2.1蘆丁標準曲線的繪制
以蘆丁對照品溶液濃度(mg/mL)(C)為橫坐標、吸光度值(A)為縱坐標繪制標準曲線。得到回歸方程為:A=6.0228C-0.0128,r=0.9997,線性范圍為 0.0044~0.0222 mg/mL,線性關系良好。
2.2單因素實驗結果
2.2.1超聲時間的選擇圖1表明,20~40 min內得率隨超聲時間的增加而增大,在超聲時間40 min時,檸條錦雞兒總黃酮的得率出現最優值;當繼續增加超聲提取時間,得率略有下降,可能是由于增加超聲時間黃酮類化合物已漸達飽和、不再明顯溶出,并且隨著超聲時間的延長,植物細胞膜逐漸被破壞,其中的粘液等雜質溶出使提取液粘度增大,影響了提取效果[20]。因此,選擇超聲提取時間為30~50 min進行Box-Behnken實驗設計。

圖1 超聲時間對檸條錦雞兒總黃酮得率的影響Fig.1 The effect of times of extraction on the yield of total flavonoids
2.2.2料液比的選擇圖2可見,料液比對檸條錦雞兒總黃酮得率的影響較大,隨溶劑量的增加總黃酮的得率也增加,當料液比達到1∶30 g/mL時得率最大,繼續增加溶劑量后得率反而有所降低,原因有可能是:料液比過小,黃酮溶解不充分;料液比過大,則樣品中一些非黃酮類的化合物溶解度增大,與黃酮類化合物競爭性溶出,從而干擾黃酮的提取使其得率減小[13]。故選擇料液比為1∶20~1∶40 g/mL進行Box-Behnken實驗設計。

圖2 料液比對檸條錦雞兒總黃酮得率的影響Fig.2 The effect of solid/liquid ratio on the yield of total flavonoids
2.2.3乙醇濃度的選擇圖3表明,當乙醇濃度在50%~80%之間,檸條錦雞兒總黃酮的得率隨濃度增加而增大;當乙醇濃度為80%時總黃酮得率達到最大,繼續增加乙醇濃度,總黃酮得率呈現下降趨勢。原因可能是由于隨著乙醇濃度增大,黃酮類化合物達到飽和,同時一些親脂性強的色素、雜質等成分溶出量增加,這些成分與黃酮類化合物競爭性溶出,從而導致黃酮類化合物得率下降[21]。本實驗選取乙醇濃度為70%~90%進行Box-Behnken實驗設計。

圖3 乙醇溶液濃度對檸條錦雞兒總黃酮得率的影響Fig.3 The effect of ethanol concentration on the yield of total flavonoids
2.2.4提取次數的選擇圖4表明,提取次數為3次時,檸條錦雞兒總黃酮的得率有最大值,但提取2次與提取3次的差別不大,而且能耗大大增加,從實驗時間和試劑成本方面考慮,選擇提取次數2次較為合適。

圖4 提取次數對檸條錦雞兒總黃酮得率的影響Fig.4 The effect of times of extraction on the yield of total flavonoids
2.3響應面實驗與結果
2.3.1響應面法確定檸條錦雞兒總黃酮的較優提取條件以A:超聲時間(min)、B:料液比(g/mL)、C:乙醇濃度(%)作為自變量,以檸條錦雞兒總黃酮得率Y(%)作為其響應值,響應面分析實驗方案及結果見表2。

表2 Box-Behnken實驗設計及結果
采用Design-Expert 8.05b軟件對表2中數據進行多項式擬合回歸,建立多元二次響應面回歸模型:Y(%)=3.72+0.081A+1.875×10-3B-0.12C+0.077AB+0.059AC+2.000×10-3BC-0.10A2-0.11B2-0.11C2,實驗因素對響應值的影響不是簡單的線性關系,A、C、AB、AC、A2、B2、C2對得率Y 的影響非常顯著。表3回歸統計分析結果表明:模型的F=60.92,p<0.0001,表明實驗的二次模型是非常顯著的,具有統計學意義。失擬項p值=0.0802>0.05,相關系數R2=0.9874,說明所得方程與實際擬合中非正常誤差所占比例小,即失擬項是不顯著的。結果顯示此模型與實際實驗擬合較好,可以很好地描述所得實驗結果,真實的實驗點用該方程代替進行分析是具有可行性的。通過F值可知,各單因素對檸條錦雞兒總黃酮得率的影響程度大小依次為:乙醇濃度>超聲時間>料液比;每兩因素交互作用對檸條錦雞兒總黃酮得率的影響因素大小依次為:超聲時間和料液比>超聲時間和乙醇濃度>料液比和乙醇濃度。

表3 響應面設計回歸方程的方差分析
注:*表示顯著性差異,p<0.05;**為極顯著性差異,p<0.01。根據該模型繪制出各交互因素響應曲面圖見圖5。從圖5a可看出,響應面坡度較陡,響應值隨超聲時間的變化率大于料液比的變化率,說明二者在交互作用中超聲時間對總黃酮得率的影響大于料液比。同理,從圖5b中可知乙醇濃度對總黃酮得率的影響大于超聲時間;從圖5c中可知乙醇濃度對總黃酮得率的影響大于料液比。觀察對比圖5a、圖5b和圖5c中響應面的坡度和等高線,圖5a中響應面的坡度最陡,其等高線也更趨向于橢圓形,說明超聲時間和液料比的交互作用最為顯著;圖5b中響應面的坡度較緩,其等高線也較圓,說明超聲時間和乙醇濃度有較顯著的交互作用但弱于超聲時間和液料比;圖5c中響應面最為平緩,其等高線也更趨向于圓形,說明料液比和乙醇濃度的交互作用較不顯著。總之,此結果與模型中F值分析結果一致。
Design-Expert程序模擬出來的RSM結果顯示,檸條錦雞兒總黃酮的較優提取工藝為:超聲時間42.61 min、料液比1∶30.98 g/mL、乙醇濃度75.12%;總黃酮得率的預測值為3.762%。

圖5 各提取因素之間的交互作用影響響應面圖Fig.5 Response surface plots showing the mutual effects of different factors on the yield of total flavonoids
2.3.2驗證實驗根據實驗實際操作情況,將實驗條件設置為:超聲提取時間43 min、料液比1∶30 g/mL、乙醇濃度75%,進行3次重復實驗(見表4)。計算得總黃酮得率的平均值為3.743%,RSD為0.94%,與模型總黃酮得率的預測值3.762%相比,誤差僅0.5%,說明響應面優化得到的提取工藝條件可靠性高,可預測性好。

表4 工藝驗證結果
2.4抗氧化性實驗的結果分析
2.4.1對羥基自由基(·OH)的清除實驗結果根據圖6能夠得知,檸條錦雞兒總黃酮對羥基自由基(·OH)有顯著的清除效果。在受測濃度范圍內,其清除羥基自由基(·OH)的作用比相同濃度的VC要略強,且隨著檸條錦雞兒總黃酮溶液濃度的增加,清除率不斷增加,檸條錦雞兒總黃酮濃度為1.0 mg/mL時清除率不再有明顯的增加,清除率達90%。

圖6 檸條錦雞兒總黃酮對羥基自由基清除Fig.6 Scavenging effects of total flavonoids on ·OH

圖7 檸條錦雞兒總黃酮對超氧自由基清除Fig.7 Scavenging effects of total flavonoids on ·
2.4.3對DPPH·的清除實驗結果根據圖8能夠得知,在受測濃度范圍內,VC對DPPH·始終保持很明顯的清除作用,都能達到95%以上;檸條錦雞兒總黃酮對DPPH·的清除效果也較顯著,但明顯弱于VC,其清除率隨總黃酮濃度增大不斷增加,檸條錦雞兒總黃酮濃度接近于0.8 mg/mL時清除率不再有明顯的增加,濃度為1.0 mg/mL時清除率達40%以上。

圖8 檸條錦雞兒總黃酮對DPPH·的清除Fig.8 Scavenging effects of total flavonoids on DPPH·
2.4.4對ABTS+自由基的清除實驗的結果按照“1.2.5.4”中所述方法計算出ABTS+自由基得清除率,結果如圖9。圖9顯示,在受測濃度范圍內,VC對ABTS+自由基有很強的清除作用,0.6 mg/mL以后清除率就保持在90%以上;檸條錦雞兒總黃酮對ABTS+自由基的清除作用相對弱于VC,但依然有著較為明顯的清除作用,在濃度達到0.8 mg/mL時清除效果最佳,清除率達到76%。隨著總黃酮濃度進一步增大,對ABTS+自由基清除率又有所降低,這種情況分析認為與“2.4.2”中的情況原因類似,但具體原因仍待進一步求證。

圖9 檸條錦雞兒總黃酮對ABTS+自由基清除Fig.9 Scavenging effects of total flavonoids on ABTS+
3 結論
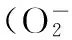
[1]牛西午.中國錦雞兒屬植物資源研究-分布及分種描述[J].西北植物學報,1999,19(5):107-133.
[2]關林婧,馬成倉.21世紀錦雞兒屬植物研究進展[J].草地學報,2014(4):697-705.
[3]中國科學院中國植物志編輯委員會.中國植物志(第24卷)[M].北京:科學出版社,1993:161.
[4]Yang H Y,Song X L,Yuan T Q,et al. Fractional Characterization of Hemicellulosic Polymers Isolated fromCaraganakorshinskiiKom[J]. Industrial & Engineering Chemistry Research,2011,50(11):6877-6885.
[5]強偉,胡娜,韓麗娟,等.檸條錦雞兒籽油體外抗真菌作用及其機制研究[J].天然產物研究與開發,2012,24(11):1614-1617.
[6]Zhong C,Wang R,Zhou Z,et al. Functional Properties of Protein Isolates fromCaraganakorshinskiiKom. Extracted by Three Different Methods[J]. Journal of Agricultural & Food Chemistry,2012,60(41):10337-10342.
[7]劉紅霞,林文翰,楊峻山.錦雞兒屬植物化學成分及藥理作用研究進展[J].中國藥學雜志,2004(5):14-17.
[8]方一杰,徐巖成,安毛毛,等.黃酮類化合物的藥動學和藥理作用研究進展[J].藥學服務與研究,2015(1):6-9.
[9]陳紅梅,謝翎.響應面法優化半枝蓮黃酮提取工藝及體外抗氧化性分析[J].食品科學,2016(2):45-50.
[10]Zhong C,Sun Z,Zhou Z,et al. Chemical Characterization and Nutritional Analysis of Protein Isolates fromCaraganakorshinskiiKom.[J]. Journal of Agricultural & Food Chemistry,2014,62(14):3217-3222.
[11]張華,特布沁,包玉英.不同方法對檸條錦雞兒中總黃酮含量測定的影響[J].安徽農業科學,2013,41(1):318-318.
[12]龐庭才,胡上英,鐘秋平,等.響應面法優化超聲輔助提取銀葉樹果殼黃酮的工藝[J].中藥材,2014(12):2289-2293.
[13]許遠,魏和平,吳彥,等.響應面優化襄荷總黃酮提取及抗氧化研究[J].食品工業科技,2015(5):233-239.
[14]胡琴,齊云,許利平,等.葛根黃酮的體外抗氧化活性研究[J].中藥藥理與臨床,2007(6):29-31.
[15]陸曉婷,張超,張暉,等.黑籽瓜種子蛋白酶解工藝及抗氧化性研究[J].食品科技,2015(5):73-78.
[16]徐秀泉,虞倩,徐穎,等.趕黃草總黃酮超聲提取工藝的響應面法優化及其體外抗氧化活性分析[J].中國實驗方劑學雜志,2012,18:38-41.
[17]徐運飛,劉琴,宋珅,等.響應面法優化黃參多糖的提取工藝及其體外抗氧化活性[J].天然產物研究與開發,2015,12:2116-2123.
[18]段宙位,竇志浩,何艾,等.青金桔皮中多酚的提取及其抗氧化性研究[J].食品工業科技,2015(10):244-248.
[19]鄭朋朋,李珊,戚麗蓉,等.山楂多糖的提取及其抗氧化性作用[J].中國釀造,2015(6):107-113.
[20]劉偉,何曉燕,陳文強,等.響應面優化野生櫻桃李葉總黃酮的超聲輔助提取工藝[J].天然產物研究與開發,2015,v.2710:1765-1770.
[21]王宗成,蔣玉仁,劉小文,等.響應面優化生姜莖葉總黃酮提取工藝及其抗氧化活性研究[J].天然產物研究與開發,2015,v.2709:1582-1588.
[22]井樂剛,路芳,張永忠.大豆異黃酮的抗氧化活性[J].食品與發酵工業,2004(2):62-65.
Optimization of extraction of total flavonoids fromCaraganakorshinskiikom with ultrasound technology by response surface analysis and evaluation of its antioxidant activityinvitro
KOU Liang1,2,LI Lu1,2,LU Li-na1,2,KANG Shu-he1,2,*
(1.Chemical Engineering College of Northwest University for Nationalities,Lanzhou 730030,China; 2.Key Laboratory for Utility of Environment-friendly Composite Materials and Biomass in Universities of Gansu Province,Lanzhou 730030,China)

Caraganakorshinskiikom;flavonoids;response surface methodology;ultrasonic-assisted extraction;antioxidant activity
2016-03-03
寇亮(1983-),男,碩士,實驗師,研究方向:藥物化學及天然有機化學,E-mail:kouliang83@163.com。
康淑荷(1972-),女,碩士,副教授,主要從事天然藥物的研究與開發,E-mail:523429214@163.com。
中央高校基本科研業務費專項資金項目(31920160049)。
TS201.2
B
1002-0306(2016)17-0225-07
10.13386/j.issn1002-0306.2016.17.036

