唑來膦酸對結腸癌細胞株CT26增殖、凋亡的影響及其機制探討
朱勁華,張威,劉美輝,劉元芬,李佳慧,張奕婷,王勇
(1江蘇建康職業學院臨床與護理學院,南京211800;2南京大學金陵學院化學與生命科學學院;3南京大學江蘇省醫學分子技術重點實驗室)
?
·論著·
唑來膦酸對結腸癌細胞株CT26增殖、凋亡的影響及其機制探討
朱勁華1,張威1,劉美輝1,劉元芬1,李佳慧2,張奕婷3,王勇3
(1江蘇建康職業學院臨床與護理學院,南京211800;2南京大學金陵學院化學與生命科學學院;3南京大學江蘇省醫學分子技術重點實驗室)
目的觀察唑來膦酸(ZOL)對結腸癌細胞株CT26增殖、凋亡及Caspase-3、p53蛋白表達的影響。方法①ZOL對CT26細胞增殖的影響觀察:將CT26細胞分為對照組和實驗組,實驗組細胞分別加入1、20、50、120、150、250 μmol/L的ZOL,對照組不加ZOL,采用MTS法測算細胞增殖率。②ZOL對CT26細胞凋亡的影響觀察:加入終濃度分別為0、1、10、100、200、300 μmol/L的ZOL孵育CT26細胞24 h,采用流式細胞術測算細胞凋亡率。③ZOL對CT26細胞中Caspase-3、p53蛋白表達的影響觀察:將CT26細胞分為實驗組與對照組,實驗組加入終濃度為200 μmol/L的ZOL,對照組不加ZOL,分別于12、24、36、48 h后采用Western blotting法檢測Caspase-3、p53蛋白。結果1、20、50、120、150、250 μmol/L的ZOL處理CT26細胞后,細胞增殖率分別為83%、68%、65%、61%、59%、55%,20、50、120、150、250 μmol/L組與1 μmol/L組相比,P均<0.05。0、1、10、100、200、300 μmol/L的ZOL作用后,CT26細胞凋亡率分別為9%、23.06%、23.73%、26.12%、27.15%,1、10、100、200、300 μmol/L組與0 μmol/L組相比,P均<0.05;實驗組加藥36、48 h后,細胞中Caspase-3、p53蛋白相對表達量高于對照組(P均<0.05)。結論ZOL可抑制結腸癌細胞存活,促進其凋亡,作用機制可能與上調Caspase-3、p53蛋白表達有關。
唑來膦酸;結腸癌;結腸癌細胞;細胞增殖;細胞凋亡;含半胱氨酸的天冬氨酸蛋白水解酶3;p53蛋白
唑來磷酸(ZOL)主要應用于治療骨質疏松癥、變形性骨炎、惡性腫瘤骨轉移等引起的高鈣血癥和骨痛癥等[1~5]。近年研究[6~10]發現,ZOL不僅可以減輕肺癌、乳腺癌、腎細胞癌、前列腺癌骨轉移瘤導致的疼痛,減少骨質破壞,還可延長患者的生存期。結腸癌發生發展過程與細胞的惡性轉變及過度增殖有關,也受細胞凋亡減少的影響。Caspase-3是細胞凋亡的關鍵蛋白酶[11]。研究[12]表明,Caspase-3和p53在大腸癌發生、發展中發揮一定作用,與大腸癌患者的預后有關。本研究選用結腸癌細胞株CT26制作體外腫瘤模型,觀察ZOL對CT26細胞增殖、凋亡及Caspase-3、p53蛋白表達的影響,旨在探討ZOL的體外抗腫瘤作用機制。
1 材料與方法
1.1細胞、材料與儀器人結腸癌細胞株CT26(美國模式培養物集存庫)培養于DMEM培養基(含10%胎牛血清、鏈霉素100 μmol/L,青霉素100 U/mL),置于5% CO2、37 ℃、飽和濕度的培養箱中培養至對數生長期;唑來膦酸,Annexin-V FITC和PI雙染試劑盒,胰蛋白酶,PBS緩沖液,10×binding buffer,medium(含FBS),裂解液,蛋白上樣緩沖液;超凈工作臺,離心機,37 ℃培養箱,倒置顯微鏡,細胞計數板,6孔板,96孔板,酶聯免疫檢測儀,流式細胞儀,SDS-PAGE電泳儀,電泳槽,轉膜儀,搖床,成像儀等。
1.2ZOL對CT26細胞增殖的影響觀察取對數生長期的CT26細胞(8×103/mL),按每孔100 μL接種到96孔培養板中,將細胞分為對照組和實驗組。對照組加入100 μL的培養液;實驗組細胞加入終濃度分別為1、20、50、120、150、250 μmol/L的ZOL;另設1個空白組,無細胞,僅加200 μL的培養液。每組設10個復孔。培養24 h后用MTS法檢測每孔吸光度值(OD值)。細胞增殖率=(實驗組OD值-空白組OD值)/(對照組OD值-空白組OD值)×100%。
1.3 ZOL對CT26細胞凋亡的影響觀察加入終濃度分別為0、1、10、100、200、300 μmol/L孵育CT26細胞24 h,用含有EDTA的胰蛋白酶消化細胞獲得單細胞懸液,用預冷的PBS洗滌后,每管加入1×binding buffer重懸細胞;多聚甲醛固定,每管加入5 μL的Annexin-V FITC和500 μL的PI混勻,避光孵育15 min;以400 μL的1×binding buffer重懸細胞,流式細胞儀檢測凋亡細胞。
1.4ZOL對CT26細胞中Caspase-3、p53蛋白表達的影響觀察采用Western blotting法。將CT26細胞分為實驗組與對照組,實驗組加入終濃度為200 μmol/L的ZOL,對照組不加ZOL。分別于12、24、36、48 h后分離CT26細胞質,提取總蛋白。取20 μL的細胞質總蛋白上樣于10% SDS-PAGE膠,轉到PVDF膜;以BSA封閉1 h后割下條帶,在膜上做標記,加入GAPDH和Caspase-3、p53一抗,孵育過夜,洗膜后孵育相應二抗;用ECL顯色,曝光,計算蛋白相對表達量。
2 結果
2.1ZOL對CT26細胞增殖的影響1、20、50、120、150、250 μmol/L的ZOL處理CT26細胞后,細胞增殖率分別為83%、68%、65%、61%、59%、55%,隨著ZOL作用濃度增高,細胞增殖率下降,其中20、50、120、150、250 μmol/L組與1 μmol/L組相比,P均<0.05。
2.2ZOL對CT26細胞凋亡的影響0、1、10、100、200、300 μmol/L的ZOL作用后,CT26細胞凋亡率分別為9%、23.06%、23.73%、26.12%、27.15%,隨著ZOL作用濃度增高,細胞凋亡率上升,其中1、10、100、200、300 μmol/L組與0 μmol/L組相比,P均<0.05。
2.3ZOL對CT26細胞中Caspase-3、p53蛋白表達的影響實驗組加藥36、48 h后,細胞中Caspase-3、p53相對表達量高于對照組(P均<0.05)。詳見表1。
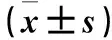
表1 兩組CT26細胞中Caspase-3、p53蛋白相對表達量比較
注:與對照組相比,*P<0.05。
3 討論
ZOL能抑制因破骨活性增加導致的骨吸收,因其具有雙磷酸鹽結構,對骨具有較強的親和力。但是,在肺癌、乳腺癌、前列腺癌等多種腫瘤的臨床治療中,ZOL不僅可以減輕患者骨轉移腫瘤導致的疼痛,減輕骨質破壞,還能延長患者的總生存期(OS)和無事件生存期(PFS)。對這一現象進行深入研究后,有學者發現ZOL在骨組織可通過抑制甲羥戊酸途徑,阻滯細胞周期從而誘導破骨細胞和單核細胞前體細胞凋亡,達到抑制骨吸收的目的。而在腫瘤組織中,ZOL能阻斷腫瘤細胞產生的各種刺激因子,誘導鈣離子釋放,減緩骨轉移的發生和發展,還可誘導多種腫瘤細胞發生凋亡,具有直接的體內外抗腫瘤作用。
本研究分別觀察了ZOL對CT26細胞增殖、凋亡的影響,結果發現,隨著ZOL作用濃度增高,細胞增殖率下降,其中20、50、120、150、250 μmol/L組低于1 μmol/L組;隨著ZOL作用濃度增高,細胞凋亡率上升,其中1、10、100、200、300 μmol/L組高于0 μmol/L組。這提示不同濃度的ZOL均可抑制CT26存活并誘導其凋亡,且隨著ZOL濃度增高,作用更明顯。
腫瘤的發生、發展與細胞過度增殖和凋亡減少有關。目前已明確的細胞凋亡相關信號轉導通路包括Fas/FasL通路、Caspase家族通路、細胞色素C信號轉導通路和線粒體通路。在這些信號通路中,Caspase家族通路被認為是非常重要的。Caspase-3是Caspase家族最重要的成員,可以與許多不同的底物發生反應,是多種凋亡途徑的共同下游效應部分。Caspase-3在許多組織和細胞中一般以非活性狀態的酶原形式存在,受到多種凋亡信號刺激后,剪切成有活性的c-Caspase-3蛋白從而啟動細胞凋亡[13]。p53基因在防止細胞過度增殖及保持DNA受損基因組的完整性上都有重要作用,其表達增加可直接引起細胞凋亡,也可通過調節其他凋亡相關基因表達,間接導致細胞凋亡[14~16]。為進一步研究ZOL抑制結腸癌細胞增殖、誘導凋亡的機制,我們觀察了ZOL對CT26細胞中凋亡相關蛋白表達的影響,結果發現,實驗組加藥36、48 h后,細胞中Caspase-3、p53相對表達量高于同時點對照組,提示ZOL可能是通過調節凋亡相關蛋白Caspase-3、p53從而發揮促進細胞凋亡的作用,且這種作用可能呈時間依賴性。
結合上述研究結果,我們認為,ZOL在體外能有效抑制CT26細胞增殖,并誘導細胞凋亡,ZOL的抗腫瘤機制可能是通過激活p53/Caspase-3信號通路、促進結腸癌細胞凋亡實現的。關于ZOL能否作為治療結腸癌的輔助藥物及ZOL的作用機制仍需進一步研究。
[1] Narechania S, Thiruchelvam N, Lokhande C, et al. Prolonged zoledronic acid-induced hypocalcemia in hypercalcemia of malignancy[J]. J Community Support Oncol, 2015,13(10):374-377.
[2] Al-Agha AE, Hayatalhazmi RS. Osteoporosistreatment with zoledronic acid in pediatric population at a university hospital in Western Saudi Arabia. A 13-year experience[J]. Saudi Med J, 2015,36(11):1312-1318.
[3] Grizzo FM, da Silva Martins J, Pinheiro MM, et al. Pregnancy and Lactation-Associated Osteoporosis: Bone Histomorphometric Analysis and Response to Treatment with Zoledronic Acid[J]. Calcif Tissue Int, 2015,97(4):421-425.
[4] Baykan EK, Saygili LF,Erdogan M, et al. Efficacy of zoledronic acid treatment in Paget disease of bone[J]. Osteoporos Int, 2014,25(9):2221-2223.
[5] Costa L, Lipton A, Hadji P. Treatment of bone metastases before the onset of pain[J]. Int J Clin Oncol, 2013,18(3):531-538.
[6] Singh T, Kaur V, Kumar M, et al. The critical role of bisphosphonates to target bone cancer metastasis: an overview[J]. J Drug Target, 2015,23(1):1-15.
[7] Kohno N. The treatment for cancer with bone metastases-whether to use zoledorenate or denosumab for bone metastases[J]. Clin Alcium, 2014,24(8):1229-1236.
[8] Luedders DW, Steinhoff J, Thill M. Lack of difference in acute nephrotoxicity of intravenous bisphosphonates zoledronic acid and ibandronate in women with breast cancer and bone metastases[J]. Anticancer Res, 2015,35(3):1797-1802.
[9] Broom RJ, Hinder V, Sharples K. Everolimus and zoledronic acid in patients with renal cell carcinoma with bone metastases: a randomized first-line phase II trial[J]. Clin Genitourin Cancer, 2015,13(1):50-58.
[10] Wirth M, Tammela T, Cicalese V, et al. Prevention of bone metastases in patients with high-risk nonmetastatic prostate cancer treated with zoledronic acid: efficacy and safety results of the zometa euro-pean study(ZEUS)[J]. Eur Urol, 2015,67(3):482-491.
[11] Perraud A, Akil H, Nouaille M, et al. Implications of cleaved caspase 3 and AIF expression in colorectal cancer based on patient age[J]. Oncol Rep, 2012,27(3):1787-1793.
[12] Wan Y, Xin Y, Zhang C, et al. Fermentation supernatants of Lactobacillus delbrueckii inhibit growth of human colon cancer cells and induce apoptosis through a caspase 3-dependent pathway[J]. Oncol Lett, 2014,25(7):1738-1742.
[13] Heravi RE, Hadizadeh F, Sankian M, et al. Cyclooxygenase-2 inhibition by novel bisaryl imidazolyl imidazole derivatives increases Bax/Bcl-2 ratio and upregulates caspase-3 gene expression in Caco-2 colorectal cancer cell line[J]. Genes Genomics, 2012,34(8):199-204.
[14] Morad SA, Madigan JP, Levin JC, et al. Tamoxifen magnifies therapeutic impact of ceramide in human colorectal cancer cells independent of p53[J]. Biochem Pharmacol, 2013,85(6):1057-1065.
[15] Ochiai H, Ohishi T, Tokuyama J, et al. Reevaluation of serum p53 antibody as a tumor marker in colorectal cancer patients[J]. Surg Today, 2012,42(3):164-168.
[16] Pedersen JW, Gentry-Maharaj A, Fourkala EO, et al. Early detection of cancer in the general population:a blinded case-control study of p53 autoantibodies in colorectal cancer[J]. Br J Cancer, 2013,108(16):107-114.
Effects of Zoledronic acid on proliferation and apoptosis of colon carcinoma CT26 cells and its possible mechanism
ZHUJinhua1,ZHANGWei,LIUMeihui,LIUYanfen,LIJiahui,ZHANGYiting,WANGYong
(1JiangSuJianKangVocationalCollege,Nanjing211800,China)
ObjectiveTo investigate the effects of bisphosphonate zoledronic acid (ZOL) on the proliferation and apoptosis of colon cancer cell line CT26 in vitro and its effect on Caspase-3 and p53 protein expression. Methods① the effect of ZOL on the proliferation of colon cancer cell line CT26: CT26 cells were divided into the control and experimental group. The different concentrations of ZOL (1, 20, 50, 120, 150, 250 μmol/L) were added into the experimental group, and no ZOL was added in the control group. The proliferation inhibitory rate of CT26 cells was detected by MTS Colorimetry. ② the effect of ZOL on the apoptosis of colon cancer cell line CT26: CT26 cells were hatched with different concentrations of ZOL (1, 10, 100, 200 and 300 μmol/L). The apoptosis of CT26 cells was detected by flow cytometry. ③ the effect of ZOL on Caspase-3 and p53 protein expression: CT26 Cells were divided into the control and experimental group. ZOL with concentration of 200 μmol/L was added into the experimental group, and no ZOL was added in the control group. Caspase-3 and p53 protein expression was detected by Western blotting at 12, 24, 36 and 48 h after treatment. ResultsThe proliferation rates of CT26 cells treated with different concentrations of ZOL (1, 20, 50, 120, 150 and 250 μmol/L) were 83%, 68%, 65%, 61%, 59% and 55% respectively. Significant difference was found between groups treated with 20, 50, 120, 150 and 250 μmol/L ZOL and group treated with 1 μmol/L (allP<0.05). The apoptosis rates of CT26 cells treated with 0, 1, 10, 100, 200 and 300 μmol/L ZOL were 9%, 23.06%, 23.73%, 26.12% and 27.15%, respectively. Significant difference was found between groups treated with 1, 10, 100, 200 and 300 μmol/L (allP<0.05). After 36 and 48 h, the relative expression of Caspase-3 and p53 protein in the experimental group was higher than that of the control group (allP<0.05). ConclusionZOL could inhibit the growth of CT26 cells and promote its apoptosis, whose mechanism may be related to the up-regulated expression of Caspase-3 and p53 protein.
colon carcinoma; colon cancer cells; cell proliferation; apoptosis; Caspase-3; p53
江蘇省衛生廳科研項目(H201430)。
朱勁華(1973-),女,副教授,碩士,主要研究方向為腫瘤藥物研究與開發。E-mail: zhjh7312@163.com
簡介:張威(1968-),男,碩士研究生,副教授,主要研究方向為腫瘤藥物研究與開發。E-mail: zydzw0810@163.com
10.3969/j.issn.1002-266X.2016.31.001
R78
A
1002-266X(2016)31-0001-03
2016-03-30)

